Пожалуйстаааа помогиии те сделать!) Очень очень надооо срооочно(( Тест по химии очень надооо 1) качественной реакцией на многоатомные спирты является действие реагента: а) аммиачного раствора оксида серебра; б) свежеосажденного Cu(OH)2 в) FeCl3 г) металлического Na 2) сколько перечисленных веществ взаимодействуют с уксусной кислотой: водород, кальций,формальдегид,фенол,бутиловый спирт,азотная кислота, оксид магния,глицерин а)4 б)5 в)3 г)7 3) водородная связь образуется между молекулами а) спирта и воды б) альдегидов в) карбоновых кислот г) спиртов 4) Какой объем оксида углерода(н.у) образуется при сжигании 3 моль этилового спирта а) 44,8л б) 134,4л в)89,6 л г)156,8 л 5) Опишите: а) кислотные свойства карбоновых кислот б) реакции в УВ радикале карбоновых кислот
Ответы
Автор ответа: Ange1ina
5.а) 1) Карбоновые кислоты при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов:
2СН3СООН+Mg=(CH3COO)2Mg+H2
2СН3СООН+CaO=(CH3COO)2Ca+H2O
8.3. Многоатомные спирты (этиленгликоль, глицерин): Химические свойства. ЕГЭ по химии
СН3СООН+NaOH=CH3COONa+H2O
Также карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например: СН3СООН+NaHCO3=CH3COONa+H2CO3
(потом разлагается на углекислый газ и воду)
2) Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):
СН3СООН+CH3CH2OH=CH3COOCH2CH3+H2O
3) При нагревании аммонийных солей карбоновых кислот образуются их амиды:
СН3СООNH4=CH3CONH2+H2O
4) Под действием карбоновые кислоты превращаются в соответствующие хлорангидриды.
СН3СООН+SOCl2=CHCOCl+HCl+SO2
Интересные вопросы
Предмет: Русский язык, автор: Pomogashka
Расставьте запятые и укажите вид подчинения.
Жена шла со мной рядом по дороге и старалась не глядеть на небо, чтобы не видеть падающих звезд, которые почему-то пугали ее.
Сколько он ни напрягал глаз в ту сторону, откуда слышались крики, ничего не мог разглядеть в темноте.
Он видел только, что прежде неподвижные массы французов заколыхались и что налево действительно была батарея.
Сильно билось сердце когда я снова увидел знакомые, родные улицы, места, дома, которые я не видел около четырех лет.
Качественной реакцией на многоатомные спирты является реакция серебряного зеркала
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Если в многоатомных спиртах ОН-группы находятся при соседних атомах углерода, то вследствие взаимного влияния этих групп (–I-эффект одной ОН-группы по отношению к другой), разрыв связи О-Н происходит легче, чем в одноатомных спиртах.
Кислотные свойства
1. С щелочными металлами
Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) вследствие взаимного влияния атомов (-I-эффект ОН-групп) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов.
Качественная Реакция На Многоатомные Спирты.
Видеоопыт «Взаимодействие глицерина с металлическим натрием»
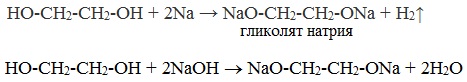
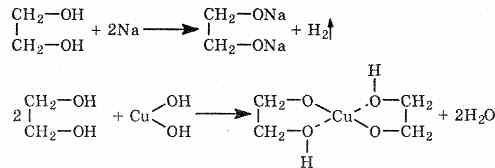
2. С гидроксидом меди(II) — качественная реакция!
Наличие нескольких ОН-групп в молекулах многоатомных спиртов обусловливает увеличение подвижности и способности к замещению гидроксильных атомов водорода по сравнению с одноатомными спиртами. Поэтому, в отличие от алканолов, многоатомные спирты взаимодействуют с гидроксидами тяжелых металлов (например, с гидроксидом меди (II) Cu (OH)2).
Продуктами этих реакций являются комплексные («хелатные») соединения, в молекулах которых атом тяжелого металла образует как обычные ковалентные связи Ме–О за счет замещения атомов водорода ОН-групп, так и донорно-акцепторные связи Ме←О за счет неподеленных пар атомов кислорода других ОН-групп.
При взаимодействии многоатомного спирта с гидроксидом меди (II) в щелочной среде образуется темно-синий раствор (гликолят меди и глицерат меди). Эта реакция является качественной реакцией на многоатомные спирты.
Видеоопыт «Взаимодействие многоатомных спиртов с гидроксидом меди (II)»
Гликолят меди
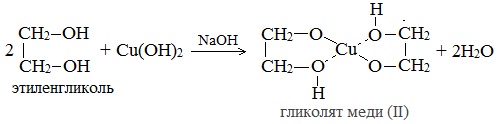
Глицерат меди
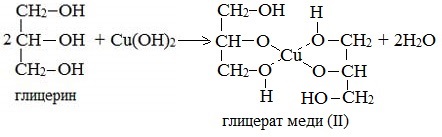
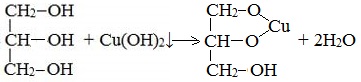
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами.
Многоатомные спирты с несоседними ОН-группами подобны по свойствам одноатомным спиртам (не проявляется взаимное влияние групп ОН).
Основные свойства
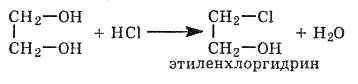
1. С галогенводородными кислотами
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
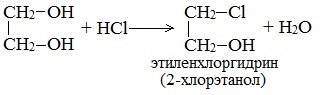
Вторая гидроксогруппа замещается труднее, под действием РСl5.
2. Реакция этерификации (с органическими и неорганическими кислотами)
Многоатомные спирты взаимодействуют с органическими и неорганическими кислотами с образованием сложных эфиров.
С карбоновыми кислотами глицерин образует сложные эфиры – жиры и масла.
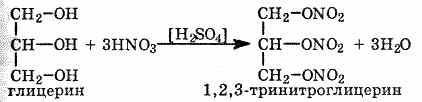
При взаимодействии глицерина с азотной кислотой в присутствии концентрированной серной кислоты образуется нитроглицерин (тринитрат глицерина):
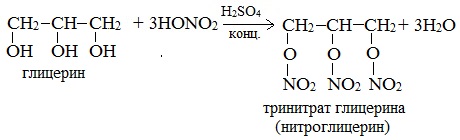
Тринитрат глицерина (тривиальное название – нитроглицерин) – тяжелая маслянистая жидкость, известное взрывчатое вещество (взрывается от легкого сотрясения и нагревания). И одновременно лекарственный препарат (спиртовые растворы его не взрываются): 1% спиртовой раствор нитроглицерина применяется в медицине в качестве средства расширяющего сосуды сердца.
3. Окисление
Видеоопыт «Взаимодействие глицерина с кристаллическим перманганатом калия»
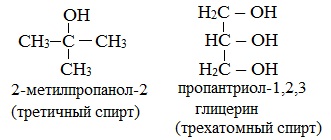
Какая разница между третичным и трехатомным спиртом?
Третичным называется спирт, в котором функциональная группа -ОН связана с третичным атомом углерода. Трехатомным называют спирт, в котором имеется три функциональных группы – ОН.
 Рубрики: Спирты
Рубрики: Спирты  Теги: Спирты
Теги: Спирты
Источник: himija-online.ru
2. Многоатомные спирты и многоатомные фенолы. Строение и реакционная способность. Качественные реакции.
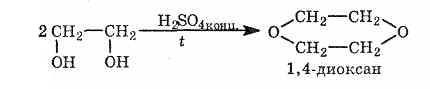
Представители многоатомных спиртов — этиленгликоль и глицерин.
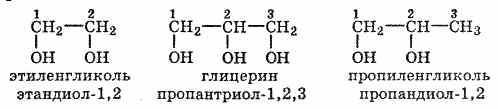
Химические свойства
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп. Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. Например, этиленгликоль реагирует не только с щелочными металлами, но и с гидроксидами тяжелых металлов.
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:
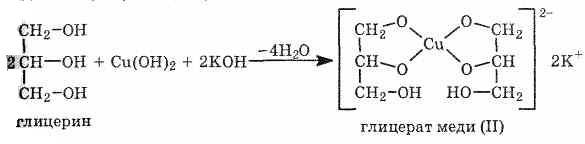
Вторая гидроксогруппа замещается труднее, под действием РСl5. При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение ярко-синего цвета.
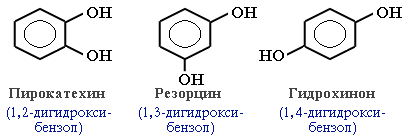
а) Рассмотрим реакции фенола по ОН-группе:
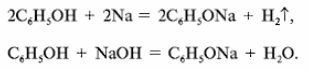
Кислотные свойства у фенола выражены сильнее, чем у спирта С2Н5ОН. Фенол – слабая кислота (карболовая).
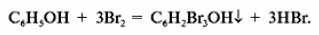
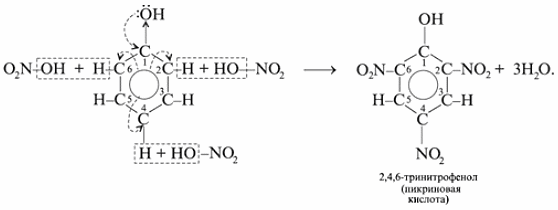
3. Фосфолипиды. Строение, гидролиз, биологическая роль.
ФОСФОЛИПИДЫ , природные липиды, содержащие в молекуле остаток фосфорной к-ты, связанной эфирной связью с производным многоатомного спирта.
Наиб. распространенная группа Ф.- фосфоглицериды общей ф-лы ROCH2CH(OR )СН2ОР(О)(О — )ОХ (R, R — алкил, алкенил, ацил; X = H, CH2CH2N + H3 и др·)· К фосфолипидам относятся также фосфосфинголипиды RCH(OH)CH(NHCOR)CH2OP(O)(O — )OX (R — алкил, алкенил, R — ацил), диольные фосфолипиды RO(CH2)nCH2OP(O)(O — )Х
Молекулы Ф. содержат неполярные гидрофобные «хвосты» и полярную гидрофильную «головку» (остаток фосфорной к-ты), что определяет мн. физ.-хим. св-ва, в т. ч. способность формировать мембраны биологические .
Гидролиз проеткает под действием ферментов. В итоге образуются исходные вещества.
4. Осуществите превращения: 2,2-диметилпропан → 1,1-дихлор-2,2-диметилпропан → 2,2‑диметилпропаналь → гидросульфитное производное 2,2-диметилпропаналя.
1. Влияние индуктивного и мезомерного эффектов на свойства органической молекулы. Приведите примеры.
Индуктивный эффект Индуктивный эффект (I-эффект) — это передача электронного влияния заместителей по цепи σ-связей. Этот эффект передаётся по цепи σ-связей с постепенным затуханием и, как правило, через три — четыре связи он уже не проявляется.
Направление индуктивного эффекта заместителя качественно оценивают, сравнивая с со связью С-Н, пологая её неполярной, а индуктивный эффект водорода равным нулю. Электроотягивающие заместители снижают элекроную плотность в системе σ-связей, и их называют электроноакцепторными.
Элекроноподающие заместители повышают электроннную плотность в цепи σ-связей по сравнению с атомом водорода, т. е. проявляют +I эффект и являются элекронодонорными. К ним относятся атомы с низкой электроотрицательностью (например, металлы), а также отрицательно заряженные атомы или группы, обладающие избытком электронной плотности, которую они стремятся перераспределить на соседние связи. Индуктивный эффект называют отрицательным (–I), если заместитель уменьшает электронную плотность на атоме углерода, с которым связан этот заместитель. При этом заместитель приобретает частичный отрицательный заряд (), а атом углерода — частичный положительный заряд (+). Например:
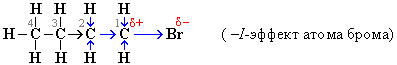
Индуктивный эффект называется положительным (+I), если заместитель увеличивает электронную плотность на атоме углерода, индуцируя на нем частичный отрицательный заряд , сам при этом приобретая заряд . Направление (знак) I-эффекта заместителя качественно оценивается путем сравнения со стандартом — атомом водорода, индуктивный эффект которого принят за 0.
- –I-эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом углерода:
-F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др.
- +I-эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью:
-Mg-, -Li; алифатические углеводородные радикалы (-CH3, -C2H5) и т.п. Мезомерный эффект Мезомерный эффект, или эффект сопряжения (М-эффект), — это передача электронного влияния эаместителей по соряжённой системе. Эффект сопряжения, в отличии от индуктивного эффекта, он передаётся по сопряжённой системе без затухания. 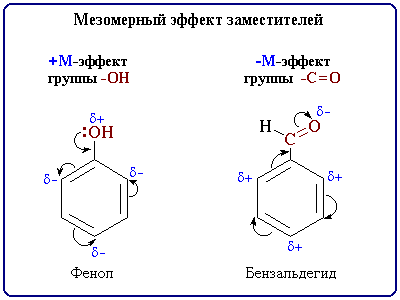 2. Одноосновные гидроксикислоты. Строение и реакционная способность гидроксикислот как бифункциональных соединений. Специфические свойства: элиминирование, внутри- и межмолекулярная циклизация. Биологическая роль гидроксикислот. Молочная, одноосновная, двухатомная
2. Одноосновные гидроксикислоты. Строение и реакционная способность гидроксикислот как бифункциональных соединений. Специфические свойства: элиминирование, внутри- и межмолекулярная циклизация. Биологическая роль гидроксикислот. Молочная, одноосновная, двухатомная 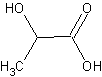 Гомологический ряд начинается с оксимуравьиной или угольной кислоты Н2СО3 или НО-СООН. Затем следует a-оксиуксусная кислота (гликолевая) НОСН2СООН. Реакция элиминирования только под действием ферментов и переносчиков. Смотри нагревание гидрокси кислот.
Гомологический ряд начинается с оксимуравьиной или угольной кислоты Н2СО3 или НО-СООН. Затем следует a-оксиуксусная кислота (гликолевая) НОСН2СООН. Реакция элиминирования только под действием ферментов и переносчиков. Смотри нагревание гидрокси кислот.
Источник: studfile.net