Работа послужит самопроверкой степени усвоения программного материала за курс неорганической и органической химии.
Бекжанова Эльмира Кокешевна
Описание разработки
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА НЕОРГАНИЧЕСКИЕ КИСЛОТЫ( и их соли)
реактив на соляную кислоту и ее соли- нитрат серебра (выпадает осадок белого цвета, который не растворяется ни в воде, ни в кислотах):
реактив на серную кислоту и ее соли- соли бария (выпадает белый осадок не растворяющийся ни в воде, ни в концентрированной кислоте):
реактив на азотную кислоту и ее соли- медные стружки, конц.серная кислота (выделение газа оксида азота (IV) NO2 бурого цвета свидетельствует о наличии нитрат ионов NO3):
4. Синяя лакмусовая бумажка в водном растворе угольной кислоты приобретает не красный, а розовый цвет.
Характерной реакцией на карбонат-ион СО3 является его взаимодействие с ионами водорода Н +
Например: К2СО3+2НСI→2KCI+H2O+ CO2 ↑ (наблюдается характерное «вскипание»).
Реактив на фосфорную кислоту и ее соли- нитрат серебра (I)
Качественная реакция тиосульфат — иона. Реакция раствора тиосульфата натрия с соляной кислотой 🧪
( появляется желтый осадок):
Качественные реакции на органические вещества
качественная реакция на (= ) связь.
Алкены обесцвечивают бромную воду, в результате присоединения атомов брома. Например этилен:
качественная реакция на (≡) связь.
Ацетилен обесцвечивает бромную воду, раствор перманганата калия, т.к. легко окисляется. Присоединение брома происходит в две стадии:
НС≡СН + Br2 → CHBr=CHBr
качественная реакция на ароматические углеводороды (арены).
Бензол очень стоек к окислению. А его гомологи окисляются относительно легко. При действии энергичных окислителей (КмnO4) на гомологи бензола окислению подвергаются только боковые цепи. Если, например, в пробирку налить 2-3 мл толуола, затем добавить к нему раствор перманганата калия и нагреть, то можно заметить, что фиолетовая окраска раствора постепенно обесцвечивается. Это происходит потому, что под действием перманганата калия метильная группа толуола окисляется и превращается в группу −СООН
качественная реакция на одноатомные спирты.
Одноатомные спирты относительно легко окисляются, с образованием альдегидов. Например, если в этанол опустить накаленную медную спираль, покрытую оксидом меди (II), то спираль становится блестящей, появляется специфический, неприятный запах ацетальдегида (уксусный альдегид):
качественная реакция на многоатомные спирты (этиленгликоль и глицерин).
Если к свежеприготовленному гидроксиду меди (II) в присутствии щелочи прилить глицерин и смесь встряхнуть, то осадок растворяется и образуется раствор ярко-синего цвета- глицерат меди (II). Это качественная реакция на многоатомные спирты:
глицерат меди (II)
качественная реакция на фенол.
Для фенола характерна цветная реакция с хлоридом железа (III) (фиолетовое окрашивание).
качественная реакция на альдегиды:
А) реакция «серебряного зеркала»
Восстановленное серебро оседает на стенках пробирки в виде блестящего налета, а альдегид окисляется в соответствующую органическую кислоту:
Реакция азотной кислоты и карбоната кальция, получение нитрата кальция/Obtaining calcium nitrate
R−COH + Ag2O t, аммиачный раствор R−COOH + 2Ag↓
Б) реакция «медного зеркала»
В этой реакции окислителем является медь со степенью окисления +2, которая восстанавливается до степени окисления +1.
качественная реакция только на муравьиную кислоту- реакция
НСООН + Ag2O → HOCOOH + 2Ag↓
Химические понятия и термины
Химия- наука о веществах, их свойствах, превращениях веществ и явлениях, сопровождающих эти явления.
То, из чего состоят физические тела, называется веществом.
Свойствами вещества называют признаки, по которым вещества отличаются друг от друга или сходны между собой.
Важнейшие физические свойства веществ: агрегатное состояние, цвет, плотность, теплопроводность, электрическая проводимость, температура плавления и кипения.
Чистыми называют вещества, которые обладают постоянными физическими свойствами (например, дист.вода).
Однородными называют такие смеси, в которых даже с помощью микроскопа нельзя обнаружить частицы веществ, входящих в смесь.
Неоднородными называют такие смеси, в которых невооруженным глазом или при помощи микроскопа можно заметить частицы веществ, составляющих смесь.
Основные способы разделения смесей (очистки веществ)
А) однородных: выпаривание, кристаллизация, дистилляция, хроматография.
Б) неоднородных: отстаивание, фильтрование, действие магнитом.
Весь материал — в документе.
Содержимое разработки
Министерство образования и науки
Республики Казахстан
АО «Өркен» ИШПП РК ФМН
Дидактический материал по химии
Качественные реакции на неорганические и органические вещества.
Основные химические понятия и термины.
Разработан учителем химии
Бекжановой Э.К.
Дидактический материал разработан учителем химии ИШПП РК ФМН
Бекжановой Э.К.
Дидактический материал рассмотрен и одобрен на заседании МО естественных дисциплин ИШПП.
Протокол № 5 от «16» октября 2009 г
Председатель МО естественных дисциплин:
Советова А.Б.
Целью создания краткого терминологического словаря по химии является помощь учащимся в повторении и степени усвоения программного материала за курс неорганической и органической химии.
Разработанный материал позволяет освоить теоретические вопросы и выработать навыки в выполнении практических заданий.
В данном мини-справочнике по химии основные понятия и термины описаны доступным для понимания учащимися языком, что позволяет им самостоятельно дорабатывать неусвоенный материал по каким-либо темам, без помощи учителя.
Данное пособие может быть использовано учителями при зачетных работах в 9-10 классах в целях закрепления и повторения изученного материала.
Найдя нужный термин, учащийся может продолжить знакомство с темой и понятием уже по учебнику, т.к. объем терминов невелик.
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА НЕОРГАНИЧЕСКИЕ КИСЛОТЫ
- реактив на солянуюкислоту и ее соли- нитрат серебра (выпадает осадок белого цвета, который не растворяется ни в воде, ни в кислотах):
- реактив на серную кислоту и ее соли- соли бария (выпадает белый осадок не растворяющийся ни в воде, ни в концентрированной кислоте):
- реактив на азотнуюкислоту и ее соли- медные стружки, конц.сернаякислота (выделение газа оксида азота (IV) NO2 бурого цвета свидетельствует о наличии нитрат ионов NO3):
- Реактив на фосфорную кислоту и ее соли-
- качественная реакция на (= ) связь.
- качественная реакция на (≡) связь.
- качественная реакция наароматические углеводороды(арены).
- качественная реакция наодноатомныеспирты.
- качественная реакция намногоатомныеспирты(этиленгликоль и глицерин).

-82%
Источник: videouroki.net
Практическая работа № 5 стр. 102 Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов
1) Получение оксида углерода (IV) и определение его свойств
а) Действия: В пробирку кладем несколько кусочков мрамора, добавляем раствор соляной кислоты. Наблюдения: Выделяется газ. Уравнения реакции: 
Выводы: При действии на мрамор соляной кислотой, она вытесняет из карбоната слабую угольную кислоту, которая затем разлагается на H2O и CO2
б) Действия: Конец газоотводной трубки помещаем в пробирку с известковой водой. Наблюдения: Образуется белый осадок, который растворяется. Уравнения реакции: 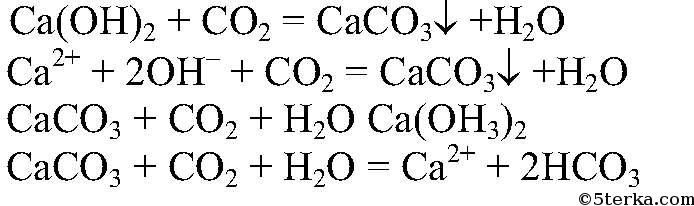
Выводы: При пропускании углекислого газа через известковую воду образуется карбонат кальция, который затем растворяется, превращаясь в гидрокарбонат. в) Действия: Пропускаем углекислый газ через дистиллированную воду. Затем добавляем синий лакмус. Наблюдения: Лакмус краснеет. Уравнения реакции:
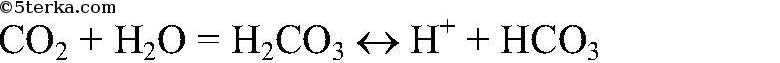
Выводы: Т.к. синий лакмус краснеет, следовательно, при растворении в воде образуется кислота. г) Действия: Наливаем в пробирку разбавленный

добавляем фенолфталеин и пропускаем углекислый газ. Наблюдения: В растворе щелочи фенолфталеин розовеет, при пропускании углекислого газа — обесцвечивается. Уравнения реакции:


Выводы: Идет реакция между

Это еще раз подтверждает кислотные свойства
2) Распознавание карбонатов.
Даны вещества: 
а) Действия: Ко всем веществам добавляем соляную кислоту. Наблюдения: В одной из пробирок выделяется газ. Уравнения реакции: 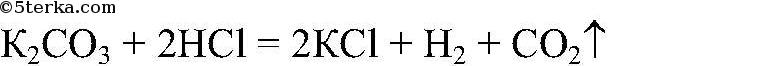

Выводы: В данной пробирке — карбонат калия, это качественная реакция на карбонат-ион. б) Наблюдения: В другой пробирке образ. прозрачный осадок. Уравнения реакции:
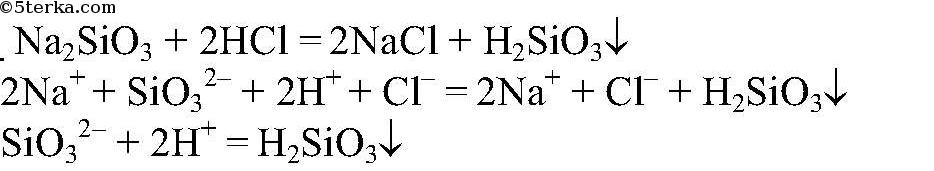
Выводы: В данной пробирке — силикат натрия, т.к. происходит образование нерастворимой кремниевой кислоты. в) Действия: Два оставшихся вещества растворяем водой и добавляем раствор хлорида бария. Наблюдения: В одной из пробирок образовался белый осадок. Уравнения реакции:


Выводы: Это качественная реакция на сульфат-ион, значит, в данной пробирке находится сульфат натрия. г) Действия: В оставшийся р-р добавляем р-р нитрата серебра (I). Наблюдения: Образовался белый осадок. Уравнения реакции:


Выводы: Реакция является качественной на хлорид-ион, следовательно, в данной пробирке — хлорид цинка.
Источник:

Решебник по химии за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
задача №0
к главе «Лабораторные и практические работы».
Источник: 5terka.com