3.4. Работа 3. Гидролиз солей
3.4.1. Цель работы
Изучить гидролиз различных солей. Исследовать влияние температуры на гидролиз.
3.4.2. Реактивы
3.4.3. Оборудование
Мерные колбы на 100 мл, пробирки, конические пробирки, микропипетки, водяная баня, рН-метр.
3.4.4. Порядок выполнения эксперимента
Опыт 10. Гидролиз катиона Al 3+
Согласно методике, описанной в опыте 1, приготовьте из 0,1 М раствора Al2(SO4)3 по 50 мл 0,01 и 0,001 М растворов. Налейте в стаканчики на 1/3 –1/2 объема исходный и приготовленные растворы и измерьте их рН с помощью рН-метра. Результаты занесите в табл. 3.6.
- Напишите уравнение реакции гидролиза Al2(SO4)3.
- Рассчитайте степень гидролиза h, константу гидролиза и константу диссоциации Al(OH)3 по третьей ступени. Результаты занесите в табл. 1.
- Сравните значение константы диссоциации Al(OH)3 по третьей ступени с табличными данными.
- Воспользуйтесь табличным значением константы диссоциации Al(OH)3 по третьей ступени и рассчитайте теоретическое значение pH исследуемых растворов солей Al2(SO4)3. Результаты занесите в табл.1.
- Сравните экспериментально полученные и теоретически рассчитанные значения pH растворов.
- Оцените влияние разбавления на степень гидролиза и pH растворов солей.
Таблица 3.6
Распознавание солей
Опыт 11: Гидролиз аниона NO2 –
Согласно методике, описанной в опыте 1, приготовьте из 0,1 М раствора KNO2 по 50 мл 0,01 и 0,001 М растворов. Налейте в стаканчики на 1/3 –1/2 их объема исходный и приготовленные растворы и измерьте их рН с помощью рН-метра. Результаты занесите в табл. 3.7.
- Напишите уравнение реакции гидролиза KNO2 .
- Рассчитайте степень гидролиза h, константу гидролиза и константу диссоциации HNO2. Результаты занесите в табл. 3/7
- Сравните полученные значения константы диссоциации HNO2 с табличной величиной.
- Воспользуйтесь табличным значением константы диссоциации HNO2 и рассчитайте теоретическое значение pH растворов КNO2 различных концентраций.
- Сравните экспериментально полученные и теоретические рассчитанные значения pH растворов солей.
- Оцените влияние разбавления на степень гидролиза и pH растворов соли КNO2.
Таблица 3.7.
Опыт 12. Определение солей слабых и сильных кислот и оснований по значениям рН растворов
Налейте в стаканчики на 1/3–1/2 объема пять–шесть 0,1 М растворов солей, указанных преподавателем. Определите рН их растворов с помощью рН-метра. Результаты измерения занесите в табл. 3.8.
Таблица 3.8
| Соль |
| рН |
| Выводы |
- Напишите уравнения реакций гидролиза солей.
- Объясните различные значения рН растворов солей.
- Какие ионы в растворах исследованных вами солей проявляют свойства кислот или оснований?
- Рассчитать Кгпо 1 ступени для одной из исследованных солей.
- Вычислите теоретическое значение рН для одной из исследованных солей и сравните его с экспериментальным.
Опыт 13. Равновесия в растворах фосфатов натрия
Эксперимент серебро и перекись водорода (гидроперит)
Налейте в три стаканчика на 1/2 — 1/3 их объема 0,1 М растворы Na3PO4, Na2HPO4, NaH2PO4. Определите рН с помощью рН-метра. Результаты занесите в таблицу 3.9.
- Напишите уравнения реакций гидролиза фосфатов натрия.
- Объясните полученные результаты.
Опыт 14. Необратимый гидролиз
В коническую пробирку налейте приблизительно по 1мл 0,1 М растворов солей FeCl3 и Na2CO3, CrCl3 и Na2CO3 или Al2(SO4)3 и Na2S. Отметьте наблюдаемое.
- Напишите уравнения реакций. Какой газ выделяется?
- Почему гидролиз солей идет до конца?
Опыт 15. Влияние температуры на степень гидролиза ацетата натрия
В две пробирки налейте на четверть их объема 1 М раствор ацетата натрия и добавьте в каждую по 2 капли фенолфталеина. Одну пробирку оставьте в качестве свидетеля, а вторую нагрейте на кипящей водяной бане. Отметьте изменение цвета раствора при нагревании. Охладите пробирку до комнатной температуры и опять отметьте наблюдаемые изменения цвета.
- Напишите уравнение реакции гидролиза ацетата натрия.
- Объясните, почему при нагревании цвет раствора с индикатором изменяется.
- Почему цвет раствора изменяется при охлаждении?
Опыт 16. Влияние температуры на гидролиз хлорида железа (III)
Налейте в пробирку примерно на треть ее объема 0,1 М раствора FeCl3. Поместите пробирку с раствором в кипящую водяную баню, нагревайте до образования коллоидного раствора.
- Напишите уравнение реакции гидролиза.
- Почему нагревание приводит к усилению гидролиза?
3.5. Работа 4. Равновесия в растворах электролитов с участием твердой фазы
3.5.1.Цель работы:
Изучить условия образования и растворения осадков, растворимость осадков солей в растворах кислот, влияние температуры на растворимость солей
3.5.3. Оборудование
Пробирки простые и конические, штатив для пробирок, пипетки капельные, аппарат Киппа, заряженный для получения H2S , центрифуга
3.5.4. Порядок выполнения эксперимента
Опыт 17: Условие образования осадков
В две пробирки налейте по 1 мл 1 М раствора MnSO4. В одну из них прилейте 2–3 капли 6 М (NH4)2S, в другую пропустите сероводород из аппарата Киппа до насыщения раствора (2-3 минуты).Опыт проводить под тягой !
- Напишите уравнения реакций.
- Опишите наблюдаемые явления и обоснуйте их, используя величины ПР и констант диссоциации слабого электролита.
Опыт 18. Растворение сульфидов в кислотах
В 3 пробирки налейте по 1мл 1 М растворов солей MnSO4, ZnSO4, CuSO4. В каждую пробирку добавьте 2-3 капли 6 М (NH4)2S. Отметьте цвета получившихся осадков. В каждую пробирку с осадком прилейте по 1мл 1 М раствора соляной кислоты. Опыт проводится под тягой!
- Напишите уравнения реакций растворения сульфидов марганца, цинка и меди в соляной кислоте.
- Объясните различную растворимость сульфидов в соляной кислоте.
- Рассчитайте константы равновесия реакций растворения сульфидов.
Опыт 19. Растворимость карбонатов кальция в сильных и слабых кислотах
В три пробирки налейте по 1-2 мл 1 М растворов CaCl2 и Na2CO3. В первую пробирку с осадком прилейте приблизительно 1 мл 1 М HCl, во вторую — такой же объем 1 М CH3COOH, в третью — 1 М H2SO4.
- Опишите наблюдаемые процессы.
- Напишите уравнения реакций растворения карбоната кальция в HCl, CH3COOH и H2SO4.
Опыт 20. Растворимость оксалата кальция в сильных и слабых кислотах
В пробирку налейте по 2 мл 1 М растворов CaCl2 и Na2C2O4. Содержимое пробирки разделите на две части. К одной части прибавьте 1 мл 1 М HCl, к другой — 1 мл 1 М CH3COOH.
- Опишите наблюдения.
- Напишите уравнения реакций взаимодействия оксалата кальция с HCl, CH3COOH и H2SO4.
Опыт 21. Растворимость солей в зависимости от температуры
Налейте в две пробирки на треть их объема дистиллированной воды. Затем в одну из них прибавьте кристаллический NaCl, а в другую кристаллический KNO3 до получения насыщенных растворов. Зафиксируйте температуру каждого из полученных растворов (термометром или на ощупь). Поместите обе пробирки в кипящую водяную баню.
- Растворение какой из солей в процессе получения их насыщенных растворов идет с изменением температуры?
- Объясните, что происходит с растворами при их нагревании и почему.
- Используя приведенный здесь рисунок кривых растворимости, объясните более сложный вид зависимости растворимости для Na2SO4.
3.6. Работа 5. Равновесия в растворах электролитов с участием комплексных ионов
3.6.1. Цель работы
Изучить равновесия в растворах электролитов с участием комплексных ионов. Исследовать влияние концентрации и температуры на химическое равновесие реакций с участием комплексных ионов.
3.6.2. Реактивы
Кристаллические NH4Cl, NaCl, KNO3, NaCH3COO; 0,1 М растворы CH3COOH, Co(NO3)2, NH4SCN, FeCl3; 0,1 М спиртовой раствор Co(NO3)2; концентрированные растворы HCl, NH4SCN и FeCl3.
3.6.3. Оборудование
Пробирки простые и конические, штатив для пробирок, капельные пипетки, стаканчики, шпатель, водяная баня.
3.6.4. Порядок выполнения эксперимента
Опыт 23. Равновесия в растворе роданида железа (III)
Налейте в стаканчик 20 мл дистиллированной воды и добавьте по 10 капель 0,1 М растворов FeCl3 и NH4CNS (раствор должен быть светло-красного цвета и прозрачный). Разлейте полученный раствор в 5 конических пробирок. Одну оставьте в качестве свидетеля, а в остальные прибавьте по несколько капель концентрированных растворов FeCl3, NH4SCN и кристаллов NH4Cl, NaCl.
- Запишите выражение для константы равновесия в роданидном растворе железа.
- Объясните, какие из использованных веществ и почему смещают равновесие реакции.
Опыт 24. Равновесие между аква- и хлоридным комплексами кобальта
В одну пробирку налейте 1 мл 0,1 М водного раствора Co(NO3)2, в другую такое же количество 0,1 М спиртового раствора Co(NO3)2. В обе пробирки по каплям прилейте концентрированную соляную кислоту до прекращения изменения окраски раствора. Отметьте количество капель израсходованной кислоты.
- Опишите наблюдаемое.
- Сравните объемы соляной кислоты, необходимые для одинакового изменения окраски водного и спиртового растворов Co(NO3)2, т.е. до одинакового смещения равновесия реакции вправо.
- Объясните, почему для одинакового смещения равновесия в водном и спиртовом растворах Co(NO3)2 потребовалось разное количество HCl. Учтите, что в водно-спиртовых растворах ионы кобальта присутствуют в виде гидратов, а спирт в реакции непосредственно не участвует.
Опыт 25. Последовательное растворение и осаждение осадков солей серебра
Налейте в коническую пробирку 5 капель 0,01 М раствора AgNO3 и добавьте 1 каплю 0,1 М раствора NaCl. К образовавшемуся осадку прибавляйте по каплям раствор аммиака (1:1) до его полного растворения. (Старайтесь избегать избытка NH3•Н2О).
Затем в эту же пробирку добавьте 1 каплю 0,1 М раствора NaBr. Наблюдайте выпадение осадка. Вновь добавьте по каплям раствор аммиака до растворения полученного осадка.
К полученному раствору добавьте 1 каплю 0,1 М раствора NaI, взвесь взболтайте и разделите на 2 части. Отцентрифугируйте осадок. Слейте с осадка жидкость.
В первую пробирку с осадком AgI добавьте по каплям раствор аммиака и убедитесь, что осадок в его избытке не растворяется. Во вторую по каплям добавьте 1 М раствор Na2S2O3 до растворения осадка.
В раствор, полученный во второй пробирке, прилейте 1 каплю 0,1 М раствора Na2S, отцентрифугируйте осадок и попытайтесь растворить его в 1 М растворе Na2S2O3.
- Напишите уравнения реакций, происходивших при образовании и растворении осадков.
- Как влияет избыток раствора аммиака или тиосульфата на равновесия вышеуказанных процессов?
Опыт 26. Влияние температуры на равновесие между аква- и хлоридным комплексами Co (II)
Налейте в пробирку на ~ 1/3 ее объема 0,4 М раствор CoCl2 и, прибавляя по каплям, конц. HCl (примерно до половины объема пробирки), доведите цвет раствора до фиолетового (но не синего!). Полученный раствор разлейте в две пробирки. Одну оставьте в качестве свидетеля. Другую поместите в стакан с горячей водой.
Наблюдайте за изменением цвета раствора. Затем эту же пробирку охладите в стакане со льдом и также отметьте изменение цвета.
- Опишите наблюдаемое.
- Напишите уравнение наблюдаемой реакции.
- В какую сторону смещается равновесие изучаемой реакции при нагревании и охлаждении?
- Экзо- или эндотермична эта реакция?
Источник: www.chemnet.ru
Гидролиз солей
Может показаться, что изучать гидролиз солей сложно, но это не так. Его можно легко понять и запомнить, так как этот процесс происходит по такому же механизму, как и люди обмениваются опытом, знаниями или какими-то предметами.
На этой странице вы узнаете
- Есть ли какая-то связь между гидрой и гидролизом?
- Какие цели ставят себе гидролиз и среда раствора?
- Гидролиз любит слизывать воду?
Что такое гидролиз?
Гидролиз – это взаимодействие молекул воды с ионами растворённого вещества.
То есть вещество при диссоциации дает ионы: катион и анион, эти ионы будут реагировать с молекулами воды. Этот процесс называется гидролизом.
Чего хочет гидролиз
У каждого человека в жизни есть какая-то цель. Кто-то хочет зарабатывать очень много денег, кто-то хочет поступить в лучший вуз, а кто-то поехать летом на море. Удивительно, но у гидролиза тоже есть цель.
Давайте возьмём интервью у гидролиза!
- Добрый день, гидролиз!
- Скажи, пожалуйста, какая у тебя самая большая цель в жизни?
- Хммм… Тут всё очевидно! Я люблю искать слабые точки и бить по ним!
- Вот это да! А как ты определяешь слабые места?
- Часть соли, которая при взаимодействии с водой отдаёт слабый электролит, и будет слабым звеном!
- Кто же их тебе дарит?
- Их мне дарят слабые кислоты или основания.
- Здорово! Неужели у тебя всегда получается находить слабые места в веществах?
- К сожалению, нет. Есть настолько сильные вещества, с которыми я не могу справиться.
- Дорогой Гидролиз, ты из-за этого расстраиваешься?
- Нет! Потому что есть не только абсолютно сильные, но и полностью слабые вещества.
- Круто! Ну тогда я желаю тебе успехов! Уверена, у тебя всё получится!
- Большое спасибо!

Из этого интервью мы крепко запомним: нерастворимые соли гидролизу не подвергаются!
Давайте представим, что мы на пляже, рядом с нами вода, а в воде камни. Камень для нас – нерастворимая соль, которая с водой не способна никак взаимодействовать, потому что она не распадается на ионы. Теперь мы понимаем, почему нерастворимые соли не гидролизуются.
Среды растворов
Давайте теперь поговорим про среды растворов! Это необходимо для того, что понимать, какие ионы содержатся в растворе и в каком количестве. Выделяют три среды: кислую, нейтральную и щелочную.
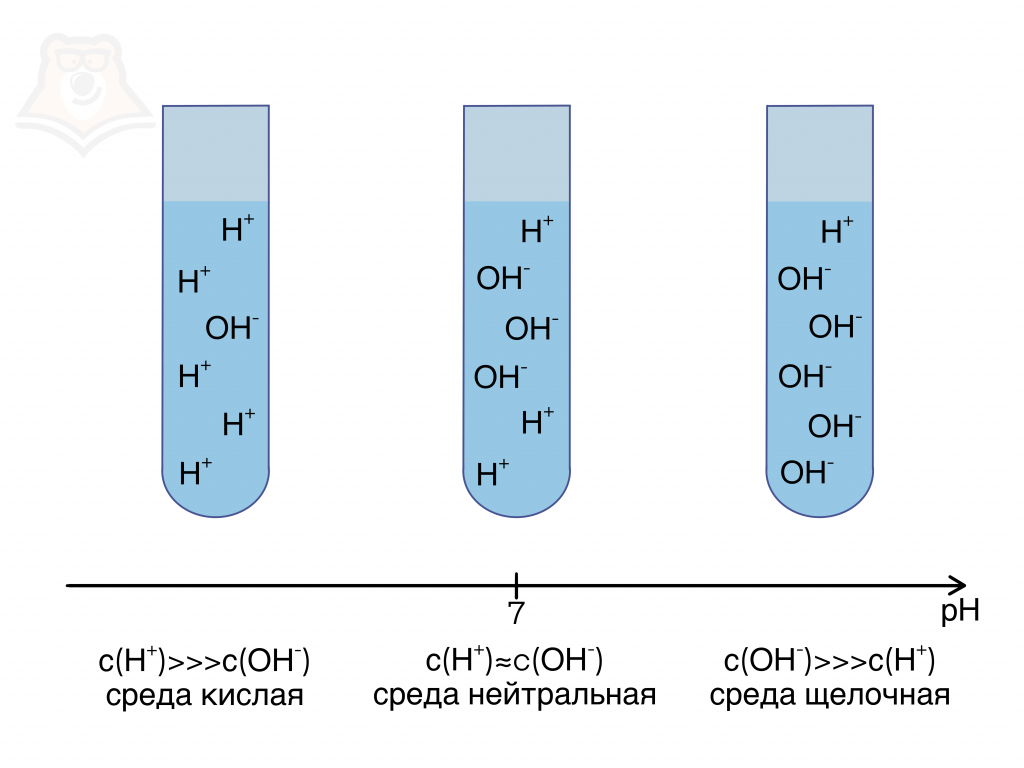
Здесь всё зависит от концентрации ионов водорода.
- Если ионов водорода больше, чем гидроксид-ионов, то среда кислая.
- Если ионов водорода и гидроксид-ионов примерно одинаковое число, то среда нейтральная.
- Если ионов водорода меньше, чем гидроксид-ионов, то среда щелочная.
Концентрацию ионов водорода отражает такая величина, как pH. Ещё её называют водородным показателем. Она обратно пропорциональна концентрации водорода. То есть, чем больше ионов водорода, тем меньше значение pH.
Давайте теперь возьмём интервью у среды, простите, госпожи Среды!
- Привет, Среда!
- Приветик!
- Скажи, пожалуйста, какая у тебя самая большая цель в жизни?
- Хммм… Тут всё очевидно! Я люблю искать сильные точки и бить по ним!
- Вот это да! А как ты определяешь сильные места?
- Часть соли, которая при взаимодействии с водой отдаёт сильный электролит и будет сильным звеном!
- Кто же их тебе дарит?
- Их мне дарят сильные кислоты или основания.
- Здорово! Спасибо тебе за интервью! Удачи!
- Взаимно!

Поговорим теперь про все три среды: кислую, щелочную и нейтральную.
- Если соль образована сильной кислотой и слабым основанием – среда кислая.
- Если соль образована слабой кислотой и сильным основанием – среда щелочная.
- Если соль образована и сильной кислотой, и сильным основанием – среда нейтральная.
Из всего сказанного необходимо сделать один очень важный вывод!
Гидролиз ищет слабую часть, а среда – сильную!
Гидролиз и среда нам всё про себя рассказали. На схемах можно посмотреть всю информацию о четырех случаях, о которых они говорили.




Роль гидролиза в биологических процессах
- Полимеры (белки, жиры и полисахариды) во время переваривания пищи благодаря гидролизу превращаются в мономеры (аминокислоты, глюкозу и т.д.). То есть без гидролиза пища почти не может усваиваться.
- Многие лекарства, попадая в наш организм, подвергаются гидролизу. Значит, без гидролиза лекарства бы усваивались хуже.
Фактчек
- Гидролиз – это взаимодействие молекул воды с ионами растворённого вещества. Нерастворимые соли гидролизу не подвергаются!
- Выделяют три среды: кислую, нейтральную и щелочную. Если ионов водорода больше, чем гидроксид-ионов, то среда кислая. Если ионов водорода и гидроксид-ионов примерно одинаковое число, то среда нейтральная. Если ионов водорода меньше, чем гидроксид-ионов, то среда щелочная.
- Концентрацию ионов водорода отражает pH. Эта величина пропорциональна концентрации водорода. То есть, чем больше ионов водорода, тем меньше значение pH.
- Гидролиз ищет слабую часть, а среда – сильную!
Проверь себя
Задание 1.
Какая среда у следующей соли: KNO3
Задание 2.
Какая среда у следующей соли: NaF
Задание 3.
Сульфат бария гидролизуется
- По катиону
- По катиону и по аниону
- Не гидролизуется
Ответы: 1. — 3; 2. — 2; 3. — 3.
Источник: umschool.net
Для чего делают и что это такое гидролиз солей
Вода — самый распространенный на земле растворитель. Особенно хорошо в ней растворяются вещества ионного строения, такие как соли. При попадании в воду растворимые соли диссоциируют — разделяются на ионы. Но некоторые вещества не просто растворяются, а разлагаются водой. При этом возникают новые вещества. Такой процесс называется гидролизом.
Что такое гидролиз?
Определение
Реакция между растворителем и растворяемым веществом, при которой они оба разделяются на составные части, а продуктами становятся новые вещества, называется сольволизом. Гидролиз в химии — это частный случай такой реакции, где в роли растворителя выступает вода.

Что такое гидролиз
- по аниону,
- по катиону,
- по аниону и катиону,
- щелочное,
- кислотное,
- ферментативное.
Википедия приводит такое определение гидролиза. Это взаимодействие с водой, в ходе которого вещество разлагается на составные части, и получаются новые соединения. Такие реакции значительно отличаются у органических и неорганических веществ, солей, протеинов, липидов и прочих.

Что такое гидролиз
В общем виде уравнение выглядит так:
где MA — соль, HA — кислота, MOH — основание.
Что такое гидролиз солей? Это реакция обмена ионами между Н2О и растворимой солью. Если результат такого взаимодействия соединения, которые плохо диссоциируют, то продуктами такого превращения будут слабые электролиты. Гидролиз как реакция — процесс, противоположный нейтрализации. В отличие от нее он эндотермический.
Он может идти обратимо и необратимо.
Какой процесс называется необратимым гидролизом? Реакция гидролиза необратима, если продукт реакции выводится из раствора, то есть осаждается или улетучивается в виде газа, а также если получается и газ, и осадок.
Это интересно! Как отличить металлы и неметаллы в таблице элементов Менделеева
Виды
То, как пойдет процесс, зависит от свойств основания и кислоты, образовавших конкретное соединение.
Обратите внимание! Соль сильной кислоты и сильного основания не гидролизуется, раствор будет с нейтральным pH.

Константа гидролиза
- По катиону и аниону. Соединение слабого основания и слабой кислоты, органическое или неорганическое, разлагается и по положительному, и по отрицательному иону. Получившийся раствор может иметь слабощелочную, слабокислую или нейтральную среду.
- По катиону. Разложение неорганических солей слабого основания и сильной кислоты проходит по катиону. Он соединяется с гидроксильным ионом ОН. Оставшиеся положительно заряженные частицы Н делают раствор кислотным. Так гидролизуется, например, сернокислая медь CuSO4.
- По аниону. Способность гидролизоваться по отрицательному иону свойственна солям сильных оснований и слабых кислот. Отрицательный ион кислотного остатка объединяется с частицей Н+ из Н2О, остается избыточное количество гидроксид-ионов. Поэтому pH в полученном растворе станет щелочным. Пример — KNO2. Если он прореагирует с Н2О, получится гидроксид калия KOH и азотистая кислота HNO2.
- Щелочной. Этот тип процесса характерен для органических соединений. Они гидролизуются в присутствии щелочи. Например, в присутствии NaOH гидролизуется C5H11Cl.
- Кислотный. Процесс в присутствии сильных неорганических кислот (серной, соляной) характерен только для органических соединений, таких как сложные эфиры.
- Ферментативный. Ферменты (энзимы) выступают катализаторами для расщепления биополимеров: белков, жиров, липоидов, крахмалов, гликогена и других. Именно такие процессы проходят в пищеварительном тракте.
- Ступенчатый гидролиз. Разложение в несколько стадий происходит, когда с H2O реагирует соль многоосновной кислоты или многокислотного основания. Сначала проходит разложение исходное соединение, возникает новая соль, она затем также гидролизуется. Таких ступеней может быть несколько. Na2CO3 — результат взаимодействия сильного основания и слабой кислоты. На первой стадии она разлагается по аниону, и получается NaHCO3. Далее идет ее сольволиз в водном растворе, получается слабая кислота H2CO3.
Источник: tvercult.ru