Аммонолиз похож на реакции гидролиза и переэтерификации. В качестве нуклеофила, замещающего спиртовый фрагмент, используют аммиак, амиды щелочных и щелочноземельных металлов.
Восстановление
Каталитическое восстановление сложных эфиров протекает в присутствии медного катализатора при высоких температуре и давлении. Результатом всегда являются первичные спирты.
Восстановление до первичных спиртов может быть проведено также комплексными гидридами металлов или натрием в спирте.
Сложноэфирная конденсация Кляйзена
СН-кислотность a-водородов сложноэфирной группы, является фактором обусловливающим возможность протекания конденсации в присутствии сильных оснований. Результат реакции – эфиры b-кетокислот.
Лекция № 36
Карбоновые кислоты и их производные
Монокарбоновые кислоты.
Производные карбоновых кислот.
· Амиды. Получение: ацилирование аммиака и аминов. Химические свойства: амидное сопряжение, кислотно-основные свойства (сравнить с аминами), восстановление, перегруппировка Гофмана, алкилирование.
Химия. 11 класс. Качественное определение спиртов, альдегидов, карбоновых кислот /24.02.2021/
Амиды
Общая формула амидов:
· R’ и R” атомы водорода – незамещенные амиды;
· R’ – водород, R” – углеводородный радикал — монозамещенные амиды;
· R’ и R” — углеводородные радикалы — дизамещенные амиды.
Практическое значение имеют, в первую очередь, незамещенные и монозамещенные амиды.
Получение
Наиболее общие метод получения амидов (от незамещенных до дизамещенных) – ацилирование (введение ацильной группы) аммиака и его производных (аминов).
Простейший, на первый взгляд, и ошибочный метод – получение амида взаимодействием карбоновой кислоты с аммиаком.
Следует помнить о кислотно-основных свойствах реагирующих веществ. Реакция получения амидов – нуклеофильное замещение ОН-группы. Взаимодействие кислоты с аммиаком приводит к аммонийным солям.
Карбоксилат-анион – частица с избытком электронной плотности, для которой реакция с нуклеофилами затруднена, если не невозможна.
В некоторых случаях аммонийная соль может быть превращена в амид нагреванием при температуре > 200 о .
Реакция применима только для простейших кислот с углеводородным радикалом. Соединения, имеющие в углеводородной части молекулы функциональные группы обычно разлагаются при более низких температурах, чем необходимо для отщепления воды.
Гладко протекаю реакции ацилирования аммиака и аминов ангидридами и хлорангидридами кислот.
Ацилирование аммиака и его производных ангидридами
Недостатком этого метода является большой расход карбоновой кислоты, т.к. половина молекулы ангидрида расходуется впустую.
Ацилирование аммиака и его производных хлорангидридами
В реакции всегда используют двойной избыток аммиака: одна молекула для введения амидной группы, вторая – для связывания хлористого водорода.
Незамещенные амиды могут быть получены частичным гидролизом нитрилов.
Кислотно-основные свойства амидов
В отличие от большинства производных аммиака, проявляющих сильно основные свойства, амиды амфотерные соединения.
Схожие химические свойства: спирты, карбоновые кислоты Органическая химия 10 класс Подготовка к ЕГЭ
Сопряжение неподеленной пары электронов амидного азота с карбонильной группой, приводит к сдвигу электронной плотности в сторону кислорода. Связь C-N имеет частично двойной характер, ее длина (1,32 Å) заметно меньше длины одинарной C-N связи (1,47 Å).
В реакциях с сильными основаниями амиды проявляют кислые свойства. Кислотность амидов близка к кислотности спиртов (рКа 15-19). Кислотные свойства используют в реакциях алкилирования.
Основность амидов также низка. Только в реакциях с сильными кислотами происходит протонирование, причем оно проходит по атому кислорода.
Химические свойства
Восстановление
Восстановление незамещенных амидов комплексными гидридами щелочных металлов (LiAlH4) приводит к первичным аминам, а — моно- и дизамещенных соответственно к вторичным и третичным аминам.
При восстановлении металлическим натрием в жидком аммиаке в присутствии этанола образуются альдегиды.
Гидролиз амидов
Кислотный гидролиз приводит к карбоновой кислоте и аммонийной соли.
В результате щелочного гидролиза образуется соль кислоты и амин или аммиак.
Перегруппировка Гофмана
Бромирование незамещенных амидов в щелочной среде ведёт к образованию первичных аминов.
Реакция состоит из нескольких стадий: первоначального образования N-бромамида, который перегруппировывается в изоцианат, гидролиз изоцианата до карбаминовой кислоты и декарбоксилирования последней в амин.
Очень важная особенность перегруппировки Гофмана в том, что она проходит с сохранением конфигурации, т.е. открывает возможность стереонаправленного синтеза. Например, взяв в качестве исходного соединения (+)-карбоновую кислоту и получив из нее (+)-амид, после перегруппировки будет получен (+)-первичный амин.
Лекция № 37
Карбоновые кислоты и их производные
Монокарбоновые кислоты.
Производные карбоновых кислот.
· Взаимопревращения амидов и нитрилов. Получение нитрилов дегидратацией амидов кислот. Химические свойства: гидролиз, аммонолиз, каталитическое гидрирование, восстановление алюмогидридом лития, использование в синтезе кетонов ароматического ряда.
Дикарбоновые кислоты
· Классификация, изомерия, номенклатура.
· Методы получения: гидролиз динитрилов, синтезы с использованием малонового эфира, окислительное расщепление циклоалкенов и циклических кетонов, окисление диолов, альдегидов, окисление диалкилбензолов.
· Химические свойства: кислотность и ее зависимость от взаимного расположения карбоксильных групп, константы кислотности для первого и второго карбоксила. Поведение дикарбоновых кислот при нагревании. Пиролиз кальциевых и ториевых солей. Получение, свойства и применение производных дикарбоновых кислот.
Источник: vunivere.ru
Карбоновые кислоты


Карбоновые кислоты встречаются в хвоинках, листьях крапивы, фруктах и овощах. Индейцы в древности смазывали стрелы ядом – производными уксусной кислоты. Из многих карбоновых кислот синтезируются сложные эфиры, которые обладают приятными ароматами и применяются в производстве. Карбоновые кислоты – соединения с одной или несколькими карбоксильными группами – СООН. Они придают фруктам и овощам кислый вкус.



В быстроразвивающемся мире уже мало учиться только в рамках школьной программы, важно получать полезные знания о финансах и инвестициях, чтобы гарантировать материальное благополучие
Создай себе задел на будущее, получай уже сегодня расширенный объем знаний и навыков по ФИНАНСОВОЙ ГРАМОТНОСТИ в режиме онлайн


Зарегистрируйся сейчас, ПРИБЛИЗЬ СВОЙ УСПЕХ
План урока:
Строение карбоновых кислот
Карбоксил, или карбоксильная группа, – сложная функциональная группа, содержащая карбонильную С=О и гидроксильную – ОН группы. Электронная плотность в молекуле стягивается на кислородный атом. Для карбонильного углерода характерно состояние sp 2 -гибридизации. Он образует три σ-связи и одну π-связь.

Виды карбоновых кислот

Номенклатура карбоновых кислот
Согласно международной номенклатуре в карбоновых кислотах к названию углеводородного радикала прибавляется суффикс «-овая» и слово «кислота». Например, метанОВАЯ КИСЛОТА.
Алгоритм названия соединения
- Нахождение главной цепи.
- Нумерация углеродных атомов, включая углеродный атом функциональной группы.
- Название радикала.
- Прибавление к названию суффикса «-овая» при наличии одной карбоксильной группы, суффикса «-диовая» при наличии двух функциональных групп. В любом случае добавляется слово «кислота».

Схема названия карбоновой кислоты.
Гомологический ряд
Первое соединение гомологического ряда – метановая кислота. Она входит в состав выделений муравьев. Медведи после зимней спячки часто ложатся на муравейник, чтобы муравьи своей кислотой убивали паразитов, скопившихся в мехе за зиму.

Гомологический ряд карбоновых кислот.
Смесь капроновой, каприловой и каприновой кислот содержится в козьем молоке.
Виды изомерии карбоновых кислот
Для соединений этого класса свойственны оба вида изомерии.
Структурная изомерия

Для непредельных представителей класса характерна изомерия положения двойной или тройной связи.

Пространственная изомерия
Оптическая изомерия возможна при наличии ассиметричного атома углерода. Цис-транс-изомерия свойственна для соединений, содержащих двойную связь.

Методы получения карбоновых кислот
Представители класса нередко встречаются в природе, но также есть промышленные и лабораторные методы их получения.
Карбоновые кислоты получают путем окисления первичных спиртов. В этом случае окислителями могут выступать перманганат или дихромат калия.
Также их синтезируют путем окисления альдегидов. Окислители – перманганат или дихромат калия.
CH3CHO + Ag2O (аммиачный раствор) → CH3COOH + Ag↓
Карбоновые кислоты могут быть синтезированы путем неполного окисления алканов. Данная реакция возможна только при высоких температурах и наличии катализатора.
С помощью окисления бутана в присутствии катализатора в промышленности синтезируют уксусную кислоту.
Из гомологов бензола получают бензойную кислоту.

Щелочной гидролиз тригалогенидов
Представителей класса получают взаимодействием водного раствора щелочи и тригалогеналкана, в котором атомы галогена расположены при одном углеродном атоме. При этой реакции галогены замещаются на гидроксильные группы.

Реакция соли и минеральной кислоты
Карбоновые кислоты получают действием минеральной кислоты на соли.
R-COOK + HCl→ R-COOH + KCl
Взаимодействие сложных кислот и воды
При наличии минеральной кислоты и при нагревании из сложных эфиров можно синтезировать карбоновые кислоты.

Синтез муравьиной кислоты путем взаимодействия щелочи и угарного газа
Реакция проводится при повышенном давлении.

Синтез карбоновых кислот с помощью реактивов Гриньяра
Из реактивов Гриньяра (алкилгалогенидов магния)при взаимодействии с углекислым газом и дальнейшем гидролизе получают карбоновые кислоты.
R-COO-MgBr + H2O →R-COOH + Mg(OH)Br
Физические свойства карбоновых кислот
Карбоновые кислоты с одним, двумя и тремя атомами углерода в цепи в нормальных условиях –легкоподвижные жидкости с резким запахом. Соединения с четырьмя-девятью атомами углерода в цепи – жидкости с неприятным запахом, а последующие по гомологическому ряду соединения – твердые вещества без запаха. Агрегатное состояние всех ненасыщенных карбоновых кислот в обычных условиях – жидкое, а дикарбоновых и ароматических – кристаллическое.
Первые три представителя гомологического ряда растворяются с водой в любых соотношениях. По мере увеличения углеродной цепи эта способность падает. Также по гомологическому ряду карбоновых кислот температура кипения и плавления увеличивается, а запах ослабевает. Наличие кратных связей характеризуется меньшими температурами плавления и кипения.
Высокие температуры плавления и кипения связаны с тем, что между молекулами формируются водородные связи. Такая связь более прочная, т.к. она образуется между водородом гидроксильной группы одного соединения и карбонильным кислородом другого.
Физические свойства представителей карбоновых кислот
Муравьиная кислота (НСООН) – прозрачная жидкость с характерным запахом. Температура кипения – +101˚С. Она содержится в выделениях муравьев, соке крапивы и хвое ели. На листьях крапивы находятся иголки с муравьиной кислотой, которые при соприкосновении с кожей ломаются и кислота проникает в организм. Муравьиная кислота оказывает раздражающее действие.

Молекула муравьиной кислоты
Пальмитиновая и стеариновая кислоты – твердые белые вещества. Они нерастворимы в воде, но немного растворимы в органических растворителях.

Молекулы пальмитиновой и стеариновой кислот
Бензойная кислота (С6Н5СООН) – ароматическая кислота, которая легко возгоняется, без превращения в жидкое состояние. Температура плавления – 122,4˚С. При понижении температуры ее пары преобразуются в кристаллы. Для бензойной кислоты характерна низкая растворимость в холодной воде, но высокая – в органических растворителях. Применяется для очистки веществ от примесей от загрязнений.

Молекула бензойной кислоты
Химические свойства карбоновых кислот
Для карбоновых кислот не свойственны реакции присоединения.
Кислотные свойства
- Взаимодействие с основаниями
- Взаимодействие с металлами
- Реакция с основными оксидами
- Реакция с солями более слабых кислот
Реакция замещения гидроксильной группы карбоновой кислоты
- Образование галогенангидридов
- Взаимодействие с аммиаком
- Образование сложных эфиров
Для проведения реакции необходима минеральная кислота.
- Образование ангидридов

Замещение атома водорода при ближайшем к карбоксильной группе углеродном атоме
Для взаимодействия карбоновых кислот с галогенами необходим красный фосфор.

Применение карбоновых кислот
Для муравьиной кислоты характерны антибактериальные свойства, поэтому она применяется в промышленном производстве. Например, потребителям она известна как добавка Е236. Она используется в консервации кондитерских изделий, молочных продуктов, безалкогольной продукции.

Применение муравьиной кислоты
Уксусная кислота применяется при получении красителей, лекарственных препаратов, растворителей лаков. В пищевой промышленности она известна как добавка Е260. Часто она используется при консервации различной продукции.

Применение уксусной кислоты
Масляная (бутановая) кислота используется при лечении заболеваний ЖКТ. Она в кишечнике образует кислую среду, которая подавляет развитие патогенных бактерий. Соли бутановой кислоты применяются в качестве кормовых добавок для животных. Они улучшают иммунную систему, пищеварение, подавляют деятельность многих вредных кишечных микроорганизмов, уменьшают необходимость применения антибиотиков и лекарственных средств.

Молекула масляной кислоты
Щавелевая кислота – непредельная двухосновная карбоновая кислота. Она применяется в синтезе красителей, чернил, пластмасс и т.д. Обладает дезинфицирующими и отбеливающими свойствами, поэтому часто добавляется в синтетические моющие средства. Соли щавелевой кислоты можно синтезировать из листьев щавеля, кислицы, ревеня. В пищевой промышленности практически не используется, т.к. щавелевая кислоты образует в организме человека труднорастворимые соли, которые откладываются в виде камней в почках и мочевом пузыре.

Молекула щавелевой кислоты
Источник: 100urokov.ru
Урок 24. Карбоновые кислоты
Карбоновые кислоты — это производные углеводородов, в молекулах которых содержится одна или несколько карбоксильных групп:

Карбоксильная группа имеет сложный состав. Она состоит из карбонильной и гидроксильной (гидроксо) групп:
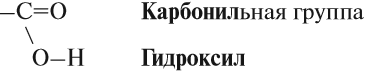
Карбоновые кислоты часто встречаются в природе, придавая ягодам и фруктам, а также некоторым другим продуктам питания кислый вкус. Их делят на различные группы (классы) по некоторым признакам:
- По строению (составу) углеводородного радикала кислоты делят на:
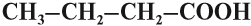
в углеводородном радикале только простые связи;
– Непредельные (в углеводородном радикале есть кратная связь);
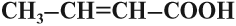
в углеводородном радикале есть кратная связь;
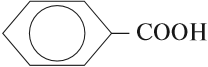
имеется бензольное кольцо.
Задание 24.1. Определите состав этих кислот.
Для того чтобы различить по составу предельные и непредельные кислоты, нужно умножить на два число атомов углерода в углеводородном радикале и сравнить полученную величину (С) с числом атомов водорода (В) в углеводородном радикале:
Задание 24.2. Какая из следующих кислот является предельной:
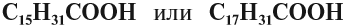
- По числу карбоксильных групп кислоты делят на:
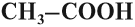
есть одна карбоксильная группа;
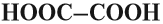
есть две карбоксильные группы.
Бывают кислоты, содержащие и большее число карбоксильных групп. Рассмотрим строение молекул и свойства карбоновых кислот на примере предельных одноосновных кислот.

Гомологический ряд, номенклатура, изомерия
Предельные одноосновные карбоновые кислоты образуют гомологический ряд с общей формулой:
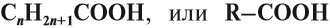
Вопрос. По какому принципу составляются названия кислот?
Для того чтобы составить название кислоты, нужно:
- подсчитать все атомы углерода (считая и атом углерода карбоксильной группы);
- назвать алкан, который имеет такое же число атомов углерода и то же строение;
- дописать к этому названию «овая» и слово «кислота».
Кроме того, для кислот чаще всего используют тривиальные названия (муравьиная, уксусная), которые указывают на происхождение кислоты или её отличительные признаки. Например, название муравьиная указывает, что эта кислота входит в состав жгучего сока муравьёв. А слово «уксусная» происходит от греческого слова «оксос», что означает «кислый». Запомните некоторые из этих названий:
Задание 24.3. Назовите по ИЮПАК пропионовую и масляную кислоты.
Если вы выполнили вышеизложенные правила, у вас получилось: пропановая кислота, бутановая кислота.
Начиная с n = 3, у кислот появляются изомеры. Изомерия предельных кислот связана со строением углеводородного радикала:
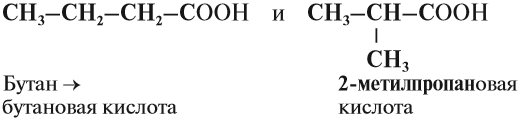
Задание 24.4. Составьте молекулярные формулы этих кислот и убедитесь, что это изомеры.

Строение молекул
В состав карбоксильной группы входит гидроксогруппа ОН.
Вопрос. В каких соединениях встречается функциональная группа ОН?
Такая же группа входит в состав молекул спиртов. Спирты проявляют очень слабые кислотные свойства, могут вступать в реакции только с очень активными, щелочными металлами, не изменяют окраску индикатора, не реагируют с растворами щелочей.
Если в раствор карбоновой кислоты добавить индикатор (лакмус), то раствор окрасится в красный цвет. Это означает, что кислоты проявляют более кислые свойства, чем спирты. Почему? Потому что карбонильная группа, которая расположена рядом с гидроксогруппой, влияет на неё.
Карбонильная группа, которая входит в состав карбоксильной группы, имеет (+) на атоме углерода. За счёт этого небольшого положительного заряда происходит смещение общих электронных пар связей «С–О» и «О–Н», поэтому эти связи становятся более полярными:
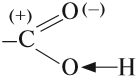
Таким образом, карбонильная группа увеличивает полярность связи О–Н, делая её более полярной. Поэтому атом водорода карбоксильной группы становится очень подвижным. Он легко замещается на атом металла, способен отщепляться в растворах: кислоты диссоциируют:
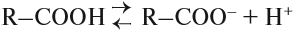
Гидроксогруппа тоже влияет на карбонильную группу, делая ее неактивной, поэтому кислоты не участвуют в реакциях с разрывом π-связи карбонильной группы.
Карбоксильная группа влияет на углеводородный радикал, делая некоторые связи С–Н в нём более полярными, и кислоты могут участвовать в реакциях замещения атомов водорода радикала.

Свойства кислот
Физические свойства
Кислоты с небольшим числом атомов углерода (1–10) — жидкости с резким запахом. Вкус у них разный — уксусная кислота — кислая, а масляная — горькая. Низшие кислоты растворимы в воде, причём с увеличением длины радикала их растворимость ухудшается.
Например, уксусная кислота — бесцветная жидкость с резким запахом. Смешивается с водой в любых соотношениях. 60…90 %-ные растворы уксусной кислоты (уксусная эссенция) опасны для жизни, в то время как 6…8 %-ные растворы столового уксуса широко применяются при приготовлении пищи.
Высшие кислоты, например стеариновая кислота, твёрдые, нерастворимые в воде вещества, лишённые запаха. Смесь таких кислот называется «стеарин». Из стеарина делают свечи.
Химические свойства
Кислоты проявляют все свойства неорганических кислот.
Вопрос. Какие свойства кислот вам известны?
Кислоты реагируют с металлами, которые стоят в ряду напряжений до водорода:
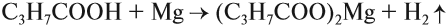
При составлении таких реакций следует помнить, что
- кислотный остаток — это часть молекулы кислоты без подвижного атома водорода; в данном случае это: С3Н7СОО;
- валентность кислотного остатка равна числу замещённых атомов водорода, в данном случае замещается один атом водорода и валентность равна I;
- исходя из этого, нужно переписать после реакции кислотный остаток, взять его в скобки и за скобками поставить цифру, равную валентности металла, а затем записать символ самого металла.
В результате такой реакции образуется соль и выделяется водород.
Кислоты реагируют с основными и амфотерными оксидами:
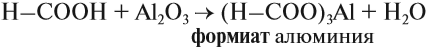
В этом случае образуется соль и вода. Такие же продукты реакции образуются при взаимодействии кислоты и основания:
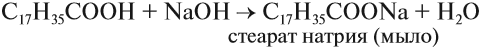
Большинство карбоновых кислот — слабые кислоты. Тем не менее они могут вытеснять более слабые кислоты из их солей:
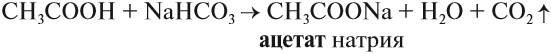
Итак, во всех этих реакциях образуются соли. Названия солей происходят от латинских названий кислот. Запомните эти названия!
Задание 24.5. Составьте для известных Вам карбоновых кислот таблицу по схеме:
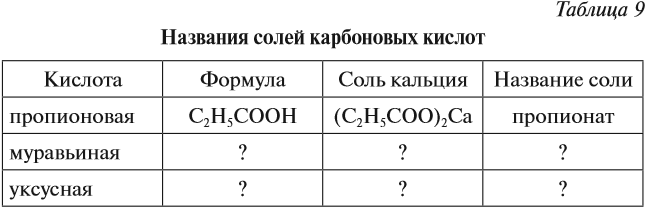
Названия солей см. выше (в уравнениях химических реакций).
Кислоты могут реагировать со спиртами, в результате получаются сложные эфиры:
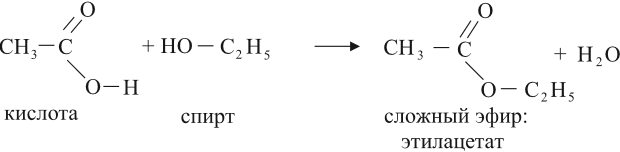
Это реакция этерификации. Она происходит в присутствии концентрированной серной кислоты. (Подробнее о названиях и свойствах сложных эфиров см. урок 25.)
Кислоты могут реагировать с галогенами за счёт углеводородного радикала, при этом на атом галогена замещается атом водорода у ближайшего к карбоксильной группе атома углерода (это α-углеродный атом):
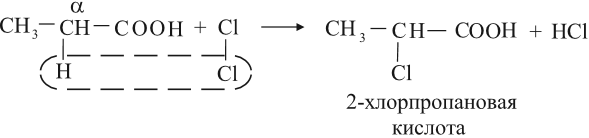
Получение и применение кислот
Кислоты можно получить при помощи окисления соответствующего альдегида:
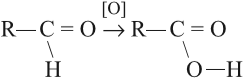
Задание 24.6. Какой альдегид нужно взять для получения уксусной кислоты? 2-метилпропановой кислоты? Составьте уравнения реакций.
Вопрос. В каких условиях происходят процессы окисления альдегидов? Являются ли эти реакции качественными на альдегидную группу?
Кислоты применяются для получения душистых веществ, растворителей, входят в состав лекарств. Наибольшее применение получила ледяная (безводная) уксусная кислота, которая используется в технических целях (для получения лекарств, ацетатного шёлка, растворителей). В магазине можно купить и пищевую уксусную кислоту (70 %-ный раствор), и уксус (6 %-ный раствор).
Концентрированная уксусная кислота — яд! Она вызывает тяжёлые ожоги внутренних органов, разрушает кровь. Её следует разбавлять водой до безопасных 5–7 % (примерно 1:10). Столовый уксус используют при приготовлении пищи. Его получают из глюкозы по схеме:
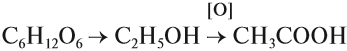
Некоторые (жирные) кислоты входят в состав жиров (см. урок 25).

Выводы
Кислоты — это производные углеводородов, содержащие карбоксильную группу. Для них характерны реакции:
- замещения атома Н карбоксильной группы (с металлами);
- обмена (с оксидами, гидроксидами, солями);
- этерификации (со спиртами);
- замещения атома Н радикала (с галогенами).
Кислоты входят в состав различных овощей, фруктов и других пищевых продуктов. Используются при приготовлении пищи, например уксус.
Источник: himi4ka.ru