Найди верный ответ на вопрос ✅ «Вычислите массовую долю нитрата серебра в растворе с молярной концентрацией 1,4 моль/л, плотность которого равна 1,18 г/см3 . » по предмету Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Новые вопросы по химии
Что произойдёт с железом при взаимодействии с водой? 3 класс.
C8h18 формула глюкозы
1. Цинк растворили в концентрированной азотной кислоте. Полученный газ растворили в горячей воде. В ходе этого взаимодействия образовался бесцветный газ. Он легко окисляется кислородом воздуха до образования бурого газа.
Закончите формулы. H2+CuO= Na+HCl =
Что такое макроэлементы и ультромикроэлементы?
Главная » Химия » Вычислите массовую долю нитрата серебра в растворе с молярной концентрацией 1,4 моль/л, плотность которого равна 1,18 г/см3
Источник: urokam.net
Задачи по химии. Разница масс. На пластинку 8
Задача на определение массовой доли всех веществ в растворе после реакции

Задача 4.
Медную пластинку массой 5 г поместили в 200 г 10% — ного раствора нитрата серебра. Через некоторое время пластинку вынули из раствора и снова взвесили. Ее масса изменилась на 1,5 г. Определите массовую долю всех веществ в растворе после реакции.
Дано;
Исходная масса медной пластинки: m(Сu)исх. = 5 г;
масса исходного раствора: mисх. р-ра = 200 г;
массовая доля АgNO3 в исходном растворе: (АgNO3) = 10%;
изменение в массе пластинки: mпластинки = 1,5 г.
Найти:
массовую долю всех веществ в растворе после реакции.
Решение:
В условии описана реакция окисления меди ионами серебра Ag + :
Причем следует учитывать, что металлическое серебро выделяется на пластинке, а не выпадает на дно реакционного сосуда.
Так как в условии не указано, на каком этапе протекания реакции пластинку вынули из раствора, остается неизвестным, весь ли исходный нитрат серебра принял участие в реакции. Путем изъятия пластинки из раствора мы могли прекратить реакцию в любой момент. В случае, если АgNО3 расходовался не весь, конечный раствор будет содержать смесь солей: Сu(NO3)2 и АgNО3.
Таким образом, сначала нам придется определять количество нитрата серебра, принявшего участие в реакции 1 . Для этого можно использовать разные алгоритмы. Наиболее удобен встречный алгоритм. В нем мы вводим величину «а», которой обозначаем массу (количество, объем) интересующего нас вещества, в данном случае m(АgNО3).
Далее, используя введенную величину как известную, по уравнению химической реакции находим массу растворившейся меди и массу выделившегося на пластинке серебра. В итоге, учитывая изменение массы пластинки, составляем математическое уравнение. Его решение дает массу расходовавшегося АgNО3. По ней мы легко рассчитаем массу образовавшегося Сu(NO3)2 и массу оставшегося нитрата серебра (если он остался) в конечном растворе.
Массовая доля элемента
Алгоритм решения можно выразить следующей схемой:
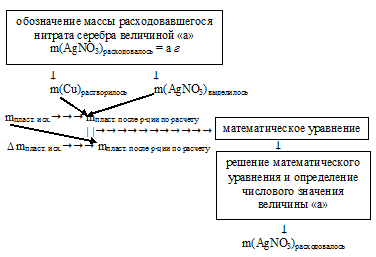
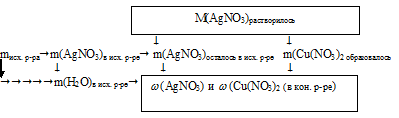
После определения массы расходовавшегося нитрата серебра находим массовые доли солей в конечном растворе по схеме:
1. Обозначим массу расходовавшегося АgNО3 величиной «а»:
2. Пользуясь величиной «а» как известной определим массу растворившейся с пластинки меди и выделившегося на ней серебра:
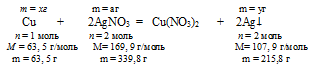
Составим две пропорции:
х г Сu взаимодействуют с а г АgNО3 (по условию)
63,5 г Сu взаимодействуют с 339,8 г АgNО3 (по уравнению)
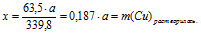
а г АgNО3 дают у г Ag (по условию)
339,8 г АgNО3 дают 215,8 г Ag (по уравнению)
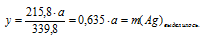
3. Определим массу пластинки после реакции, используя найденные значения масс растворившейся меди и выделившегося серебра:
mпласт. после р-ии = mисх. пласт. – m(Cu)растворилось + m(Ag)выделилось =
= 5 – (0,187 . а) + (0,6,35 . а) = 5 + (0,448 . а) г.
4. Определим массу пластинки после реакции по данным из условия.
В условии сказано, что масса пластинки изменилась, но не указано увеличилась она или уменьшилась. По уравнению реакции можно ответить на этот вопрос:
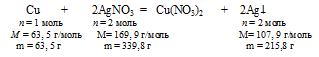
При растворении 63,5 г меди выделяется 215,8 г серебра, следовательно, масса пластики после реакции увеличилась 2 .
m(пластинки после р-ии) = m(исходн. пластинки) + m = 5 + 1,5 = 6,5 г.
5. Используя данные о массе пластинки, полученные двумя разными путями в 3 и 4 действиях, составляем математическое уравнение. Приравниваем значения массы пластинки после реакции:
5 + 0,448 . а = 6,5
Решая уравнение, получим: а = 3,35 г.
Величиной «а» мы обозначали массу расходовавшегося АgNО3: m(AgNO3)расходовалось = 3,35 г.
6. Теперь определим массу оставшегося после реакции нитрата серебра:
Определим m(АgNО3)в исх р-ре по массовой доле и массе раствора (из условия):
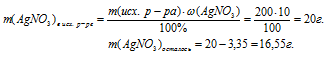
7. Определим массу образовавшегося Сu(NO3)2 по массе расходовавшегося нитрата серебра.
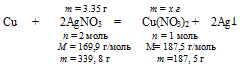
3,35 г АgNО3 дают х г Сu(NO3)2 (по условию)
339,8 г АgNО3 дают 187,5 г Сu(NO3)2 (по уравнению)
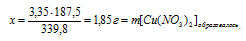
8. Определим массовые доли АgNО3 и Сu(NO3)2 в конечном растворе. Для этого нам потребуется узнать массу воды в растворе. Ее масса не изменилась в процессе реакции, так как вода не принимала в ней участия.
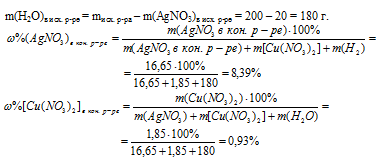
Ответ: АgNО3 = 8,39%; Сu(NO3)2 = 0,93%.
Комментарии:
1 Несмотря на то, что одно из веществ взято в избытке, а другое в недостатке, эта задача не относится к типу «на определение избытка-недостатка». В ее условии указано количество только одного исходного участника реакции (АgNО3). Применение алгоритма определения избытка-недостатка невозможно.
3 В случае других металлов масса пластинки могла и уменьшиться. Это зависит от молярной массы металла и от соотношения коэффициентов перед ними в уравнении реакции. Изменение массы обозначают греческой буквой дельта «».
- Вы здесь:
- Главная

- Задачи

- ЕГЭ-химия

- Термохимические уравнения | Задача 1.8 — 1.10
Источник: buzani.ru
В колбе смешали 25 г 2%-ного раствора нитрата серебра AgN03, 15 г 3%-ного раствора нитрата серебра AgN03, 20 г 1 0%-ного нитрата натрия NaN03, 30 г 20%-ного раствора нитрата натрия NaN03 и 1 0 г воды. Вычислите массовую долю нитрата натрия и массовую долю нитрата серебра в полученном растворе.
Получи верный ответ на вопрос «В колбе смешали 25 г 2%-ного раствора нитрата серебра AgN03, 15 г 3%-ного раствора нитрата серебра AgN03, 20 г 1 0%-ного нитрата натрия . » по предмету Химия, используя встроенную систему поиска. Наша обширная база готовых ответов поможет тебе получить необходимые сведения!
Новые вопросы по химии
1) Вычислить объём углекислого газа, выделившегося при сливании растворов, содержащих 5,3 гр карбоната натрия и 7,3 гр соляной кислоты. 2) Вычислить массовую долю поваренной соли в растворе, приготовленном из 40 гр соли и 160 гр воды.
Рассчитайте массу алюминия, необходимого для получения 130 г хрома из его оксида cr203 алюмотермическим способом
Определить количество оксида железа 3 необходимиго для получения чистого железа количеством 112 г путём алюминотермии и составить дано
Рассчитайте объем водорода, выделившегося при взаимодействии 30 г цинка с 200 мл 20%-ного раствора соляной кислоты
Na-NaOH-Ch3 COONa-Ch4-Co2-Na2 CO3-NaHCo3
Главная » Химия » В колбе смешали 25 г 2%-ного раствора нитрата серебра AgN03, 15 г 3%-ного раствора нитрата серебра AgN03, 20 г 1 0%-ного нитрата натрия NaN03, 30 г 20%-ного раствора нитрата натрия NaN03 и 1 0 г воды.
Источник: 4i5.ru