Относительная атомная масса — величина массы атома в атомных единицах массы. Чтобы найти атомную массу элемента, необходимо массу его атома поделить на 1/12 массы нейтрального атома изотопа углерода 12C.
Учитывая, что абсолютная масса атома является невероятно малой величиной, в химии преимущественно пользуются в практических целях другой величиной — относительной атомной массой,определяющей во сколько раз масса атома данного элемента тяжелее массы того элемента, который взят за единицу измерения массы. За такую единицу, названную атомной единицей массы (а.е.м.), принята 1/12 часть массы атома изотопа углерода 12 С. Эту единицу еще называют дальтон (Да) или углеродная единица.
1 а. е. м. = (1,66043 ± 0,00031)×10 -24 г. В таблице Д.И. Менделеева приведены относительные атомные массы. Если же требуется рассчитать абсолютную массу атома, следует относительную атомную массу данного элемента умножить на абсолютное значение а.е.м. (1,67 х 10 см. Число Авогардо Na(6,022045±0,000031)×10 23 является коэффициентом пропорциональности между единицей массы (граммом) и а.е.м. Узнать атомную массу интересующего вас элемента несложно с помощью онлайн калькулятора.
Относительная атомная масса | Химия | TutorOnline
nikto31
Источник: infofaq.ru
Как найти относительную массу серебра
Порядковый номер – 47. Строение атома показано на рис. 1. Металл d-семейства.
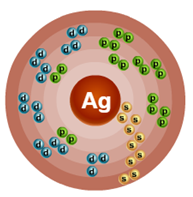
Рис. 1. Схема строения атома серебра.
В обычных условиях серебро представляет собой вещество белого цвета с гранецентрированной кубической решеткой. Металлу свойственна исключительная пластичность. Серебро значительно превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 10,5 г/см 3 . Температура плавления 961,2 o C, кипения 2170 o C.
Молярная масса серебра равна 107,8682 г/моль. Данное значение показывает отношение массы вещества (m) е число моль данного вещества (n), обозначается M и может быть рассчитано по формуле:
Иными словами, молярная масса вещества – это масса 1 моль данного вещества, выраженная в г/моль или ккмоль.
Серебро не может существовать в виде газа, только в форме твердого вещества, поэтому для нахождения значения его молярной массы нельзя использовать величину молярного объема или производить расчеты по формуле Менделеева-Клапейрона.
Примеры решения задач
| Задание | Вычислите массовую долю нитрата серебра в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18г/моль): |
Рассчитаем массу раствора нитрата серебра:
msolution(AgNO3) = 40 + 360 = 400 г.
Вычислим массовую долю нитрата серебра в растворе:
| Задание | При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве. |
| Решение | Запишем уравнения реакций взаимодействия металлов, представляющих собой сплав (медь и серебро), в концентрированной азотной кислоте: |
В результате реакции образуется смесь, состоящая из нитрата серебра и нитрата меди (II). Пусть количество вещества меди в сплаве составляет хмоль, а количество вещества серебра – у моль. Тогда массы этих металлов будут равны (молярная масса меди 64 г/моль, серебра – 108 г/моль):
Согласно условию задачи, масса сплава равна 3 г, т.е.:
По уравнению (1) n(Cu) : n(Cu(NO3)2) = 1:1, значит n(Cu(NO3)2) = n(Cu) =х. Тогда масса нитрата меди (II) составляет (молярная масса равна 188 г/моль) 188х.
Согласно уравнению (2), n(Ag) : n(AgNO3) = 1:1, значит n(AgNO3) = n(Ag) =y. Тогда масса нитрата серебра составляет (молярная масса равна 170 г/моль) 170y.
По условию задачи масса смеси нитратов равна 7,34 г:
Получили систему уравнений с двумя неизвестными:
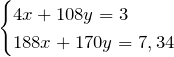
Выразим из первого уравнения х и подставим это значение во второе уравнение, т.е. решим систему методом подстановки.
Значит количество вещества серебра равно 0,01 моль. Тогда, масса серебра в сплаве равна:
m (Ag) = n (Ag) × M (Ag) = 0,01 × 108 = 1,08г.
Не вычисляя xможно найти массу меди в сплаве:
m (Cu) = malloy– m (Ag) = 3 – 1,08 = 1,92 г.
Серебро и его характеристики
Общая характеристика серебра
В качестве примеси серебро присутствует почти во всех медных и особенно свинцовых рудах. Из этих руд получают около 80% всего добываемого серебра.
Чистое серебро – очень мягкий, тягучий металл (рис. 1), оно лучше всех металлов проводит теплоту и электрический ток.
Серебро – малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение серебряных предметов – результат образования на поверхности черного сульфида серебра Ag2S.

Рис. 1. Серебро. Внешний вид.
Атомная и молекулярная масса серебра
Поскольку в свободном состоянии серебро существует в виде одноатомных молекул Ag, значения его атомной и молекулярной масс совпадают. Они равны 107,8682.
Изотопы серебра
Известно, что в природе серебро может находиться в виде двух стабильных изотопов 107 Ag и 109 Ag. Их массовые числа равны 107 и 109 соответственно. Ядро атома изотопа серебра 107 Ag содержит сорок семь протонов и шестьдесят нейтронов, а изотопа 109 Ag – такое число протонов и шестьдесят два нейтрона.
Существуют искусственные нестабильные изотопы серебра с массовыми числами от 93-х до 130-ти, а также тридцать шесть изомерных состояния ядер, среди которых наиболее долгоживущим является изотоп 104 Ag с периодом полураспада равным 69,2 минуты.
Ионы серебра
На внешнем энергетическом уровне атома серебра имеется один электрон, который является валентным:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 9 5s 2 .
В результате химического взаимодействия серебро отдает свой валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион:
Молекула и атом серебра
В свободном состоянии серебро существует в виде одноатомных молекул Ag. Приведем некоторые свойства, характеризующие атом и молекулу серебра:
Энергия ионизации атома, кДж/моль
Сплавы серебра
На практике чистое серебро вследствие мягкости почти не применяется: обычно его сплавляют с большим или меньшим количеством меди. Сплавы серебра служат для изготовления ювелирных и бытовых изделий, монет, лабораторной посуды.
Примеры решения задач
| Задание | Вычислите массовую долю нитрата серебра в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18 г/моль): |
Рассчитаем массу раствора нитрата серебра:
msolution(AgNO3) = 40 + 360 = 400 г.
Вычислим массовую долю нитрата серебра в растворе:
| Задание | При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве. |
| Решение | Запишем уравнения реакций взаимодействия металлов, представляющих собой сплав (медь и серебро), в концентрированной азотной кислоте: |
В результате реакции образуется смесь, состоящая из нитрата серебра и нитрата меди (II). Пусть количество вещества меди в сплаве составляет х моль, а количество вещества серебра – у моль. Тогда массы этих металлов будут равны (молярная масса меди 64 г/моль, серебра – 108 г/моль):
Согласно условию задачи, масса сплава равна 3 г, т.е.:
По уравнению (1) n(Cu) : n(Cu(NO3)2) = 1:1, значит n(Cu(NO3)2) = n(Cu) =х. Тогда масса нитрата меди (II) составляет (молярная масса равна 188 г/моль) 188х.
Согласно уравнению (2), n(Ag) : n(AgNO3) = 1:1, значит n(AgNO3) = n(Ag) =y. Тогда масса нитрата серебра составляет (молярная масса равна 170 г/моль) 170y.
По условию задачи масса смеси нитратов равна 7,34 г:
Получили систему уравнений с двумя неизвестными:
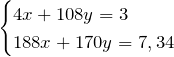
Выразим из первого уравнения х и подставим это значение во второе уравнение, т.е. решим систему методом подстановки.
Значит количество вещества серебра равно 0,01 моль. Тогда, масса серебра в сплаве равна:
m (Ag) = n (Ag) × M (Ag) = 0,01 × 108 = 1,08г.
Не вычисляя x можно найти массу меди в сплаве:
m (Cu) = malloy– m (Ag) = 3 – 1,08 = 1,92 г.
Молярная масса и другие характеристики серебра
Серебро — это химический элемент, который обозначается символом Ag. Атомный номер — 47. Точная молярная масса серебра составляет 107,8682(2) а. е. м. (г/моль). Этот металл мягкий, белый и блестящий. Обладает самой высокой электропроводностью, теплопроводностью и отражательной способностью из всех металлов.
В природе встречается в чистом виде (самородное серебро), в виде сплава с золотом и другими металлами, а также в минералах (например, в аргентите).
В основном производится в качестве побочного продукта от переработки меди, золота, свинца и цинка.Серебро еще с древнейших времен ценится как драгоценный металл. Он более распространенный, чем золото, и поэтому его часто использовали в качестве материала для изготовления монет. В современном мире серебро применяется во многих отраслях. Ниже перечислены самые известные способы его использования.
Монеты и украшения
Электрум (так называют сплав золота и серебра) начали использовать для чеканки монет еще около 700 лет до нашей эры. Позже этот металл стали применять в чистом виде. Многие народности использовали серебро в качестве основной денежной единицы. Например, валюта «фунты стерлингов» (£) получила свое название потому, что означала стоимость одного фунта серебра. Другие исторические валюты, такие как французский ливр, имеют сходную этимологию.
В XIX веке были открыты крупные месторождения этого драгоценного металла в Северной и Южной Америке. Опасаясь резкого снижения стоимости серебра, большинство государств к 1900 году перешли на золотой стандарт. В некоторых языках, среди которых санскрит, иврит, испанский и французский, понятия «деньги» и «серебро» эквивалентны одному слову.
Серебряные монеты до сих пор чеканятся в некоторых странах как памятные и коллекционные предметы. Обычно они не входят в общую валютную циркуляцию, но известны некоторые исключения. Например, в американском штате Юта серебро до сих пор считается легальным платежным средством. Серебряные монеты и слитки также используются в качестве инвестиций для защиты от инфляции и девальвации.
Относительно небольшая молярная масса данного металла благоприятно сказывается на фактической массе ювелирных изделий из него. Например, ожерелья не вызывают ощущения тяжести и дискомфорта у тех, кто их носит. Украшения традиционно изготавливаются из стерлингового (стандартного) серебра. Этот сплав состоит из 92,5% серебра и 7,5% меди.
Стерлинговое серебро более твердое и имеет более низкую температуру плавления по сравнению с чистым серебром или чистой медью. В США настоящим признают сплав, в котором не более 10% меди.
В Великобритании признаком качества считается сплав, состоящий из серебра на 95,8%. Ювелиры, которые специализируются на этом металле, обычно работают и с другими: золотом, медью, сталью, латунью. Они производят ювелирные изделия, столовые приборы, подсвечники, вазы и другие художественные элементы.
Молярная масса серебра
Молярная масса серебра.










Молярная масса серебра:
Молярная масса – это характеристика вещества, отношение массы вещества к его количеству.
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol). Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярная масса численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро (NA = 6,022 140 76⋅10 23 моль −1 ).
Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой (абсолютной молекулярной массой), выраженной в а. е. м., и относительной молекулярной массой.
В свою очередь, молекулярная масса – масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы, а. е. м.) и относительную молекулярную массу – безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12 C.
Молярную массу обозначают M.
Молярная масса серебра (M (Ag)) составляет 107,8682(2) г/моль.
Необходимо иметь в виду, что молярные массы химических элементов и простых веществ, которые они образуют – не одно и то же. Например, молярная масса кислорода как химического элемента (атома) ≈ 16 г/моль, а вещества (O2) ≈ 32 г/моль.
Источник: ollimpia.ru
Рассчитайте относительные атомные массы следующих элементов: а) платины Pt (масса атома равна 3,24 * 10 -25 кг); б) урана U (масса атома равна 3,95 * 10 -22 г). Найдите эти элементы в периодической системе на форзаце II.
Ответ: Ar (Pt) = 195,18 а.е.м., Ar (U) = 237,95 а.е.м.
0 0 голоса
Рейтинг статьи
Подписаться
Войти через
Я разрешаю создать мне учетную запись
Когда вы первый раз заходите с помощью соцсетей, мы получаем публичную информацию из вашей учетной записи, предоставляемой провайдером услуги соцсети в рамках ваших настроек конфиденциальности. Мы также автоматически получаем ваш e-mail адрес для создания вашей учетной записи на нашем веб сайте. Когда она будет создана, вы будете авторизованы под этой учетной записью.
Не согласен Согласен
Войти через
Я разрешаю создать мне учетную запись
Когда вы первый раз заходите с помощью соцсетей, мы получаем публичную информацию из вашей учетной записи, предоставляемой провайдером услуги соцсети в рамках ваших настроек конфиденциальности. Мы также автоматически получаем ваш e-mail адрес для создания вашей учетной записи на нашем веб сайте. Когда она будет создана, вы будете авторизованы под этой учетной записью.
Не согласен Согласен
0 комментариев
Межтекстовые Отзывы
Посмотреть все комментарии
На развитие сайта
Цитата:
Знание законов заключается не в том, чтобы помнить их слова, а в том, чтобы постичь их смысл. Марк Туллий Цицерон
древнеримский политик, оратор и философ.
Источник: himgdz.ru