Найди верный ответ на вопрос ✅ «Вычислить электродный потенциал серебра, опущенного в раствор его соли с концентрацией 0,001 моль/л . » по предмету Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Новые вопросы по химии
Что произойдёт с железом при взаимодействии с водой? 3 класс.
C8h18 формула глюкозы
1. Цинк растворили в концентрированной азотной кислоте. Полученный газ растворили в горячей воде. В ходе этого взаимодействия образовался бесцветный газ. Он легко окисляется кислородом воздуха до образования бурого газа.
Закончите формулы. H2+CuO= Na+HCl =
Что такое макроэлементы и ультромикроэлементы?
Главная » Химия » Вычислить электродный потенциал серебра, опущенного в раствор его соли с концентрацией 0,001 моль/л
Источник: urokam.net
РАСЧЕТ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ
Произведением растворимости малорастворимого электролита является произведение активностей ионов насыщенного раствора при неизменных температуре и давлении. Оно является величиной постоянной.
Как Раскрыть Свой Потенциал: Достигни Предела СВОИХ ВОЗМОЖНОСТЕЙ
Каждый малорастворимый электролит КАт посылает в раствор п катионов К т+ и т анионов А п ~. Поэтому в общем виде для малорастворимого электролита КАтпроизведение растворимости выражается уравнением: ПР = акгаА„_,
где акт. и аА„_ — активности катиона и аниона соответственно».’ По произведению растворимости AgCI
можно рассчитать эту активность: аДд+ = ПР/аС|„.
Подставляем последнее в уравнение Нернста и расписываем логарифм:

Если активность хлорид-ионов равна единице, потенциал равен сумме двух констант и может рассматриваться как стандартный потенциал полуреакции

если учесть, что ПР = 1,75 ? 10~ 10 для AgCI при 25°С.
Аналогичным способом можно найти потенциал серебряного электрода в растворе, содержащем ион, который образует с ионом серебра растворимый комплекс. Например, рассмотрим полуреак- цию:

Стандартный электродный потенциал этой полуреакции равен электродному потенциалу при условии, что активности комплекса и лиганда равны единице.
Проводя аналогичные вычисления, можно найти:

где К — константа устойчивости комплекса. Антилогарифмируя последнее выражение, т.е.

можно получить выражение для константы устойчивости в зависимости от величины стандартного потенциала.
Причины отличия расчетных значений стандартных электродных потенциалов от реальных
Окислительно-восстановительные системы, в зависимости от скорости реакций, протекающих на электродах, подразделяются на обратимые и необратимые. Стандартные потенциалы обратимых систем измерены непосредственно, тогда как стандартные потенциалы необратимых систем в большинстве случаев находят путем термодинамических расчетов. Вследствие этого на практике их величины оказываются иными, так как на них оказывают большое влияние многие факторы. Поэтому гораздо большее практическое значение имеют формальные (реальные) потенциалы окислительно-восстановительных систем. Формальный потенциал системы есть потенциал полуэлемента относительно стандартного электродного электрода при условии, что концентрации каждого реагирующего вещества и продукта равны одному молю и концентрации любых других компонентов раствора точно известны.
Как НАЙТИ свой СКРЫТЫЙ ПОТЕНЦИАЛ? | философия Карла Юнга
Источник: studref.com
Расчет произведений растворимости и констант устойчивости комплексов по величинам стандартных потенциалов
Знание величин стандартных потенциалов полуреакций с участием малорастворимых или комплексных соединений позволяет решить и обратную задачу — рассчитать произведение растворимости или константу устойчивости комплексного соединения.
ПРИМЕР 10. Рассчитайте произведение растворимости бромида серебра из величин стандартных потенциалов систем AgBr/Ag и Ag + /Ag.
Решение. Запишем уравнения полуреакций
AgBr + e ↔ Ag + Вr —
и найдем в таблицах величины соответствующих стандартных потенциалов E°AgBr/Ag = +0.071 В и E°(Ag + /Ag) = 0.799 В.
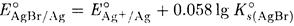
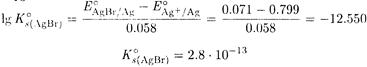
ПРИМЕР 11. Рассчитайте константу устойчивости комплекса CdL4 2- , если известно, что стандартные потенциалы полуреакций Cd 2+ + 2е ↔ Cd и CdL4 2- + 2e ↔ Cd + 4L — равны — 0.403 В и — 0.958 В соответственно.
Решение. Для полуреакции CdL4 2- + 2e ↔ Cd + 4L — стандартпый потенциал можно выразить через Е° полуреакции Cd 2+ + 2е ↔ Cd и константу устойчивости β°4комплекса CdL4 2- :
Источник: studopedia.su