Потенциал серебряного электрода имеет вполне определенную зависимость от концентрации ионов хлора в растворе. Поэтому если такой электрод погрузить в неводный электролит с растворенной в нем нефтью, то по величине его потенциала можно судить о содержании хлоридов в нефти. Зависимость потенциала серебрян-ного электрода от концентрации хлоридов имеет нелинейный, логарифмический характер. Для этого метода характерны непостоянство потенциала при малом содержании солей в нефти, зависимость потенциала от состава растворителя, наличия в растворителе и в нефти различных примесей, в частности соединения серы и непредельных углеводородов. Хотя изменения потенциала от содержания хлоридов довольно значительны и составляют примерно 70 мв при изменении концентрации хлоридов в 10 раз, однако отсутствие стабильности и воспроизводимости потенциала не позволяют рассчитывать на достаточную точность и универсальность этого метода. [1]
Потенциал серебряного электрода зависит от концентрации ионов серебра, на которую в свою очередь влияет присутствие ионов сульфида, так как сульфид вступает в реакцию с ионами серебра, образуя относительно нерастворимые соли. [2]
Продукты в ОВР. Ч.2-1. Электродный потенциал металлов.
Когда изменение потенциала серебряного электрода превысит 20 мв / мл, раствор AgNO3 приливают по каплям, пока скачок потенциала не будет пройден, затем снова приливают по 1 мл, а вблизи второй точки эквивалентности-по каплям. [3]
Когда изменение потенциала серебряного электрода превысит 20 мв / мл, раствор AgNO, приливают по каплям, пока скачок потенциала не будет пройден, затем снова приливают по 1 мл, а вблизи второй точки эквивалентности-по каплям. [4]
Аналогичным способом можно выразить потенциал серебряного электрода в растворе, содержащем ион, который образует с ионом серебра растворимый комплекс. [5]
Так, резкий скачок потенциала серебряного электрода в момент переключения зарядного тока на второй ступени с малых значений на большие — явление, которое раньше связывалось со старением анодных продуктов [21], объясняется следующим. При медленных режимах заряда на второй ступени реакционная поверхность серебряного электрода в меньшей степени отличается по составу от переходного слоя, чем при быстрых, поскольку при этом создаются лучшие условия для диффузии ионов кислорода в глубь электрода.
Поэтому с уменьшением величины зарядного тока сопротивление серебряного электрода на второй ступени и внутреннее сопротивление аккумулятора возрастают. Как видно из рис. 113, с уменьшением зарядного тока растет величина пика сопротивления, а также величина внутреннего сопротивления аккумулятора на второй ступени. При 12-шс режиме заряда максимум сопротивления равен примерно 0 5 ом, а сопротивление на второй ступени составляет около 0 04 ом. Для 120 — и 600-чос режимов эти величины соответственно равны 0 8; 0 25 ом и 1 0; 0 52 ом. [6]
Так, резкий скачок потенциала серебряного электрода в момент переключенля зарядного тока на второй ступени с малых значений на большие — явление, которое раньше связывалось со старением анодных продуктов [21], объясняется следующим. При медленных режимах заряда на второй ступени реакционная поверхность серебряного электрода в меньшей степени отличается по составу от переходного слоя, чем при быстрых, поскольку при этом создаются лучшие условия для диффузии ионов кислорода в глубь электрода. Поэтому с уменьшением величины зарядного тока сопротивление серебряного электрода на второй ступени и внутреннее сопротивление аккумулятора возрастают. Как видно из рис. 129, с уменьшением зарядного тока растет величина пика сопротивления, а также величина внутреннего сопротивления аккумулятора на второй ступени. [8]
Электрохимический ряд потенциалов. 1 часть. 10 класс.
Найдем кривые сила тока — потенциал серебряного электрода в ходе этой реакции. [10]
Эквивалентную точку находят по резкому изменению потенциала серебряного электрода . [11]
В приложении 2 приведены данные для потенциала серебряного электрода в присутствии некоторых ионов. Подобная информация имеется и для других электродных систем. Эти данные часто упрощают вычисления потенциалов полуреакций. [12]
Воспользовавшись знакомыми формулами, можно легко подсчитать потенциал серебряного электрода , опущенного в титруемый раствор. [14]
До начала титрования при включенной мешалке определяют первоначальный потенциал серебряного электрода и приступают к титрованию раствором AgNOs. Измерение потенциала серебряного электрода проводят после каждого добавления 0 1 -ил раствора AgNOs. [15]
Источник: www.ngpedia.ru
Решение задач с использованием уравнения Нернста (Nernst)
Решение задач по химии с использованием уравнениея Нернста
Задание 246.
Потенциал серебряного электрода в растворе АgNO3 составил 95% от значения его стандартного электронного потенциала. Чему равна концентрация ионов Аg+ (моль/л). Ответ: 0,20 моль/л.
Решение:
Электродный потенциал металла (Е)зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Используя уравнение Нернста, получим выражение для расчета концентрации ионов Ag + в растворе:
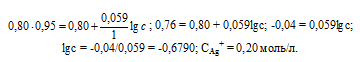
Ответ: 0,20 моль/л.
Задание 247.
Составьте схему, напишите электронные уравнения электродных процессов, и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Сd 2+ ] = 0,8 моль/л, а [Сu 2+ ] = 0,01 моль/л. Ответ: 0,68 В.
Решение:
Схема данного гальванического элемента:
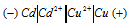
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Кадмий имеет меньший потенциал (—0,403 В) и является анодом, на котором протекает окислительный процесс:
Cd 0 — 2 = Cd 2+ (1)
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu 2+ + 2 = Cu 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Cd 0 + Cu 2+ = Cd 2+ + Cu 0
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы кадмия и меди при заданных концентрациях:
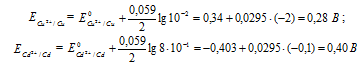
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода. Так как концентрация ионов в растворе 1 молы/л, то ЭДС элемента равна разности стандартных потенциалов двух его электродов:
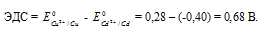
Ответ: 0,68 В.
Задание 248.
Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом — анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде.
Решение:
а) Схема гальванического элемента, в котором медь является катодом:
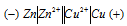
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Цинк имеет меньший потенциал (-0,763 В) и является анодом, на котором протекает окислительный процесс:
Zn 0 — 2 = Zn 2+ (1)
Медь, потенциал которой +0,34 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Cu 2+ + 2 = Сu 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Zn 0 + Cu 2+ = Zn 2+ + Cu 0
б) Схема гальванического элемента, в котором медь является анодом:
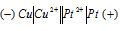
Медь имеет меньший потенциал (+0,34 В) и является анодом, на котором протекает окислительный процесс:
Cu 0 — 2 = Cu 2+ (1)
Платина, потенциал которой +1,19 В, катод, т.е. электрод, на котором протекает восстановительный процесс:
Pt 2+ + 2 = Pt 0 (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Сu 0 + Pt 2+ = Cu 2+ + Pt 0
Задание 249.
При какой концентрации ионов Сu 2+ (моль/л) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода? Ответ: 2,98 . 10 -12 моль/л..
Решение:
Определим концентрацию ионов Cu 2+ , при которой потенциал медного электрода равен 0,00 В, получим:
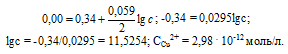
Ответ: 2,98 . 10 -12 моль/л.
Задание 250.
Какой гальванический элемент называют концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в 0,01 н., а второй в 0,1 н. растворы AgNO3. Ответ: 0,059 В.
Решение:
Гальванический элемент, работа которого основана на различных концентрациях ионов металла у катода и у анода, называется концентрационным. Обычно катод и анод сделаны из одного и того же металла, опущенных в растворы своей соли разной концентрации. Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:

Е 0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Определим электродные потенциалы серебряных электродов при разных концентрациях ионов серебра Ag+, получим:
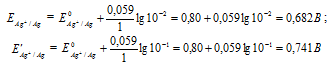
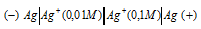
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода, получим:
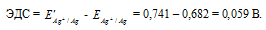
Ответ: 0,059 В.
- Вы здесь:
- Главная

- Задачи

- Химия-Шиманович

- Свойства марганца| Задания 417 — 422
Источник: buzani.ru
Эталоны решения задач
Задача 1. Вычислить потенциал медного электрода, если медная пластинка опущена в раствор медного купороса с активностью ионов меди 0,02 моль/л при 25 0 С. Стандартный потенциал медного электрода равен +0,34В.
| Дано: | Решение |
| aCu 2+ = 0,02 моль/л j 0 Cu 2+ /Cu = +0,34В jCu 2+ /Cu –? | Уравнение Нернста для расчета значения электродного потенциала, возникающего на границе металл-раствор, имеет вид: j = j 0
= j 0  + +  . Переходя от натурального логарифма к десятичному получаем: . Переходя от натурального логарифма к десятичному получаем: |
j  = j 0
= j 0  +
+ 

Схема медного электрода: Сu|Cu 2+ и на электроде протекает процесс Cu 2+ + 2ē ⇄ Cu, отсюда n = 2. При 298К сомножитель = 0,059, а уравнение примет вид:

j Cu 2+ /Cu= j 0 Cu 2+ /Cu +

Отсюда находим, что j Cu 2+ /Cu= + 0,34 + 0,02 = +0,34 + 0,0295 × lg 2×10 –5 = 0,34 + +0,029 × (–1,7) = 0,34 – 0,05 = 0,29B
Задача 2. Найти ЭДС элемента при 25 0 С, составленного из серебряного и свинцового электродов, металлические пластинки которых погружены в раствор нитрата серебра с концентрацией 0,1 моль/л и раствор нитрата свинца (II) с концентрацией 0,25 моль/л (считать, что коэффициент активности в обоих случаях равен 1), если значения стандартных электродных потенциалов серебра и меди соответственно равны + 0,80В и
| Дано: | Решение |
| C(AgNO3)= 0,1 моль/л C(Pb(NO3)2)=0,25 моль/л j 0 Ag + /Ag= + 0,80В j 0 Pb 2+ /Pb= – 0,13В Е =? | Так как j 0 Ag + /Ag > j 0 Pb 2+ /Pb, то катодом является серебряный электрод, а анодом – свинцовый электрод. Записываем схему гальванического элемента: ⊝Pb½Pb 2+ ║Ag + ½ Ag⊕ |
Записываем уравнения реакций, протекающие на электродах:
| анод: Pb – 2ē = Pb 2+ |
| катод: Ag + + ē = Ag 0 |
| Pb + 2Ag + = Pb 2+ + 2Ag 0 |
ЭДС гальванического элемента равен: Е = j катода – j анода или в нашем случае

При 25 0 С потенциал серебряного электрода: j Ag + /Ag= j 0 Ag + /Ag + ,

где aAg + = C×fa, отсюда jAg + /Ag= 0,8 + lg 0,1×1=0,8 + 0,059×(–1) = 0,741B
2. Для свинцового электрода: jPb 2+ /Pb= j 0 Pb 2+ /Pb +  = –0,13+
= –0,13+  lg 0,25×1= –0,13 + 0,0295×(–0,6) = –0,3 – 0,0177 = –0,3177В
lg 0,25×1= –0,13 + 0,0295×(–0,6) = –0,3 – 0,0177 = –0,3177В
3. Е = 0,741 – (–0,3177) = 1,0587В
Задача 3. Определите ЭДС концентрационного гальванического элемента при 25 0 С, составленного из двух серебряных электродов, погруженных в растворы нитрата серебра с активностью ионов серебра 1 моль/л и 0,5 моль/л. Стандартный электродный потенциал серебряного электрода равен +0,80В.
| Дано: | Решение |
| a1(Ag + )= 0,5моль/л a2(Ag + )= 1,0 моль/л j 0 Ag + /Ag= + 0,80В E –? | Записываем схему гальванического элемента: ⊝Ag½Ag + (0,5 моль/л) ║Ag + (1 моль/л) ½Ag ⊕, ЭДС концентрационного гальванического элемента равна: Е =  , где n = 1, a а2 > а1 , где n = 1, a а2 > а1 |

При 25 0 С Е = = 0,059 lg2=0,059×0,3=0,0177B

Задача 4. Стандартный ОВ потенциал системы + 8Н + + 5ē ® Mn 2+ + 4Н2О
равен + 1,52В. Рассчитайте ОВ потенциал этой системы при увеличении рН раствора до 5.
Дано: j 0   = +1,52В рН = 5 j = +1,52В рН = 5 j   –? –? |
Решение Уравнение Петерса для расчета ОВ потенциала данной системы имеет вид: j   =j 0 =j 0   + +  , где n = 5 , где n = 5 |

По сравнению со стандартными условиями изменилась только активная концентрация Н + – ионов: т.к. рН = 5, то = 10 –5 моль/л. Поэтому
j 
 = j 0
= j 0 
 +
+  = 1,52 + 0,0118 × lg10 –40 = 1,52 – 0,472 = 1,048В
= 1,52 + 0,0118 × lg10 –40 = 1,52 – 0,472 = 1,048В
Источник: studopedia.org