Латинское zincum переводится как «белый налет». Происхождение этого слова точно не установлено. Предположительно, оно идет от персидского «ченг», хотя это название относится не к цинку, а вообще к камням. Слово «цинк» встречается в трудах Нахождение в природе [ ]
В природе встречается только в виде соединений, важнейшим из которых является цинковая обманка ZnS и цинковый шпат ZnСО3.
Получение [ ]
Цинк в природе как самородный метал не проявляется, рудообразующий минерал цинка — сфалерит ZnS и цинковый спат ZnCO3.
Физические свойства [ ]
В чистом виде — довольно пластичный серебристо-белый Химические свойства [ ]
Типичный амфотерный металл. Стандартный электродный потенциал −0,76 В, в ряду стандартных потенциалов расположен до железа.
На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
Оксид цинка реагирует как с растворами кислот:
ZnO + серой и ее аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
Какой цинк мне нравится Доктор Лисенкова #shorts
Цинкование 45-60% В медицине(оксид цинка как антисептик) 10% Производство сплавов 10% Производство резиновых шин 10% Масляные краски 10%
Чистый металлический цинк используется для восстановления благородных металлов добываемых подземным выщелачиванием (золото, серебро). Кроме того, цинк используется для извлечения серебра, золота и др. Из чернового свинца в виде так называемой «серебристой пены» интерметаллидов цинка с серебром и золотом, и обрабатываемых обычными методами аффинажа.
| — | Файл:Map projection-Eckert IV.png Планета | 10,000,000 |
| 1 | Файл:Flag of the People’s Republic of China.svg Китай | 2,600,000 [2] |
| 2 | Файл:Flag of Australia.svg 1,380,000 | |
| 3 | Файл:Flag of Peru.svg 1,201,794 | |
| 4 | 727,000 | |
| 5 | Файл:Flag of Canada.svg 710,000 | |
| 6 | Файл:Flag of Mexico.svg 480,000 [2] | |
| 7 | Республика Ирландия 425,700 | |
| 8 | Файл:Flag of India.svg 420,800 | |
| 9 | Файл:Flag of Kazakhstan.svg 400,000 [2] | |
| 10 | Файл:Flag of Sweden.svg 192,400 | |
| 11 | Файл:Flag of Russia.svg Россия | 190,000 [2] |
| 12 | Файл:Flag of Brazil.svg 176,000 [2] | |
| 13 | Файл:Flag of Bolivia.svg 175,000 [2] | |
| 14 | Файл:Flag of Poland.svg 135,600 | |
| 15 | Файл:Flag of Iran.svg 130,000 [2] | |
| 16 | Файл:Flag of Morocco.svg 73,000 [2] | |
| 17 | Файл:Flag of Namibia.svg 68,000 [2] [3] | |
| 18 | Файл:Flag of North Korea.svg 67,000 [2] | |
| 19 | Файл:Flag of Turkey.svg 50,000 [2] | |
| 20 | Файл:Flag of Vietnam.svg 48,000 [2] | |
| 21 | Файл:Flag of Thailand.svg 45,000 [2] | |
| 22 | Файл:Flag of Honduras.svg 37,646 | |
| 23 | Файл:Flag of Finland.svg 35,700 | |
| 24 | Файл:Flag of South Africa.svg 34,444 | |
| 25 | Файл:Flag of Chile.svg Чили | 31,725 |
| 26 | Файл:Flag of Argentina.svg 30,300 [2] | |
| 27 | Файл:Flag of Bulgaria.svg 17,300 [2] | |
| 28 | Файл:Flag of Romania.svg 9,600 [2] | |
| 29 | Файл:Flag of Japan.svg Япония | 7,169 |
| 30 | Файл:Flag of Algeria.svg 5,000 [2] | |
| 31 | Файл:Flag of Saudi Arabia.svg 1,500 [2] | |
| 32 | Файл:Flag of Georgia.svg 400 [2] | |
| 33 | Файл:Flag of Bosnia and Herzegovina.svg Босния и Герцеговина | 300 [2] |
| 34 | Файл:Flag of Myanmar.svg 100 [2] |
7 удивительных и полезных свойств цинка Цинк для организма
Биологическая роль [ ]
См. также [ ]
- Категория: Соединения цинка
Ссылки [ ]
Примечания [ ]
- ↑Minerals Yearbook 2006
- ↑ 2,002,012,022,032,042,052,062,072,082,092,102,112,122,132,142,152,162,172,182,192,20 ориентировочно
- ↑ does not include ores sent to solvent extraction-electrowinning plant
Источник: vlab.fandom.com
Цинк

Цинк — элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 30. Обозначается символом Zn (лат. Zincum). Простое вещество цинк при нормальных условиях — хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).
В четвертом периоде цинк является последним d-элементом, его валентные электроны 3d 10 4s 2 . В образовании химических связей участвуют только электроны внешнего энергетического уровня, поскольку конфигурация d 10 является очень устойчивой. В соединениях для цинка характерна степень окисления +2.
Цинк – химически активный металл, обладает выраженными восстановительными свойствами, по активности уступает щелочно-земельным металлам. Проявляет амфотерные свойства.
Взаимодействие цинка с неметаллами
При сильном нагревании на воздухе сгорает ярким голубоватым пламенем с образованием оксида цинка:
2Zn + O2 → 2ZnO.
При поджигании энергично реагирует с серой:
Zn + S → ZnS.
С галогенами реагирует при обычных условиях в присутствии паров воды в качестве катализатора:
Zn + Cl2 → ZnCl2.
При действии паров фосфора на цинк образуются фосфиды:
Zn + 2P → ZnP2 или 3Zn + 2P → Zn3P2.
С водородом, азотом, бором, кремнием, углеродом цинк не взаимодействует.
Взаимодействие цинка с водой
Реагирует с парами воды при температуре красного каления с образованием оксида цинка и водорода:
Zn + H2O → ZnO + H2.
Взаимодействие цинка с кислотами
В электрохимическом ряду напряжений металлов цинк находится до водорода и вытесняет его из неокисляющих кислот:
Zn + 2HCl → ZnCl2 + H2;
Zn + H2SO4 → ZnSO4 + H2.
Реагирует с концентрированными серной и азотной кислотами с образованием соли цинка и продуктов восстановления кислот:
Zn + 2H2SO4 → ZnSO4 + SO2 + 2H2O;
Взаимодействие цинка со щелочами
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты:
Zn + 2KOH → K2ZnO2 + H2.
Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH3 → Zn3N2 + 3H2;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O → [Zn(NH3)4](OH)2 + H2.
Взаимодействие цинка с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO4 → Cu + ZnSO4;
Zn + CuO → Cu + ZnO.
Оксид цинка (II) ZnO – белые кристаллы, при нагревании приобретают желтую окраску. Плотность 5,7 г/см 3 , температура возгонки 1800°С. При температуре выше 1000°С восстанавливается до металлического цинка углеродом, угарным газом и водородом:
ZnO + C → Zn + CO;
ZnO + CO → Zn + CO2;
ZnO + H2 → Zn + H2O.
С водой не взаимодействует. Проявляет амфотерные свойства, реагирует с растворами кислот и щелочей:
ZnO + 2HCl → ZnCl2 + H2O;
ZnO + 2NaOH + H2O → Na2[Zn(OH)4].
При сплавлении с оксидами металлов образует цинкаты:
ZnO + MgO → MgZnO2.
При взаимодействии с оксидами неметаллов образует соли, где является катионом:
2ZnO + SiO2 → Zn2SiO4,
ZnO + B2O3 → Zn(BO2)2.
Гидроксид цинка (II) Zn(OH)2 – бесцветное кристаллическое или аморфное вещество. Плотность 3,05 г/см 3 , при температуре выше 125°С разлагается:
Zn(OH)2 → ZnO + H2O.
Гидроксид цинка проявляет амфотерные свойства, легко растворяется в кислотах и щелочах:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O;
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4];
также легко растворяется в водном растворе аммиака с образованием гидроксида тетраамминцинка:
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2.
Получается в виде осадка белого цвета при взаимодействии солей цинка со щелочами:
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl.
Источник: www.yoursystemeducation.com
Цинк (Zn, Zincum)
Цинк в чистом виде впервые выделил Уильям Чемпион в 1738 году, хотя латунь (сплав меди с цинком) использовали в Древнем Египте и Древней Греции (calorizator). Иногда первооткрывателем цинка называют немца С. Маргграфа, который в 1746 году разработал аналогичный способ выработки цинка и описал его более подробно, чем Чемпион.
Названием цинк обязан Парацельсу, в чьих трудах встречаются слова zincum и zinken, которыми назван металл, видимо, из-за схожести его кристаллитов с иглами (zinke – зубец).
Общая характеристика цинка
Цинк является элементом побочной подгруппы II группы IV периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 30 и атомную массу 65,39. Принятое обозначение – Zn (от латинского Zincum).

Нахождение в природе
Цинк достаточно распространённый элемент, он содержится в земной коре, практически во всех водных ресурсах Мирового Океана и во многих живых организмах. На сегодняшний день известно более 60-ти минералов цинка (сфалерит, цинкит, каламин и др.). крупные месторождения цинка обнаружены в Австралии, Боливии, Иране и Казахстане.
Физические и химические свойства
Цинк является хрупким, пластичным переходным металлом, имеет бело-голубоватый цвет, на воздухе покрывается слоем оксида цинка, что приводит к потускнению. При высоких температурах сгорает, образуя белый оксид цинка.
Суточная потребность в цинке
В сутки организм взрослого здорового человека должен получать от 9 до 11 мг цинка, дети – чуть меньше, от 2 до 8 мг, женщины в период беременности и кормления грудью – от 11 до 13 мг.
Продукты питания богатые цинком
Основные поставщики цинка – продукты питания, важный для жизнедеятельности организма элемент содержится в зелёных листовых овощах, брокколи, цветной капусте и редисе, моркови и кукурузе, зелёном луке, фасоли, горохе и чечевице, авокадо и ягодах, арахисе, кокосе, грецких и кедровых орехах, кунжуте, пшенице, овсянке и рисе. Присутствует цинк и в продуктах животного происхождения – свинине и баранине, говядине и индейке, мясе утки и говяжьем языке, морепродуктах и рыбе, плавленом сыре и яичном желтке.

Полезные свойства цинка и его влияние на организм
Функции и полезные свойства цинка:
- участие в формировании костных тканей,
- предупреждение диабета,
- препятствие появлению эпилепсии,
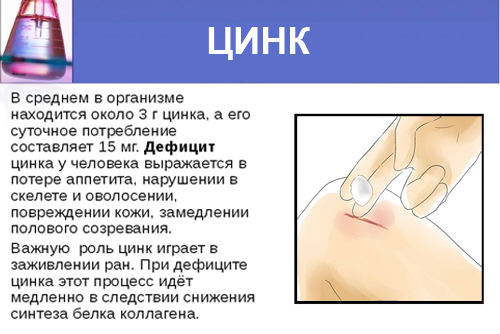
- обеспечение быстрого заживления ран,
- пособничество всасыванию витамина А,
- улучшение состояния волос,
- положительное влияние на умственные способности человека,
- профилактика возникновения артрита и ревматизма.
Взаимодействие с другими
Цинк необходим для метаболизма витамина E, витамин А действует только в присутствии цинка. Витамин С и цинк — хорошее средство против катаров и многих вирусных заболеваний.
Признаки нехватки цинка
Нехватка цинка в организме человека характеризуется следующими симптомами:
- расстройства деятельности желудочно-кишечного тракта,
- хрупкость ногтей и появление на них белых пятен,
- истощение и выпадение волос,
- потеря чувства вкуса и аппетита,
- незаживление мелких ран,
- нервозность, быстрая утомляемость,
- снижение памяти.
Признаки избытка цинка
Применение цинка в жизни
Цинк в чистом виде используется как восстановитель благородных металлов, как защита стали от коррозии, для производства аккумуляторов, в полиграфической промышленности, в медицине, производстве различных сплавов, резиновых шин и масляных красок.

Источник: calorizator.ru