- Общие сведения.
Формула: Na2B4O7 Термин «Бура» применяют по отношению к нескольким близким веществам: она может существовать в безводной форме, в природе чаще встречается в виде пятиводного или десятиводного кристаллогидрата:
- Безводная бура (Na2B4O7)
- Пентагидрат (Na2B4O7·5H2O)
- Декагидрат (Na2B4O7·10H2O)
Однако наиболее часто слово бура относят к соединению Na2B4O7·10H2O. Тетраборат натрия (Бура) встречается в солевых отложениях, образованных при испарении сезонных озёр Бура́ (декагидрат тетрабората натрия, Na2B4O7 · 10H2O) — прозрачные кристаллы, при нагревании до 400 °C полностью теряют воду. В воде бурагидролизуется, ее водный раствор имеет щелочную реакцию. С оксидами многих металлов бура при нагревани образует окрашенные соединения — бораты («перлы буры»).
- Получение.
Способы получения буры сохранялись в строжайшей тайне, их не знали даже европейские алхимики. Тем не менее, алхимики отличали буру от соды, хотя как именно они это делали, неизвестно: ведь оба вещества схожи в том, что дают щелочную среду при растворении в воде и поэтому вытесняют аммиак из хлорида аммония. Щелочная реакция раствора тетрабората натрия обусловлена тем, что в водном растворе протекает реакция гидролиза c образованием в растворе борной кислоты B(OH) 3: Na2B4O7 = 2Na + + B4O7 2– ; B4O7 2– + 7H2O 2OH – + 4B(OH)3, а выделение аммиака при взаимодействии с NH4Cl отвечает уравнению: Na2B4O7 + 2NH4Cl + H2O = 2NH3 + 2NaCl + 4B(OH) 3 Хотя в 16–17 вв. химики не имели представления о точном составе получаемых и используемых ими веществ, а об их свойствах судили по самым примитивным признакам, вроде пробы на вкус, им удавалось иногда сделать замечательные открытия. Так, голландский алхимик Вильгельм Гомберг, нагревая буру с серной кислотой H2SO4, выделил борную кислоту B(OH)3. При этом протекала реакция: Na2B4O7·10H2O + H2SO4 = B(OH)3 + Na2SO4 + 5H2O А в 1751 Анри Дюамель де Монсо установил, что в составе буры, как и в составе соды, содержится элемент «натр». Можно только догадываться, как именно за три тысячи лет до нашей эры люди натолкнулись на буру. Возможно, индус-паломник, отдыхая на берегу озера, бросил в костер кусок неведомого белого вещества и заметил, что пламя стало зеленым, а вещество оплавилось и стало похоже на стекло. Позже, вероятно, обнаружили, что бура, как и сода, помогает отстирывать одежду от грязи (мыла еще не было). Постепенно люди научились использовать буру для дубления кож, в производстве стекла и глазурей, наконец, как лекарство – антисептик для промывания горла.
- Качественный анализ.
- Аналитические реакции на катион натрия.
1. Реакция с ацетатом диоксоуран(VI)цинка Zn(UO2)3(CH3COO)8 c образованием жёлтого кристаллического осадка (фармакопейная реакция — ГФ) или жёлтых кристаллов тетра- и октаэдрической формы, нерастворимых в уксусной кислоте (МКС). Для повышения чувствительности реакции следует нагреть исследуемую смесь на предметном стекле. NaCl + Zn(UO2)3(CH3COO)8 + CH3COOН + 9 H2O  NaZn(UO2)3(CH3COO)9 · 9 H2O + HCl Мешающие ионы: избыток ионов K + , катионы тяжёлых металлов (Hg2 2+ , Hg 2+ , Sn 2+ , Sb 3+ , Bi 3+ , Fe 3+ и др.). Реакция используется как дробная после удаления мешающих катионов. 2. Окрашивание бесцветного пламени горелки в жёлтый цвет (ГФ). 3. Реакция с пикриновой кислотой с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящих из одной точки (МКС). Error: Reference source not found Реакция используется как дробная только в отсутствие мешающих ионов (K + , NH4 + , Ag + ). 4. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах. NaCl + K[Sb(OH)6]
NaZn(UO2)3(CH3COO)9 · 9 H2O + HCl Мешающие ионы: избыток ионов K + , катионы тяжёлых металлов (Hg2 2+ , Hg 2+ , Sn 2+ , Sb 3+ , Bi 3+ , Fe 3+ и др.). Реакция используется как дробная после удаления мешающих катионов. 2. Окрашивание бесцветного пламени горелки в жёлтый цвет (ГФ). 3. Реакция с пикриновой кислотой с образованием кристаллов пикрата натрия жёлтого цвета игольчатой формы, исходящих из одной точки (МКС). Error: Reference source not found Реакция используется как дробная только в отсутствие мешающих ионов (K + , NH4 + , Ag + ). 4. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах. NaCl + K[Sb(OH)6] 
 KCl + H3SbO4 + 2 H2O H3SbO4
KCl + H3SbO4 + 2 H2O H3SbO4 HSbO3 + H2O
HSbO3 + H2O
- Аналитические реакции на -ион.
1. С групповым реагентом BaCl2 + CaCl2 2. С куркумовой бумагой (ГФ). Куркумовая бумага, смоченная раствором тетрабората натрия (или ортоборной кислоты) и несколькими каплями разбавленной хлороводородной кислоты, окрашивается при высушивании в розовый цвет, переходящий в зеленовато-чёрный при дальнейшем смачивании бумаги раствором аммиака. Мешают анионы-окислители, обесцвечивающие куркумовую бумагу. 3. Реакция этерификации с этиловым спиртом в присутствии концентрированной серной кислоты. Na2B4O7 + H2SO4 + 5 H2O 
 B(OC2H5)3 + 3 H2O Методика: 0,2 г борной кислоты (или тетрабората натрия) помещают в фарфоровую чашку. Для дробного открытия выпаривают досуха 1 см 3 испытуемого раствора в фарфоровой чашке, прибавляют 1 см 3 концентрированной серной кислоты, 3 см 3 этанола и перемешивают. При зажигании смесь горит пламенем, окаймленным зелёным цветом. Выполнению реакции мешают хлорид-, бромид-, иодид-ионы. Их удаляют выпариванием с серной кислотой до появления «белого дыма».
B(OC2H5)3 + 3 H2O Методика: 0,2 г борной кислоты (или тетрабората натрия) помещают в фарфоровую чашку. Для дробного открытия выпаривают досуха 1 см 3 испытуемого раствора в фарфоровой чашке, прибавляют 1 см 3 концентрированной серной кислоты, 3 см 3 этанола и перемешивают. При зажигании смесь горит пламенем, окаймленным зелёным цветом. Выполнению реакции мешают хлорид-, бромид-, иодид-ионы. Их удаляют выпариванием с серной кислотой до появления «белого дыма».
- Количественный анализ.
Стандартизация 0,1 М раствора хлороводородной кислотыпо стандартному раствору тетрабората натрия (способ пипетирования)Na2B4O7+ 2HCl+ 5H2O= 2NaCl+ 4H3BO3 М (Na2B4O710H2O) = 381, 37г/моль А. Приготовление стандартного 0,1 М раствора тетрабората натрия Методика приготовления титрованного раствора по точной навеске приведена в таблице «Способы приготовления титрованных растворов» (тетраборат натрия растворяют в горячей воде) см. табл. 1 стр. 21. Поправочный коэффициент раствора КП рассчитывают по формуле: 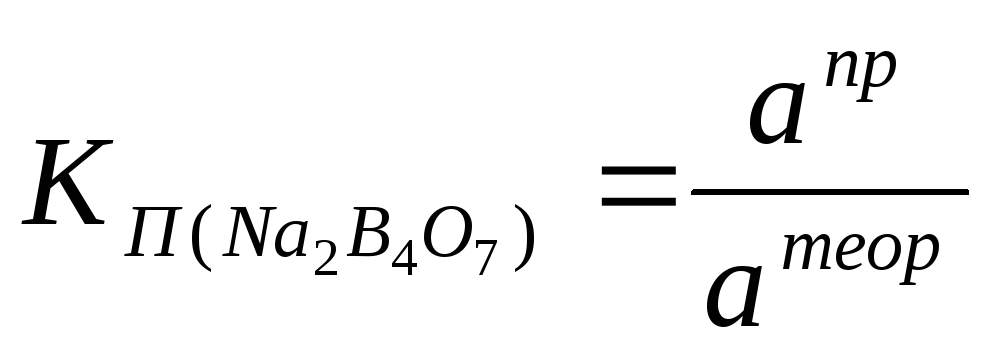 а пр – практическая навеска тетрабората натрия, г а теор – навеска теоретическая тетрабората натрия, г. Б. Установка КП0,1 М раствора хлороводородной кислотыМетодика:Точно отмеривают пипеткой 10-15 см3стандартного раствора тетрабората натрия в колбу для титрования, прибавляют 1-2 капли раствора метилового оранжевого и титруют 0,1 М раствором хлороводородной кислоты до перехода жёлтой окраски в розовато-оранжевую. Здесь и далее расчёт КП раствора с точностью до четвёртого знака после запятой, исходя из основного уравнения титриметрического анализа, производят по среднему значению из трёх параллельных титрований
а пр – практическая навеска тетрабората натрия, г а теор – навеска теоретическая тетрабората натрия, г. Б. Установка КП0,1 М раствора хлороводородной кислотыМетодика:Точно отмеривают пипеткой 10-15 см3стандартного раствора тетрабората натрия в колбу для титрования, прибавляют 1-2 капли раствора метилового оранжевого и титруют 0,1 М раствором хлороводородной кислоты до перехода жёлтой окраски в розовато-оранжевую. Здесь и далее расчёт КП раствора с точностью до четвёртого знака после запятой, исходя из основного уравнения титриметрического анализа, производят по среднему значению из трёх параллельных титрований 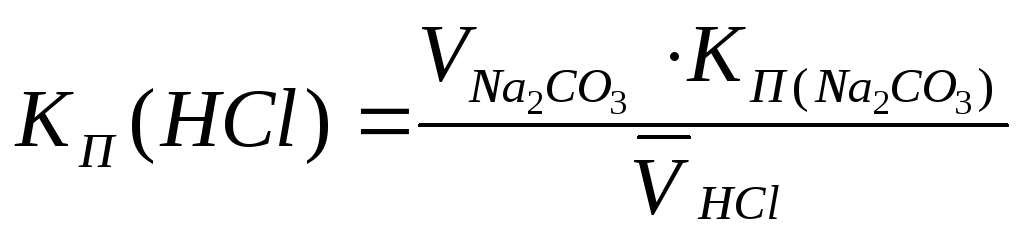
- Применение.
- в производстве эмалей, глазурей, оптических и цветных стекол;
- при пайке в качестве флюса;
- в бумажной и фармацевтической промышленности;
- как дезинфицирующее и консервирующее средство;
- в аналитической химии:
- как стандартное вещество для определения концентрации растворов кислот;
- для качественного определения оксидов металлов (по цвету перлов);
- Список литературы.
- Лурье Ю.Ю. Справочник по аналитической химии. Москва, 1972;
- Методическое указание «Инструментальные методы анализа», Пермь, 2004;
- Методическое указание «Качественный химический анализ», Пермь, 2003;
- Методическое указание «Количественный химический анализ», Пермь, 2004;
- Рабинович В.А., Хавин З.Я. Краткий химический справочник, Ленинград, 1991.
Ограничение
Как сделать буру в домашних условиях?
Для продолжения скачивания необходимо пройти капчу:
Источник: studfile.net
формула бура
Ответ от Андрей Гулин[гуру]
Определить — элементарно: под действием уксуса сода начинает «шипеть».
По поводу качественной реакции на буру — несколько сложнее: можно попробовать реакцию образования перлов, но как сделатьэто в домашних условиях — ?
Андрей Гулин
Просветленный
(29559)
Нет, не будет. Кстати, Вы спрашивали формулу буры, сразу упустил: Na2B4O7*10H2O
Ответ от Александр Зацаринный[гуру]
На стакан воды чайную ложку белого порошка и столовую ложку уксуса. Сода вступает в реакцию с образованием углекислоты, образуя обильное газовыделение.
Ответ от Ѕимик[гуру]
Сода не будет давать осадок с хлоридом бария, а бура будет — это одна из качественных реакций на тетраборат-анион. Бура формула Na2B4O7
Ответ от 22 ответа[гуру]
Привет! Вот подборка тем с похожими вопросами и ответами на Ваш вопрос: Имеется белый порошок. Как определить, сода эта или бура? Формула буры, качественная реакция ее?
Источник: 22oa.ru
Бура (тетраборат натрия декагидрат, бура десятиводная, натрий борнокислый, борат натрия, тетраборат динатрия)

Бура представляет собой бесцветный кристаллический порошок растворимый в воде. В воде бура гидролизуется, ее водный раствор имеет щелочную реакцию. С оксидами многих металлов бура при нагревани образует окрашенные соединения — бораты. В природе встречается в виде минерала тинкаля.
Плотность — 1,71 г/см³. Температура плавления 741° C.
Термин «Бура» применяют по отношению к нескольким близким веществам: она может существовать в безводной форме, в природе чаще встречается в виде пятиводного или десятиводного кристаллогидрата.
Техническую буру (тетраборат натрия декагидрат) получают нейтрализацией борной кислоты карбонатом натрия.

Применение буры.
В зависимости от назначения техническую буру выпускают двух марок: А и Б. Они широко применяются:
в производстве оптических и цветных стекол, стекловолокна и стеклоткани;
в производстве эмалей и глазурей;
в производстве тосола, смазок, тормозных жидкостей;
в производстве строительных материалов как компонент антипирена и антисептика для эковаты, клеев и ДСП;
при сварке, резке и пайке металлов в качестве флюса;
в бумажной, косметической и фармацевтической промышленности;
как дезинфицирующее и консервирующее средство;
в аналитической химии, как стандартное вещество для определения концентрации растворов кислот, а также для качественного определения оксидов металлов (по цвету перлов);
в фотографии — в составе медленно действующих проявителей в качестве слабого ускоряющего вещества;
как основной кислородсодержащий отбеливающий компонент моющих, чистящих средств и отбеливателей;
как сырье для получения источников оксида бора — противоокислительного агента.
Физико-химические показатели буры технической ГОСТ 8429-77:

Требования безопасности буры технической ГОСТ 8429-77:

Требования безопасности.
Бура пожаро- и взрывобезопасна, токсичность обусловлена основным исходным компонентом — борной кислотой, которая по степени воздействия на организм относится к веществам 3-го класса опасности.
Упаковка, транспортировка и хранение.
Буру упаковывают в четырехслойные бумажные мешки, пленочные мешки-вкладыши, вложенные в льно-джуто-кенафные, четырехслойные бумажные или дублированные резинобитумной смесью мешки. Допускается упаковывать продукт в специализированные мягкие контейнеры разового использования.
Буру транспортируют железнодорожным и автомобильным транспортом, в универсальных контейнерах. Продукт, упакованный в мягкие специализированные контейнеры, транспортируют на открытом подвижном составе.
Буру хранят в упакованном виде в закрытых складских помещениях. Продукт, упакованный в специализированные мягкие контейнеры разового использования, допускается хранить на незагрязненных открытых площадках, имеющих твердое покрытие со стоком вод при условиях, обеспечивающих работу грузовых механизмов.
Гарантийный срок хранения продукта — 6 месяцев со дня изготовления.
ООО “ФАСТЕХ” осуществляет поставки химической продукции со склада в Белгороде в сроки и по доступным ценам, на выгодных для Вас условиях.
Источник: www.promglobal.ru