Титрование – процесс, в котором к определяемому веществу по каплям добавляют раствор титранта, точно до того момента, при котором количество добавляемого титранта строго эквивалентно количеству определяемого вещества.
Осадительное титрование основано на реакциях, сопровождающихся образованием малорастворимых соединений. Для этого необходимо соблюдение ряда условий:
- Осадок должен быть практически нерастворимым.
- Выпадение осадка должно происходить достаточно быстро (т.е. не должно сказываться явление образования пересыщенных растворов).
- Результаты титрования не должны в заметной степени искажаться явлениями адсорбции (соосаждения).
- Должна иметься возможность фиксировать точку эквивалентности при титровании.
Наиболее распространенным является метод, основанный на применении титрованных растворов серебра – аргентометрия. Этим методом определяют как галогениды и роданид – ион, так и серебро в различных образцах. Ag+ + X = AgX (осадок) (X = Cl-, Br-, I-, SCN-).
Определение хлорид-ионов
Определение хлорид — ионов методом Мора.
Метод основан на прямом титровании раствора, содержащего хлорид – ионы стандартным раствором нитрата серебра в присутствии индикатора – хромата калия. Применение хромата –калия в качестве индикатора основано на способности CrO42- давать с Ag+ кирпично – красного цвета осадок Ag2CrO4, который в определенных условиях начинает выпадать лишь после того, как определяемые Cl- ионы будут практически полностью осаждены в виде AgCl.
Ag+ + Cl- = AgCl (осадок)
2Ag+ + CrO4 2- = AgCrO4 (кирпично – красный цвет).
Фиксирование точки эквивалентности происходит благодаря тому, что в колбу для титрования добавляют K2CrO4.
До точки эквивалентности: Cl- + Ag+ = AgCl (осадок)
В точке эквивалентности: AgCl, CrO4.
После точки эквивалентности: CrO4 2- + 2Ag+ = Ag2CrO4 (осадок)
К. Т. Т. – конечная точка титрования. Ошибка титрования связана с тем, что нам нужно перетитровать раствор. Точка эквивалентности неравна К.Т.Т.
ПР (AgCl) меньше, чем ПР (Ag2CrO4).
При проведении определения нужно контролировать рН. Это связано с тем, что в:
Кислой среде (при рН меньше 6,5), труднее зафиксировать К.Т.Т, потому что протекает реакция с индикатором CrO4. 2CrO4 2- + 2H+ = Cr2O7 2- + H2O
Щелочной среде происходит разрушение титранта AgNO3 Ag+ + OH- = AgOH,
2AgOH = Ag2O (осадок) + H2O.
В методе Мора всегда нужно к измеренному объему раствора соли галогена приливать раствор соли серебра из бюретки, так как только в этом случае получается резкое изменение окраски в конце титрования.
Метод Мора применим только для титрования в нейтральной или слабощелочной среде (рН 6,5 – 10), так как Ag2CrO4 растворим в кислотах и в их присутствии не выпадает.
Если анализируемый раствор имеет кислую реакцию, его нейтрализуют раствором тетрабората натрия Na2B4O7 * 10H2O или бикарбоната натрия NaHCO3. Другим условием применимости метода Мора является отсутствие в исследуемом растворе катионов, дающих с CrO4 2- осадки. Таковы, например, Ba2+, Pb2+, Bi3+.
Расчет массы хлорид – ионов проводится по формуле: m Cl = N (AgNO3) * Э Cl * V (AgNO3) / 1000, г.


52)ЙОДОМЕТРИЯ. Йодометрическое определение меди. В основе всех йодометрических определений лежит реакция I2 — + 2e ® 2I — . Стандартный окислительно-восстановительный потенциал которой Е 0 (I2/2I — )=0,54 В. Определение меди основано на взаимодействии ионов Cu 2+ c иодид-ионами, в результате чего образуется осадок CuI и выделяется I2, который титруют раствором тиосульфата натрия в присутствии крахмала в качестве индикатора.
2Cu 2+ + 4I — = 2CuI (осадок) + I2
Расчетная формула: mСu = N(Na2S2O3) * ЭCu * V(Na2S2O3) / 1000.
- Потенциал пары I2/2I — невелик, и поэтому многие йодометрические реакции обратимы и до конца не доходят; только при создании надлежащих условий они протекают практически до конца.
- Иод – вещество летучее, поэтому титрование ведут на холоду. Это необходимо также потому, что с повышением температуры понижается чувствительность крахмала как индикатора.
- Йодометрическое титрование нельзя проводить в щелочной среде, так как иод реагирует со щелочами: I2 + 2OH = IO — + I — + H2O.
- Растворимость йода в воде мала, поэтому при йодометрических определениях окислителей необходимо применять значительный избыток KI.
- Скорость реакции между определяемым окислителем и I — — ионами оказывается обычно недостаточной. Поэтому к титрованию выделившегося йода приступают лишь через некоторое время после прибавления окислителя.
- Реакционную смесь сохраняют в темноте, так как свет ускоряет в кислых растворах побочную реакцию окисления I — — ионов до I2 кислородом воздуха:
Линия окислителей – основной раствор KI, поэтому прямое титрование этим раствором не используется, чаще используется титрование по замещению.
Cr2O7 2- + 6I- изб +14H+ = 2Cr 3+ + 3I2 + 7H2O
Линия восстановителей – основной раствор молекулярного йода (I2). Растворами йода молекулярного можно определить As 3+ , Sb 3+ , Sn 2+ , H2S, SO3 2- .
53. Комплексонометрическое определение кальция и магния в растворе.
Мурексид в щелочной среде взаимодействует с кальцием с образованием ярко-розового комплексного соединения состава 1 : 1 Са 2+ + Н2Y 2- → СаY 2- + 2Н +
При комплексонометрическом титровании кальция ярко-розовая или красная окраска раствора переходит в фиолетовую.
Билет 54. Комплексонометрическое титрования
Титрантом является ЭДТУ или ее динатриевая соль ЭДТА, к-рая наз. комплексоном III или трилоном Б. Метод основан на ценном свойстве комплексонов, широко используемом в анализе, их способность давать внутрикомплексные соли с ионами щелочноземельных металлов: магнием, кальцием и барием.
Комплексы, образуемые комплексонами с большинством катионов металлов, весьма устойчивы, что вполне обеспечивает практически полное связывание определяемого металла в комплекс.
Общая жесткость воды обусловлена присутствующими в ней солями Ca и Mg. Метод основан на образовании при рН=10±0,2 прочного бесцветного комплексного соединения трилона Б с ионами кальция и магния. В эквивалентной точке титрования все ионы кальция и магния связываются в комплексное соединение трилоном Б, в результате чего происходит изменение окраски индикатора от красной до голубой.
Са 2+ + Н2Y 2- → СаY 2- + 2Н + Mg 2+ + Н2Y 2- → Mg Y 2- + 2Н +
Выполнение определения. Отбирают пипеткой 50 мл исслед. воды и переносим в коническую колбу для титрования, прибавляем 15 мл аммиач.буфера, перемешиваем и вносим на кончике ложечки индикатора ЭХЧ-Т. Р-р перемешиваем и титруем 0,05 Мэкв. р-ром ЭДТА до перехода красной окраски в синюю. Определяем средний V титранта после неск.повторов. жесткость воды рассчитываем по формуле: ОЖВ = Сн(Na2Н2Y)*V(Na2Н2Y)*1000/Vаликв.
55. 

Источник: megaobuchalka.ru
Как определить количество серебра в воде?
Для приготовления серебряной воды можно использовать не только ложку, но и любое другое столовое серебро. Чтобы посеребрить воду, нужно оставить ложку в воде на три дня — за меньший срок не получится достичь эффективной концентрации ионов.
Сколько держать серебряный ионизатор в воде?
Чтобы получить насыщенную ионами серебра воду, нужно постоянно держать ионизатор в сосуде с водой. Должно пройти не менее 36 часов, чтобы ионы серебра проникли в воду в достаточном количестве. На 1 литр воды достаточно одного стандартного ионизатора из серебра.
Можно ли кипятить воду с ионами серебра?
Чтобы воду, предназначенную для обогащения ионами серебра, избавить от хлора её нужно предварительно прокипятить или очистить с помощью кувшинного фильтра с угольным патроном.
Что происходит с серебром в воде?
«Действительно, ионы серебра обладают дезинфицирующими свойствами, убивают болезнетворные бактерии и грибки. Ионы серебра проникают в микробную клетку и разрушают ее. Таким образом, происходит обеззараживание воды или пищевого продукта.
Как очистить воду серебром в домашних условиях?
Положите на дно кувшина серебряную монетку или опустите ионизатор. Приготовление серебряной воды займет несколько суток. Затем просто подливайте в графин воду вместо использованной. Ваши серебряные изделия в воде лишь замедляет рост и развитие бактерий.
Что такое Серебряный ионизатор воды?
Ионизатор воды производится из серебра высшей пробы – 999,9 и 960. Он предельно прост в применении: достаточно поместить прибор в графин или бокал и закрепить цепочку зажимом. Уже через сутки вы получите воду – чистую, обеззараженную, без микробов и бактерий.
Как работает Серебряный ионизатор воды?
В ходе исследований серебряные ионизаторы признаны, как лечебные – профилактические устройства. Серебро обеззараживает воду примерно от 650 видов вредных микробов. Это происходит за счет насыщения жидкости полезными ионами серебра. Грибки и микробы проникают в здоровые клетки, уничтожая белки.
Как выбрать ионизатор воды?
Желательно выбирать ионизаторы с анодом, изготовленным из титана и покрытым диоксидом рутения. Электрод должен быть покрыт полностью! Если же это правило не будет соблюдено, при электролизе в воду станут попадать опасные примеси. Объем ионизированной воды на выходе.
Как сделать воду с ионами серебра?
Серебряную емкость с водой нужно поставить в прохладное, но темное место, куда не попадают прямые солнечные лучи. Пусть кувшин постоит там около суток. Этого времени будет достаточно, чтобы ионы серебра насытили воду.
Как определить наличие ионов серебра в воде?
Теоретически, в домашних условиях можно воспользоваться раствором обычной поваренной соли, если капнуть ее в воду, в которой есть серебро, должен выпадать осадок хлорида серебра в виде белесоватой взвеси.
Как правильно приготовить серебряную воду?
Нужно просто регулировать время его работы и объем воды. Выдержав прибор в трех литрах воды на протяжении 30 секунд – получиться слабо концентрированная серебряная вода, а если на протяжении трех минут – то средне концентрированная.
Что делает серебро в воде?
Используют серебро и для очистки воды бассейнов. Это дороже хлорных препаратов, но безопасно для аллергиков. Специалист по системам водоподготовки Сергей Мысков подтверждает: «Ионы серебра уничтожают все известные бактерии, микроорганизмы, не нанося при этом никакого ущерба организму человека».
Как серебро обеззараживает воду?
Бактерицидные свойства серебра основаны на том, что его ионы нарушают работу ферментов, которые регулируют жизнедеятельность бактерий. . Однако ионы серебра уничтожают не все виды бактерий. Не до конца изучены бактерицидные свойства серебра по отношению к некоторым простейшим и вирусам.
Источник: aura-nn.ru
Определение хлоридов и сульфатов
Концентрация хлоридов в водоемах – источниках водоснабжения допускается до 350 мг/л.
В водах рек северной части России хлоридов содержится обычно немного, не более 10 мг/л, в южных районах – до десятков и сотен мг/л. Много хлоридов попадает в водоемы со сбросами хозяйственно-бытовых и промышленных сточных вод. Это показатель весьма важен при оценке санитарного состояния водоема.
Качественное определение хлоридов проводят титрованием пробы анализируемой воды нитратом серебра в присутствии хромата калия как индикатора. Нитрат серебра дает с хлорид-ионами белый осадок, а с хроматом калия – кирпично-красный осадок хромата серебра. Из образовавшегося осадков меньшей растворимостью обладает хлорид серебра.
Поэтому лишь после того, как хлорид-ионы будут связаны, начинается образование хромата серебра. Появление слабо оранжевой окраски свидетельствует о конце реакции. Титрование можно проводить в нейтральной или слабо щелочной среде. Кислую анализируемую воду нейтрализуют гидрокарбонатом натрия.
Определение содержания хлоридов
| Осадок или помутнение | Концентрация хлоридов, мг/л |
| Опалесценция или слабая муть Сильная муть Образуются хлопья, но осаждаются не сразу Белый объемистый осадок | 1-10 10-50 50-100 более100 |
В коническую колбу помещают 100 мл воды, прибавляют 1 мл 5% -ного раствора хромата калия и титруют 0,05 н.раствором нитрата серебра при постоянном взбалтывании до появления слабо-красного окрашивания.
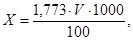
где 1,773 – масса хлорид-ионов (мг), эквивалентная 1 мл точно 0,05 н.раствора нитрата серебра, затраченного на титрование, мл.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru