В Москве с грузового поезда во время движения съехали рельсы и повредили станцию Матвеевская, сообщила Московская железная дорога (МЖД). Станция находилась на реконструкции до 2021 года.
Инцидент произошел сегодня, 18 июля, в 5:09 на перегоне Москва сортировочная-Киевская—Солнечная Киевского направления. «Во время перевозки рельсов произошло нарушение габарита груза, вследствие чего была повреждена пассажирская инфраструктура на платформе №1 станции Матвеевская»,— говорится в пресс-релизе.
Движение на Киевском направлении осуществляется в штатном режиме. Железнодорожники уже убрали поврежденные конструкции на платформе и открыли ее для пассажиров. МЖД создала штаб для выяснения причин произошедшего.
Telegram-канал Baza опубликовал видео инцидента. На нем видно, что рельсы снесли обшивку и стекла на платформе.
- Лаура Кеффер подписаться отписаться
Источник: www.kommersant.ru
Физика 9 класс. Состав атомного ядра. Ядерные силы
Как определить состав ядра серебра
В качестве примеси серебро присутствует почти во всех медных и особенно свинцовых рудах. Из этих руд получают около 80% всего добываемого серебра.
Чистое серебро – очень мягкий, тягучий металл (рис. 1), оно лучше всех металлов проводит теплоту и электрический ток.
Серебро – малоактивный металл. В атмосфере воздуха оно не окисляется ни при комнатных температурах, ни при нагревании. Часто наблюдаемое почернение серебряных предметов – результат образования на поверхности черного сульфида серебра Ag2S.

Рис. 1. Серебро. Внешний вид.
Атомная и молекулярная масса серебра
Поскольку в свободном состоянии серебро существует в виде одноатомных молекул Ag, значения его атомной и молекулярной масс совпадают. Они равны 107,8682.
Изотопы серебра
Известно, что в природе серебро может находиться в виде двух стабильных изотопов 107 Ag и 109 Ag. Их массовые числа равны 107 и 109 соответственно. Ядро атома изотопа серебра 107 Ag содержит сорок семь протонов и шестьдесят нейтронов, а изотопа 109 Ag – такое число протонов и шестьдесят два нейтрона.
Существуют искусственные нестабильные изотопы серебра с массовыми числами от 93-х до 130-ти, а также тридцать шесть изомерных состояния ядер, среди которых наиболее долгоживущим является изотоп 104 Ag с периодом полураспада равным 69,2 минуты.
Ионы серебра
На внешнем энергетическом уровне атома серебра имеется один электрон, который является валентным:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 9 5s 2 .
В результате химического взаимодействия серебро отдает свой валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион:
Молекула и атом серебра
В свободном состоянии серебро существует в виде одноатомных молекул Ag. Приведем некоторые свойства, характеризующие атом и молекулу серебра:
Энергия ионизации атома, кДж/моль
Сплавы серебра
На практике чистое серебро вследствие мягкости почти не применяется: обычно его сплавляют с большим или меньшим количеством меди. Сплавы серебра служат для изготовления ювелирных и бытовых изделий, монет, лабораторной посуды.
Примеры решения задач
| Задание | Вычислите массовую долю нитрата серебра в растворе, полученном при растворении соли массой 40 г в воде количеством 20 моль. |
| Решение | Найдем массу воды (молярная масса 18 г/моль): |
Рассчитаем массу раствора нитрата серебра:
msolution(AgNO3) = 40 + 360 = 400 г.
Вычислим массовую долю нитрата серебра в растворе:
| Задание | При растворении 3 г сплава меди и серебра в концентрированной азотной кислоте получили 7,34 г смеси нитратов. Определите массовые доли металлов в сплаве. |
| Решение | Запишем уравнения реакций взаимодействия металлов, представляющих собой сплав (медь и серебро), в концентрированной азотной кислоте: |
В результате реакции образуется смесь, состоящая из нитрата серебра и нитрата меди (II). Пусть количество вещества меди в сплаве составляет х моль, а количество вещества серебра – у моль. Тогда массы этих металлов будут равны (молярная масса меди 64 г/моль, серебра – 108 г/моль):
Согласно условию задачи, масса сплава равна 3 г, т.е.:
По уравнению (1) n(Cu) : n(Cu(NO3)2) = 1:1, значит n(Cu(NO3)2) = n(Cu) =х. Тогда масса нитрата меди (II) составляет (молярная масса равна 188 г/моль) 188х.
Согласно уравнению (2), n(Ag) : n(AgNO3) = 1:1, значит n(AgNO3) = n(Ag) =y. Тогда масса нитрата серебра составляет (молярная масса равна 170 г/моль) 170y.
По условию задачи масса смеси нитратов равна 7,34 г:
Получили систему уравнений с двумя неизвестными:
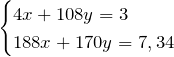
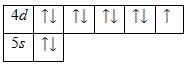
Выразим из первого уравнения х и подставим это значение во второе уравнение, т.е. решим систему методом подстановки.
Значит количество вещества серебра равно 0,01 моль. Тогда, масса серебра в сплаве равна:
m (Ag) = n (Ag) × M (Ag) = 0,01 × 108 = 1,08г.
Не вычисляя x можно найти массу меди в сплаве:
m (Cu) = malloy– m (Ag) = 3 – 1,08 = 1,92 г.
Строение атома серебра
Общие сведения о строении атома серебра
Относится к элементам d-семейства. Металл. Обозначение – Ag. Порядковый номер – 47. Относительная атомная масса – 107,868 а.е.м.
Электронное строение атома серебра
Атом серебра состоит из положительно заряженного ядра (+47), внутри которого есть 47 протонов и 61 нейтрон, а вокруг, по пяти орбитам движутся 427 электронов.
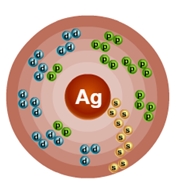
Рис.1. Схематическое строение атома серебра.
Распределение электронов по орбиталям выглядит следующим образом:
Валентными электронами атома серебра считаются электроны, расположенные на 4d— и 5s-орбиталях. Энергетическая диаграмма основного состояния принимает следующий вид:
Валентные электроны атома серебра можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Примеры решения задач
| Задание | Сколько атомных орбиталей d-подуровня заполнено у элемента с порядковым номером 23? Запишите его электронную формулу. |
| Решение | На d-подуровне имеется пять орбиталей, на каждой из которых может одновременно находиться 2 электрона (в сумме 10). Элемент с порядковым номером 23 — это ванадий (V). Запишем электронную конфигурацию его атома в основном состоянии: |
1s 2 2s 2 2p 6 3s 2 3p 6 3 d 3 4 s 2 .
В атоме ванадия заполнены 3 орбитали 3d-подуровня.
| Задание | Почему марганец проявляет металлические свойства, а хлор – неметаллические? Ответ мотивируйте строением атомов этих элементов. Запишите их электронные формулы. |
| Ответ | Запишем электронные конфигурации атомов хлора и марганца в основном состоянии: |
Атому хлора до завершения внешнего энергетического уровня не хватает всего 1-го электрона, поэтому он обладает сильно выраженными неметаллическими свойствами. Марганцу для этих же целей потребуется гораздо больше электронов, поэтому, ему проще отдать свои валентные электроны при химическом взаимодействии, чем принять их – явный признак металлических свойств.
Серебро, свойства атома, химические и физические свойства
Серебро, свойства атома, химические и физические свойства.










107,8682(2) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1
Серебро — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 47. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), пятом периоде периодической системы.
Физические свойства серебра
Атом и молекула серебра. Формула серебра. Строение атома серебра:
Серебро (лат. Argentum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ag и атомным номером 47. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), пятом периоде периодической системы.
Серебро – металл. Относится к группе переходных металлов, а также к драгоценным металлам и металлам платиновой группы.
Как простое вещество серебро при нормальных условиях представляет собой ковкий, пластичный металл серебристо-белого цвета.
Молекула серебра одноатомна.
Химическая формула серебра Ag.
Электронная конфигурация атома серебра 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1 . Потенциал ионизации (первый электрон) атома серебра равен 731 кДж/моль (7,576234(25) эВ).
Строение атома серебра. Атом серебра состоит из положительно заряженного ядра (+47), вокруг которого по пяти оболочкам движутся 47 электронов. При этом 46 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку серебро расположен в пятом периоде, оболочек всего пять. Первая – внутренняя оболочка представлена s-орбиталью.
Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и четвертая – внутренние оболочки представлены s-, р- и d-орбиталями. Пятая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома серебра на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома серебра состоит из 47 протонов и 61 нейтрона.
Серебро относится к элементам d-семейства.
Радиус атома серебра (вычисленный) составляет 165 пм.
Атомная масса атома серебра составляет 107,8682(2) а. е. м.
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью.
Изотопы и модификации серебра:
Свойства серебра (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Серебро |
| 102 | Прежнее название | |
| 103 | Латинское название | Argentum |
| 104 | Английское название | Silver |
| 105 | Символ | Ag |
| 106 | Атомный номер (номер в таблице) | 47 |
| 107 | Тип | Металл |
| 108 | Группа | Драгоценный, переходный металл, металл платиновой группы |
| 109 | Открыт | Известно с древних времен |
| 110 | Год открытия | до 5000 года до н. э. |
| 111 | Внешний вид и пр. | Ковкий, пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 7,9·10 -6 % |
| 120 | Содержание в морях и океанах (по массе) | 1,0·10 -8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10 -8 % |
| 122 | Содержание в Солнце (по массе) | 1,0·10 -7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000014 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 107,8682(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 1 |
| 203 | Электронная оболочка | K2 L8 M18 N18 O1 P0 Q0 R0 |
205* Эмпирический радиус атома серебра согласно [1] и [3] составляет 144 пм.
206* Ковалентный радиус серебра согласно [1] и [3] составляет 145±5 пм и 134 пм соответственно.
401* Плотность серебра согласно [3] и [4] составляет 10,5 г/см 3 (при 0 °C/20 °C и иных стандартных условиях , состояние вещества – твердое тело).
402* Температура плавления серебра согласно [3] и [4] составляет 961,95 °С (1235,1 K, 1763,51 °F) и 960,5 °С (1233,65 K, 1760,9 °F) соответственно.
403* Температура кипения серебра согласно [3] и [4] составляет 2211,85 °C (2485 K, 4013,33 °F) и 2167 °С (2440,15 K, 3932,6 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) серебра согласно [3] и [4] составляет 11,95 кДж/моль и 11,3 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) серебра согласно [3] и [4] составляет 254,1 кДж/моль и 251,5 кДж/моль соответственно.
410* Молярная теплоёмкость серебра согласно [3] составляет 25,36 Дж/(K·моль).
Источник: ollimpia.ru
Остались вопросы?
Помогите решить задачи.1)Автобус,двигаясь со скоростью 72км/ч,начинает тормозить с ускорением 3м/с2 и останавливается. Чему равно время торможе .
ДАЮ 60 БАЛЛОВШкольник решил испытать кастрюлю на плавучесть. Он поместил цилиндрическую кастрюлю массой 2.4 кг, высотой 30 см и площадью дна 8 .
Прямолинейное движение двух тел задано уравнениями x1(t) = k1t + b1 и x2(t) = k2t+ b2, где x1(t) и x2(t) – координаты в момент времени t первог .
СРОЧНО!! ДАЮ 30 БАЛЛОВЭкспериментатор Глюк добыл немного неизвестного науке вещества в твёрдомсостоянии, поместил его в калориметр и радостно н .
Движение точки на ободе колеса радиусом R, катящегося с угловой скоростью ω без скольжения по горизонтальной поверхности описывается уравнениям .
Источник: znanija.pro