«РД 52.24.407-2017. Руководящий документ. Массовая концентрация хлоридов в водах. Методика измерений аргентометрическим методом» (введен в действие Приказом Росгидромета от 11.12.2017 N 647)
9.3 Установление точной молярной концентрации растворов нитрата серебра
9.3.1 Для установления точной молярной концентрации раствора нитрата серебра, 0,05 моль/дм 3 , в коническую колбу вместимостью 250 см 3 с помощью пипетки с одной отметкой помещают 25,0 см 3 аттестованного раствора хлоридов с молярной концентрацией 0,01410 моль/дм 3 , добавляют мерным цилиндром 75 см 3 дистиллированной воды и градуированной пипеткой 1 см 3 раствора хромата калия.
Раствор в колбе перемешивают и титруют раствором нитрата серебра с молярной концентрацией 0,05 моль/дм 3 до появления красновато-оранжевого осадка.
Титрование повторяют и, при отсутствии расхождения в объемах раствора нитрата серебра более 0,05 см 3 , за результат принимают среднее арифметическое значение. В противном случае повторяют титрование до получения результатов, отличающихся не более, чем на 0,05 см 3 . Одновременно выполняют холостой опыт, используя для титрования 100 см 3 дистиллированной воды, отобранной мерным цилиндром.
Условный Титр раствора или Титр по определяемому веществу. Часть 2.
Если для установления точной молярной концентрации раствора нитрата серебра используют аттестованный раствор хлоридов с молярной концентрацией 0,05000 моль/дм 3 (см. приложение А), в колбу помещают с помощью пипетки с одной отметкой 10,0 см 3 аттестованного раствора хлоридов, добавляют мерным цилиндром 90 см 3 дистиллированной воды и градуированной пипеткой 1 см 3 раствора хромата калия.
9.3.2 Для установления точной молярной концентрации раствора нитрата серебра, 0,02 моль/дм 3 , в коническую колбу вместимостью 250 см 3 с помощью пипетки с одной отметкой помещают 10,0 см 3 аттестованного раствора хлоридов с молярной концентрацией 0,01410 моль/дм 3 , добавляют мерным цилиндром 90 см 3 дистиллированной воды и градуированной пипеткой 1 см 3 раствора хромата калия.
Раствор в колбе перемешивают и титруют раствором нитрата серебра с молярной концентрацией 0,02 моль/дм 3 до появления красновато-оранжевого осадка. Титрование повторяют и, при отсутствии расхождения в объемах раствора нитрата серебра более 0,05 см 3 , за результат принимают среднее арифметическое значение. В противном случае повторяют титрование до получения результатов, отличающихся не более, чем на 0,05 см 3 . Одновременно выполняют холостой опыт, используя для титрования 100 см 3 дистиллированной воды, отобранной мерным цилиндром.
Если для установления точной молярной концентрации раствора нитрата серебра используют аттестованный раствор хлоридов с молярной концентрацией 0,05000 моль/дм 3 (см. приложение А), в колбу помещают с помощью пипетки с одной отметкой 5,0 см 3 аттестованного раствора хлоридов, добавляют мерным цилиндром 95 см 3 дистиллированной воды и градуированной пипеткой 1 см 3 раствора хромата калия.
9.3.3 Молярную концентрацию раствора нитрата серебра M2, моль/дм 3 , рассчитывают по формуле
Титр раствора (Т). Решение задач. Часть 1.
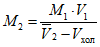
, (1)
где M1 — молярная концентрация аттестованного раствора хлоридов, моль/дм 3 ;
V1 — объем аттестованного раствора хлоридов, см 3 ;
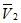
— среднее арифметическое значение объема раствора нитрата серебра, израсходованного на титрование аттестованного раствора хлоридов, см 3 ;
Vхол — объем раствора нитрата серебра, израсходованный на титрование холостой пробы, см 3 .
Рассчитанное значение молярной концентрации раствора нитрата серебра округляют и записывают таким образом, чтобы оно содержало четыре значащие цифры.
Источник: e-ecolog.ru
Аргентометрическое титрование
Готовят стандартный раствор хлорида натрия и приблизительно 0,02н раствор нитрата серебра, стандартизируют второй раствор по первому.
Опыт 1. Приготовление стандартного раствора хлорида натрия.
Стандартный раствор хлорида натрия (или калия) приготавливают из химически чистой соли. Поскольку – эквивалентная масса хлорида натрия равна его молярной массе; для приготовления 0,25л 0,02н раствора требуется
58,45 ∙0,02 ∙ 0,25 = 0,029г
Навеску около 0,12г хлорида натрия, взятую на аналитических весах, переносят в мерную колбу емкостью 100мл растворяет, доводят объем раствора водой до метки, перемеривают: вычисляют титр и нормальность стандартного раствора хлорида натрия.
Если навеска хлорида натрия оказалась, например равна 0,1226г,
, а нормальность стандартного раствора
Опыт 2. Приготовление приблизительно 0,02н раствора нитрата серебра.
При аргентометрическом титрования эквивалентная масса нитрата серебра равна его молярной массе, поэтому 0,2л 0,02н раствора должны содержать 169,9 ∙ 0,02∙0,2 = 0,6796г.
На технохимических весах отвешивают приблизительно 0,34 -0,35г нитрата серебра, переносят в мерную колбу на 100мл, растворяют, доводят объем раствора водой до метки. Хранят раствор в колбе, обернутой черной бумагой, или в склянке из темного стекла (на свету нитрат серебра разлагается).
Опыт 3. Стандартизация раствора нитрата серебра по хлориду натрия.
Вымытую водой бюретку промывают раствором нитрата серебра, подготавливают к титрованию.
Пипетку ополаскивают раствором хлорида натрия, переносят 10мл его в коническую колбу, приливают 2 капли насыщенного раствора хромата калия, осторожно, по каплям, титруют раствором нитрата серебра при перемешивании; чисто желтая окраска смеси должна перейти в красноватую от одной избыточной капли нитрата серебра.
Берут среднее из сходящихся отсчетов титрования и вычисляют нормальность стандартизированного раствора нитрата серебра.
Если на титрование 10 мл 0,02097н раствора хлорида натрия пошло в среднем 10,26 мл раствора нитрата серебра, то
В приведенном примере это означает, что 1мл стандартизированного раствора нитрата серебра соответствует 0,0007244 г оттитрованного хлора.
Опыт 4. Определение содержания хлора в растворе (или образце) по Мору.
Содержание хлорид — ионов определяют в минеральных удобрениях и других химикалиях.
Пробирку с образцом анализируемого вещества взвешивают на аналитических весах, переносят содержимое ее в мерную колбу на 100мл, снова взвешивают, и по разности находят величину навески.
Если навеска составила, например, 0,1302г, а на титрование 10мл анализируемого раствора пошло в среднем 4,74мл стандартизированного раствора нитрата серебра, то достаточно умножить эту величину на титр раствора нитрата серебра, по хлору, чтобы найти массу хлора в 10мл: 4,74∙0,0007244= 0,003434 г, а здесь анализируемый раствор содержит хлора в десять раз больше: 0,003434∙10 = 0,03434 г.
0,1302 г составляет 100%
Титр раствора нитрата серебра по хлору используют при серийных определениях хлорид — ионов в образцах.
Источник: studopedia.info
лаба 6. Standartizatsia_rastvora_nitrata_serebra_po_metodu_Moru
Работа 5. Стандартизация раствора нитрата серебра по методу Мору.
В основе метода Мора лежат следующие реакции:
Посуда и реактивы: химический штатив; бюретка вместительностью 25 мл; конические колбы для титрования (3 шт.); пипетка Мора вместительностью 10 мл; химические стаканы вместительностью 100 мл (2 шт.).
Хлорид натрия, NaCl, 0,0500 М.
Индикатор: хромат калия, K2CrO4, насыщенный раствор.
Нитрат серебра, AgNO3,0,0500 M стандартный раствор.
Объем раствора, NaCl, мл
Объем AgNO3, пошедший на титрование, мл
Концентрация раствора AgNO3, моль/л
Источник: studfile.net