Разбавленная серная кислота и сульфаты осаждают Pb 2+ в виде белого кристаллического осадка:
Осадок PbSO4 растворим при нагревании в щелочах:
и в концентрированном растворе ацетата аммония:
Разбавленная азотная кислота повышает частично растворимость PbSO4 за счёт связывания SO4 2- в HSO4 — .
Выполнение реакции. К 5–6 каплям раствора Pb 2+ добавить 8–10 капель раствора H2SO4. Исследовать действие на осадок сульфата свинца NaOH, CH3COONH4, нагревания.
Характерные реакции катионов РТУТИ
1. Реакция с раствором аммиака.
Это наиболее характерная реакция, позволяющая открыть Hg2 2+ в присутствии Pb 2+ и Ag + . Описание дано в общих реакциях.
Характерные реакции катионов СЕРЕБРА
1. Для отделения катионов серебра от катионов свинца и ртути пользуются характерными свойствами хлорида серебра растворяться в избытке раствора аммиака с образованием комплексного иона [Ag(NH3)2] + :
2. Восстановление катионов серебра до металлического.
Как получить много свинца из аккумулятора. Гальванический способ.
Катионы серебра восстанавливаются в щелочной среде ионами Mn 2+ до свободного серебра:
Реакцию можно провести капельным методом.
Выполнение реакции. Приготовить в пробирке несколько капель аммиаката серебра. На полоску фильтровальной бумаги нанести последовательно каплю раствора нитрата марганца и каплю приготовленного [Ag(NH3)2] + .
Ход анализа смеси катионов II группы
При систематическом ходе анализа разделение катионов II группы основано на различной растворимости в воде хлоридов катионов II группы при нагревании (отделение Pb 2+ ) и различном отношении AgCl и Hg2Cl2 к действию раствора NH3 (открытие Hg2 2+ и отделение Ag + ).
Выполнение реакций.
1. Рассмотреть выданную аналитическую задачу, измерить рН раствора, сделать вывод.
2. Осадить катионы II группы в виде хлоридов, действуя на часть исследуемого раствора 1,5-кратным избытком раствора соляной кислоты. Рассмотреть образовавшийся осадок, указать его возможный состав, промыть на фильтре холодной водой.
3. Перевести хлорид свинца в раствор, промывая осадок на фильтре кипящей водой. К горячему фильтрату прилить несколько капель уксусной кислоты и раствор иодида калия. Охладить. Сделать вывод о присутствии катионов свинца.
4. Полностью отделить PbCl2, промывая осадок горячей водой до отрицательной реакции раствора с KI.
5. Обработать осадок на фильтре раствором NH3. Сделать вывод о наличии Hg2Cl2. Хлорид серебра при этом переходит в фильтрат в виде [Ag(NH3)2] + . Разрушить аммиакат серебра в фильтрате и открыть Ag + в виде AgI или AgCl.
6. Описать решение экспериментальной задачи с уравнениями протекающих реакций разделения и обнаружения. Сделать вывод о катионном составе.
III ГРУППА КАТИОНОВ
К III аналитической группе относятся катионы щелочно-земельных металлов: Ba 2+ , Sr 2+ , Ca 2+ . Групповой реагент – раствор серной кислоты, осаждающий сульфаты, растворимость которых уменьшается с увеличением атомной массы элементов.
СВИНЦОВЫЙ СУРИК. КАК СДЕЛАТЬ ОКСИД СВИНЦА В ДОМАШНИХ УСЛОВИЯХ
Фосфаты, оксалаты, силикаты, хроматы, карбонаты катионов Ba 2+ , Sr 2+ , Ca 2+ также малорастворимы.
Хлориды, нитраты, ацетаты хорошо растворимы в воде.
Общие реакции катионов Ba 2+ , Sr 2+ , Ca 2+
1. Реакция с серной кислотой.
Серная кислота и растворимые в воде сульфаты образуют с ионами Ba 2+ , Sr 2+ , Ca 2+ белые кристаллические осадки по уравнению:
Все осадки не растворимы в кислотах и щелочах, но имеют различную растворимость в воде:
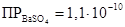 ,
, 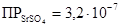 ,
, 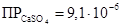 .
.
Наименее растворим BaSO4, CaSO4 – значительно растворяется в воде. Поэтому осадок ВаSO4 определяется моментально даже из разбавленных растворов, SrSO4 – через некоторое время, СаSO4 – только из достаточно концентрированных растворов. Следует отметить, что растворимость CaSO4 понижается при добавлении спирта или ацетона. В отличие от ВаSO4 и SrSO4 растворимость сульфата кальция в значительной степени повышается в присутствии сульфата аммония за счёт образования нестойкой соли:
Для перевода МеSO4 в раствор их превращают в МеСО3, которые легко растворяются в кислоте:
Практически это превращение осуществляется путём многократной обработки осадка сульфатов насыщенным раствором Na2CO3 при нагревании (мокрый способ) или сплавлением его в тигле с 5–6-кратным избытком смеси Na2CO3 и К2CO3 (сухой способ).
Выполнение реакции. К растворам солей Ba 2+ , Sr 2+ , Ca 2+ добавить 1,5-кратный избыток раствора Н2SO4. Выпадают белые кристаллические осадки. Обратить внимание и отметить скорость образования и количество осадка. Если осадок CaSO4 не выпадает, потереть палочкой о стенки пробирки. Отобрать раствор над осадком CaSO4 в другую пробирку, добавить спирт или ацетон.
Что происходит? Почему?
2. Реакция с гипсовой водой.
Гипсовая вода, то есть водный насыщенный раствор гипса CaSO4·2Н2О образует с ионами Ba 2+ и Sr 2+ белые кристаллические осадки. Ион бария образует осадок сразу, осаждение SrSO4 происходит не полностью, очень медленно, нагревание раствора ускоряет образование осадка. Это объясняется различной растворимостью сульфатов – в насыщенном растворе CaSO4 равновесная концентрация SO4 2- равна 3·10 -3 М. Это количество вполне достаточно для осаждения ВаSO4, например, из 1·10 -3 М раствора соли, для SrSO4 при этой же концентрации Sr 2+
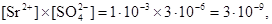

что меньше и недостаточно для полного осаждения катионов стронция.
Выполнение реакции. К нескольким каплям раствора солей Ba 2+ , Sr 2+ и Ca 2+ в пробирках добавить насыщенный раствор гипсовой воды. Описать в тетради наблюдаемые явления. Пробирку с SrSO4 нагреть 2–3 мин. На водяной бане.
Что происходит?
3. Реакция с бихроматом и хроматом калия.
K2CrO4 и K2Cr2O7 образуют с катионами Ba 2+ и Sr 2+ жёлтые кристаллические осадки хроматов состава MeCrO4:
 ,
, 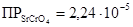 ,
, 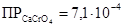
Катионы кальция осаждаются только из концентрированных растворов, вследствие высокой растворимости СаCrO4. При рН < 7 катионы стронция и кальция не осаждаются.
Образование хроматов при действии К2Cr2O7 объясняется, во-первых, присутствием в растворе К2Cr2O7 ионов CrO4 2- согласно равновесию:
Во-вторых, меньшей растворимостью МеCrO4 по сравнению с МеCr2O7.
Полное осаждение Ва 2+ происходит при рН ~5, поэтому в реакционную смесь добавляют избыток СН3СООNa, создавая ацетатную буферную смесь:
Этим пользуются для отделения Ba 2+ от Sr 2+ и Ca 2+ , не дающих осадков в данных условиях.
Выполнение реакции. К растворам Ba 2+ , Sr 2+ и Ca 2+ добавить избыток К2CrO4. Отметить наблюдаемые явления. Проверить действие HCl и CH3COOH. Провести аналогичный опыт с К2Cr2O7.
Сопоставить результаты.
4. Окрашивание пламени.
Летучие соли бария окрашивают пламя горелки в желтовато-зелёный цвет, стронция – в карминно-красный, кальция – в кирпично-красный цвет.
Выполнение реакции. В 3 фарфоровые лодочки налить по 1 мл спирта, аккуратно поджечь и внести шпательками сухие соли (хлориды, нитраты) Ba 2+ , Sr 2+ , Ca 2+ , наблюдать за окраской пламени.
Источник: cyberpedia.su
СХЕМА АНАЛИЗА СМЕСИ КАТИОНОВ ПЕРВОЙ,

ПРОДОЛЖИТЕЛЬНОСТЬ ЗАНЯТИЯ: 180 минут.
МЕСТО ПРОВЕДЕНИЯ: лаборатория химии.
ОСНАЩЕННОСТЬ ЗАНЯТИЯ:
растворы солей: BaCl2, CaCl2, ZnSO4, Al2(SO)4)3, NaCl, КС1, NH4CI, AgNO3, Pb(CH3СОО)2, контрольные задачи на смесь катионов I-II группы,
ОБОРУДОВАНИЕ: спиртовки, спички, держатели, пробирки, микроскоп,
стеклянные палочки, центрифуга, электрическая плитка,
тигли, тигельные щипцы.
3 Стандарт 2009 года -2-
К занятию студенты должны ЗНАТЬ:
1. Свойства катионов бария, кальция. Общая характеристика.
2. Групповой реактив. Его действие.
3. Реактивы на катионы бария, кальция.
4. Значение соединений катионов III группы в медицине.
5. Понятие о произведении растворимости (ПР)
(см.практическое занятие №1) .
6. Условия осаждения и растворения малорастворимых соединений в соответствие с величинами ПР (см.практическое занятие №1) .
7. Свойства катионов алюминия, цинка. Общая характеристика.
8. Значение и применение гидролиза и амфотерности в открытии и
отделении катионов IV группы.
9. Групповой реактив. Реактивы на катионы алюминия, цинка.
10. Применение соединений алюминия, цинка в медицине.
11. Свойства катионов натрия, калия, аммония. Реактивы.
12. Условия осаждения ионов калия и натрия в зависимости от концентрации, реакции среды и температуры.
13. Свойства катионов серебра, свинца (II). Групповой реактив. Его действие.
14. Реактивы на катионы серебра, свинца (II).
3 Стандарт 2009 года -3-
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
- Какие катионы относят к первой аналитической группе?
- Какие реакции используются для открытия ионов аммония?
- Какая из них является специфической?
- Как открыть катион аммония при помощи гидроксида натрия?
- Какие реакции используют для открытия катиона калия?
- Как называется осадок, полученный от действия на соль калия гексанитрокобальтата (III) натрия?
- Почему ион аммония мешает открытию катиона калия?
- Как удалить аммонийные соли из раствора?
- Как убедиться, что катион аммония удален?
- Какие катионы относятся ко второй аналитической группе?
- Какой реактив является групповым на вторую аналитическую группу?
- Какая реакция используется для обнаружения катиона серебра?
- В чем растворяется осадок хлорида серебра? Назовите продукт этой реакции?
- В чем растворяется осадок хлорида свинца?
- Какая реакция используется для обнаружения катиона свинца?
- Как отделить ионы свинца II от ионов серебра?
- Какие катионы входят в состав III аналитической группы?
- Какова сравнительная растворимость сульфатов катионов III группы?
- Какая реакция наиболее характерна для катионов бария?
- Какими свойствами обладает осадок хромата бария?
- Какая реакция наиболее характерна для катиона кальция?
- Какими свойствами обладает осадок оксалата кальция?
3 Стандарт 2009 года -4-
- В какой цвет окрашивается бесцветное пламя летучими солями бария? кальция?
- Как выполняется микрокристаллоскопическая реакция на ион кальция?
- Какие катионы входят в состав IV аналитической группы?
- Почему IV аналитическая группа называется группой амфотерных гидроксидов?
- Какие соединения образуют катионы IV аналитической группы от действия избытка щелочи?
- Как обнаружить присутствие катионов цинка в растворе?
Какими свойствами обладает осадок гексоцианоферрата (II) цинка-калия?
29. Что называют зеленью Ринмана?
30. Какие реакции используют для обнаружения катиона алюминия?
31. Как проводят реакцию получения «Тенаровой сини»?
- Как выполняют реакцию открытия катиона алюминия с ализарином?
3 Стандарт 2009 года -5-
ЗАДАНИЯ ДЛЯ ВНЕАУДИТОРНОЙ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ:
1. Подготовить сообщения:
а) биологическая роль кальция и бария;
б) биологическая роль алюминия и цинка;
в) применение соединений кальция и бария в медицине;
г) применение соединений алюминия и цинка в медицине;
2. В тетрадях для самоподготовки написать в молекулярном и ионном виде:
а) фармакопейные реакции на катионы кальция и цинка;
б) реакцию взаимодействия хлорида бария с серной кислотой;
в) реакцию взаимодействия сульфата алюминия с нитратом кобальта.
Назвать основные продукты реакций, их свойства. Указать внешний эффект, условия выполнения реакций.
3.Написать уравнения реакций, лежащих в основе систематического хода анализа смеси катионов I-III аналитических групп.
3 Стандарт 2009 года -6-
СХЕМА АНАЛИЗА СМЕСИ КАТИОНОВ ПЕРВОЙ,
Источник: megaobuchalka.ru
Вопросы для повторения. Анализ смеси катионов I аналитической группы
Если ион свинца находится в анионе комплексного соединения Na2[Pb(OH)4], то обнаружение иона свинца проводится следующим образом: к щелочному раствору соли свинца прилить K2CrO4 и затем прибавлять по каплям азотную кислоту. Когда рН станет меньше 7, выпадет желтый осадок по реакции
При нагревании осадки PbCl2, PbI2 растворяются, а при охлаждении растворов снова выпадают.
Ион ртути обнаруживается путём прибавления раствора аммиака к солям ртути или к осадку Hg2Cl2 до рН >7. Выпадает чёрный осадок мелкодисперсной (металлической) ртути:
3.1. К смеси катионов первой группы прилить по каплям соляную кислоту до полного осаждения AgCl, PbCl2, Hg2Cl2. Осадок отделить от раствора центрифугированием.
3.2. Отделение AgCl и открытие Hg2 2+
К осадку хлоридов (1) прилить 8-10 капель раствора аммиака, перемешать, центрифугировать. Если осадок потемнел, то значит, присутствует ион ртути (I) (осадок сохранить). Слить раствор (2) (центрифугат) в чистую пробирку.
3.3. Обнаружение Ag +
К полученному раствору (2) прибавить по каплям HNO3 до рН≤5. В присутствии ионов серебра выпадает белая муть или осадок AgCl.
3.4. Обнаружение Pb 2+
а) Если ион ртути обнаружен, то к осадку (2) прилить концентрированной щелочи до рН≥10, перемешать палочкой, центрифугировать. Слить раствор (3) в чистую пробирку, прибавить к нему одну каплю K2CrO4 и азотную кислоту до рН < 7. Выпадение желтого осадка PbCrO4 указывает на наличие иона свинца.
б) Если ион ртути не обнаружен, то к осадку (2) прибавить раствор K2CrO4 и азотной кислоты до рН< 7. Выпадение желтого осадка PbCrO4 указывает на наличие иона свинца.
По выполненной работе составить подробный отчет, сделать вывод о составе полученной смеси ионов.
1. Что является групповым реагентом на катионы первой группы и как он действует на эти ионы? Написать уравнения реакций.
2. Написать реакции действия избытка щёлочи на катионы первой группы.
3. Написать реакции действия избытка аммиака на катионы первой группы.
4. При добавлении к осадку хлоридов первой группы раствора аммиака весь осадок растворился. Какой ион был в осадке? Написать уравнение реакции.
5. При добавлении избытка аммиака к раствору ионов первой группы выпал белый осадок. Какой ион присутствует в растворе?
6. Почему при добавлении раствора иодида калия к аммиакату серебра выпадает осадок иодида серебра? Написать уравнения этих реакций.
7. Какими реакциями можно отделить ион серебра от иона свинца? Написать уравнения этих реакций.
8. Какой реакцией можно отделить ион свинца от иона ртути? Написать уравнение реакции.
9. Какой ион первой группы может вступать в реакцию диспропорционирования? Написать примеры таких реакций.
10. Почему при добавлении раствора SnCl2 к раствору Hg2(NO3)2 выпадает сначала белый осадок, а затем чернеет? Написать уравнения происходящих реакций. Какие свойства в данном случае проявляет ион ртути (I)?
11. В результате чего раствор смеси солей катионов первой группы имеет кислую реакцию?
12. Свойства гидроксидов катионов I аналитической группы.
Анализируемая смесь включает
Источник: studopedia.su