Если предварительные испытания убедят в том, что измельчение исследуемого вещества безопасно, его истирают возможно мельче в фарфоровой, а затем в агатовой ступке. Отдельные небольшие порции измельченного вещества пробуют растворять на холоду, а затем при нагревании последовательно в таких растворителях: вода, 3 М HCl, затем 12 М HCl, 3 М HNO3, затем 16 М HNO3 и, наконец, царская водка [7].
Если растворимость нельзя определить на глаз, ее устанавливают, взяв на часовое стекло каплю растворителя, после его воздействия на вещество, и выпарив затем досуха жидкость. Наличие сухого остатка на стекле и его количество характеризуют растворимость в данном растворителе [7].
К последующему растворителю следует переходить, если установлено, что предыдущий не растворяет исследуемого вещества. Если вещество представляет собою гетерогенную смесь, компоненты которой различаются по растворимости, можно применять несколько растворителей последовательно: например, обработать объект водой, а остаток растворить в 3 М HCl. Полученные два раствора следует смешать и, если при этом не образуется осадок, то таким же образом можно приготовить и весь исходный раствор для анализа [7].
Нерастворяющийся осадок, который остается после смешения таких растворов или применения всех растворителей, чаще всего содержит такие вещества (соединения редких и рассеянных элементов не рассматриваются):
некоторые соли серебра – AgCl, AgBr, AgI, AgCN – белого или желтого цвета;
некоторые сульфаты – BaSO4, SrSO4, CaSO4, PbSO4 – белого цвета;
некоторые фториды – CaF2 и др. – белого цвета;
некоторые окислы – А12O3, SnO2 и др. – белого цвета, Fe2O3 – бурого цвета, Сг2O3 – зеленого цвета;
некоторые силикаты – Al2O3∙2SiO2 и др. цвет может быть любым.
2.1.1.3 Анализ катионов и анионов
После того как испытуемый минерал тем или иным способом переведено в раствор, приступают к исследованию этого раствора на катионы и анионы за кислотно-основной схемой [8].
2.2.2 Общая характеристика фотометрических методов определения мышьяка
В наиболее удачном методе определения мышьяка использована реакция образования желтой мышьяковомолибденовой гетерополикислоты, которую затем восстанавливаю до так напиваемой мышьяковомолибденовой сини. Однако можно проводить определение мышьяка и по оптической плотности желтого комплекса [7].
Спектры поглощения желтого мышьяковомолибденового комплекса и мышьяковомолибденовой сини представлены на рис.1.
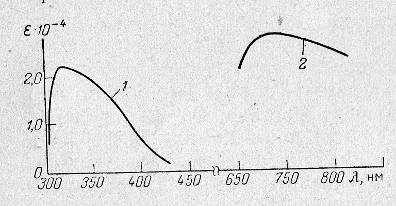
Рисунок 2.1 Спектры поглощения желтого(1) и синего(2) мышьяковомолибденовых комплексов
Из этого рисунка следует, что если проводить измерение оптической плотности желтого комплекса в видимой области при 400 нм, то чувствительность метода примерно в 5 раз меньше по сравнению с чувствительностью метода, основанного на измерении оптической плотности мышьяковомолибденовой сини при 700 – 800 нм. Свойства мышьяковомолибденовых гетерополикислот, как желтой, так и синей, подобны свойствам фосфорномолибденовых гетерополикомплексов. Поэтому основная трудность при определении мышьяка этим методом заключается в отделении мышьяка от фосфора [7].
Кинь СЕРЕБРО В этот Раствор — ОНО ЗАСИЯЕТ КАК БЕЛОЕ ЗОЛОТО 👍#совет #лайфхак
2.2.2.1 Количественное определение мышьяка в неизвестном минерале
Навеску металла разрушают азотной кислотой, сурьмяную кислоту связывают тартратом и мышьяк выделяют вместе с магний-аммоний фосфатом. После чего отделяют мышьяк в виде арсина и определяют в виде мышьяковомолибденовой сини [7].
2.2.2.2 Реактивы и приборы
Фосфат калия, однозамещенный, 2%-ный раствор. Растворяют 20 г однозамещенного фосфата калия в воде, разбавляют до 1 л и перемешивают.
Магнезиальная смесь, растворяют 55 г хлорида магния MgCl2∙6H2O и 105 г хлорида аммония NH4Cl в воде, добавляют 350 мл концентрированного раствора аммиака и разбавляют водой до 1 л. Дают раствору отстояться в течение 3 – 4 дней и фильтруют.
Хлорид олова(II), 0,5%-ный раствор в хлористоводородной кислоте, разбавленной (1 : 1).
Молибдат-гидразиновый реактив. Растворяют 1 г молибдата аммония в 100 мл 5 н. серной кислоты и 0,15 г сернокислого гидразина в 100 мл воды. Разбавляют 10 мл раствора молибдата аммония до 90 мл водой, добавляют 1 мл раствора сернокислого гидразина и водой разбавляют до 100 мл. Эта смесь неустойчива, и поэтому ее готовят ежедневно или в ходе анализа отдельно прибавляют соответствующее количество растворов молибдата аммония и сернокислого гидразина.
Прибор для отгонки хлорида мышьяка(III) (показан на рис. 2.2), спектрофотометр КФК-3, кюветы на 1см, набор колб и пипеток.
Источник: kazedu.com
Большая Энциклопедия Нефти и Газа
Строят график зависимости оптической плотности от концентрации стандартных растворов серебра . По графику находят концентрацию серебра в фильтрате. Из первоначально прибавленного количества серебра вычитают количество серебра, найденное в фильтрате, и таким образом находят количество серебра, связанное с бромом. [7]
Для построения калибровочной кри вой к серии стандартных растворов серебра прибавляют по 1 мл азотной, серной кислот и 10 -ного раствора персульфата аммония, нагревают до появления паров SOg и после охлаждения поступают так, как описано выше. [8]
Таким же способом получают данные для построения калибровочной кривой со стандартным раствором серебра соответствующей концентрации . [9]
Это дает возможность титриметрически определять роданиды и цианиды, используя в качестве титранта стандартные растворы серебра в присутствии различных индикаторов, фиксирующих КТТ. Наибольшее распространение нашли адсорбционные индикаторы, например, некоторые красители, сорбирующиеся образующимися в процессе титрования осадками и изменяющие при этом свою окраску. [10]
Метод основан на том, что хлорид-ион осаждают, добавляя в исследуемый раствор заведомый избыток стандартного раствора серебра . Не вошедшее в реакцию с хлорид-ионом серебро оттит — ровывают раствором роданида. Так как хлорид серебра более растворим, чем роданид ( см. с. [11]
Концентрацию дитизона в растворе четыреххлористого углерода определяют путем измерения поглощения зеленого раствора или методом экстракционного титрования, применяя стандартный раствор серебра . Определение проводят следующим образом. В делительную воронку вносят 100 мкг серебра ( 10 мл раствора серебра при концентрации 0 01 мг / мл), добавляют из бюретки ( темного стекла) порциями 0 001 % — ный раствор дитизона и встряхивают. Образующийся оранжевый дитизонат серебра сливают и опять встряхивают с новой порцией дитизона. Под конец добавляют 0 5 — 0 2 мл раствора дитизона. Первое экстракционное титрование имеет ориентировочный характер. На экстракционное титрование 100 мкг серебра идет 23 75 мл точно 0 001 % — ного раствора дитизона. [12]
Если применяют фотометр, то помещают подкисленный раствор анализируемого образца подходящего объема, содержащий 2 — 10 у серебра, в делительную воронку и встряхивают в течение 2 мин с 5 0 мл раствора дитизоната меди. Стандартные растворы серебра , применяемые для построения стандартной кривой, должны иметь примерно такой же объем и кислотность, что и анализируемый раствор. [13]
Если желают применить фотометр, то берут количество анализируемого раствора, содержащее от 2 до 10 г серебра, и 2 мин. Стандартные растворы серебра , служащие для построения калибровочной кривой, должны иметь приблизительно те же объем и кислотность, что и анализируемый раствор. [14]
Полученный раствор выпаривают досуха. Затем к нему добавляют 25 мл воды, 2 5 мл стандартного раствора серебра ( 3 148 г нитрата серебра растворяют в воде и доводят объем раствора до 1 л, 1 мл такого раствора содержит 2 мг серебра) и разбавляют водой до 50 мл. Получают отсчеты для линии меди 324 8 ммк, для фона при 325 0 и 327 0 ммк, затем для линий меди 327 4 ммк, серебра 328 1 ммк и фона при 328 3 ммк. [15]
Источник: www.ngpedia.ru
Растворимость и комплексообразование

Очевидно, что комплексообразование, связывая ионы в растворе, будет влиять на растворимость малорастворимых солей, точнее говоря, оба процесса — комплексообразование и осаждение — будут конкурировать друг с другом. Например, добавив достаточное количество раствора аммиака к осадку хлорида серебра, мы можем перевести серебро в растворимый комплекс:

Нетрудно видеть, что эта реакция представляет собой сумму уже известного нам процесса осаждения
равновесие в котором определяется произведением растворимости [ Ag 4 ][Cl ] = = 1,8-10 10 , и комплексообразования

которому отвечает константа устойчивости Куст = [Ag(NII:i)-|]/[Ag*][NH:J 2 = = 2,9-10 7 . Нетрудно убедиться в том, что равновесию в нашей суммарной реакции соответствует константа, равная произведению ПР-К :

Следовательно, хлорид серебра растворим в присутствии аммиака гораздо больше, чем в воде без добавок.
Если же вместо AgCl мы возьмем еще менее растворимый Agl (ПР = = 8,3-10 17 ), то окажется, что даже максимально возможные концентрации аммиака не приводят к заметному растворению Agl, так как произведение ПР • К = 8,3 • 10 17 • 2,5 • 10 7 = 2 • 10 9 оказывается слишком мало и необходимо искать более сильный комплексообразователь.
Комплексообразовапие с участием ионов серебра имеет большое практическое значение в фотографии. Процесс фиксирования изображения на галогенсеребряных фотоматериалах как раз заключается в растворении галогенида серебра (хлорида, бромида или иодида, в зависимости от типа материала) на незасвеченных участках. Для этой цели используется образование комплексов серебра уже не с аммиаком, а с еще более сильным комплексо- образователем — ионом тиосульфата:

В присутствии Na2S203 все галогениды серебра быстро и полно переходят в раствор в форме Ag(S2Oз)2“(вoдн).
Резюме
Произведение растворимости — весьма информативная величина, очень удобная при обсуждении свойств растворов сильных электролитов, но для активного использования ее необходимо:
- • уверенно пользоваться всеми способами выражения концентраций;
- • хорошо понимать, как соотносится аналитическая концентрация соли с концентрациями ее ионов;
- • легко ориентироваться в направлениях смещения равновесий;
- • помнить и понимать свойства константы равновесия.
Если у вас нет полной уверенности в понимании этих проблем, вернитесь еще раз к гл. 12 и 13.
Практикум
Вопросы для самоконтроля
1. Приготовили два раствора. В 1 л первого растворено по 0,01 моль NaCl и КВг, в 1 л второго растворено по 0,01 моль КС1 и NaBr. Будут ли различаться свойства этих растворов?
2. Сульфат кальция CaSO, заметно растворим — в 1 л насыщенного раствора содержится 2 г соли, nP(CaS01) = 2,5-10 а концентрации ионов Са 2+ и SO 2 равны. Как изменится концентрация ионов Са 2+ если к 1 л этого раствора добавить 1 моль хорошо растворимого Na2SO^?
- 1. Напишите всю цепочку равновесий, связывающих K2S в растворе и H2S над этим раствором. Используя принцип Ле Шателье, покажите, как будут смещаться все равновесия при добавлении к раствору кислоты или щелочи.
- 2. Объясните, по какой причине практически нерастворимый в воде хлорид серебра легко растворяется в растворе аммиака.
- 3. Произведения растворимости солей AgBr и Mg:,(PO,)2 практически одинаковы и равны 2-10 |3 . Докажите, что концентрация ионов Ag’ в насыщенном растворе AgBr во много раз меньше, чем концентрация ионов Mg 2 ‘ в насыщенном растворе Mg3(PO,)2.
Задачи для самостоятельного решения
- 1. Вычислите ПР(СаСО:() при 20°С, если при этой температуре в 100 мл раствора содержится 6,5 -10 4 г соли.
- 2. Произведения растворимости хлорида, хромата и ортофосфата серебра при 20°С соответственно равны 1,8-10 |0 ; 4,0 -10 ,2 ; 1,3 -10 20 . Вычислите, для какой из солей молярная концентрация ионов серебра в насыщенном растворе наибольшая.
- 3. Сколько граммов хлорида натрия можно добавить к 1 л 0,001 М раствора AgN03 до появления осадка?
- 4. В растворе содержатся хлориды кальция и бария в равных молярных долях. Какой из ионов металлов первым начнет переходить в осадок при добавлении к раствору серной кислоты?
Источник: studme.org