Поперечное сечение захвата тепловых нейтронов 2,35*10 -28 м 2 . Конфигурация внеш. электронной оболочки 4s 2 4p 2 ; степень окисления + 4 (наиб. устойчива), + 3, + 2 и + 1; энергия ионизации при последоват. переходе от Ge° к Ge 4+ соотв. 7,900, 15,9348, 34,22, 45,70 эВ; электроотрицательность по Полингу 1,8; атомный радиус 0,139 нм, ионный радиус (в скобках указаны координац. числа) для Ge 2 + 0,087 нм (6), для Ge 4+ 0,053 нм(4), 0,067 нм(6).
Содержание германия в земной коре 1,5*10 -4 % по массе. Относится к рассеянным элементам. В природе в своб. виде не встречается. Содержится в виде примеси в силикатах, осадочных железных, полиметаллич., никелевых и вольфрамовых рудах, углях, торфе, нефтях, термальных водах и водорослях. Важнейшие минералы: германит Cu,(Ge, Fe, Ga)(S, As)4 (6,2-10,2% германия), яргиродит Ag8GeS6 (3,65-6,93%), рениерит Cu3(Fe, G.e,Zn)(S, As)4 (5,46-7,80%), плюмбогерманит (Pb,Ge,Ga)2SO4(OH)2*2H2O*(8,18%).
В США, Италии, ФРГ и нек-рых др. странах осн. источник германия — побочные продукты переработки; медно-свинцово-цинковых сульфидных руд, в Заире и Намибии-полиметаллич. руды. В золе бурых углей содержится от 0,0005 до 0,34% германия, в золе каменных углей-от 0,001; до 1-2% германия.
Зарплаты в Германии
Свойства. Компактный германий — вещество серебристого цвета с металлич. блеском; кристаллич. решетка устойчивой модификации Ge I-кубич. гранеценрированная типа алмаза (а = = 0,566 нм). При высоких давлениях Ge I переходит в др. модификации (см. табл.), к-рые, по сравнению с ним, отличаются большими плотностью и электрич. проводимостью.

КРИСТАЛЛИЧЕСКИЕ МОДИФИКАЦИИ ГЕРМАНИЯ ПРИ ВЫСОКИХ ДАВЛЕНИЯХ
При конденсации пара германия на пов-сти с т-рой 100-370 °С образуется аморфный германий, к-рый при 250 °С и обычном давлении или при 20 °С и давл. 600 МПа превращ. в Ge I. Т. пл. 938,25°С, т. кип. 2850°С; плотн.
5,33 г/см 3 ; C o p 23,32 Дж/(моль*К); 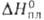 37,3 кДж/моль,
37,3 кДж/моль, 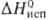 369,04 кДж/моль; S o 298 31,09 Дж/(моль*К); давление пара 0,665 Па (938 °С); температурный коэф. линейного расширения 6,1*10 -6 К -1 (273-603 К) и 6,6*10 -6 К -1 (573-923 К); теплопроводность 5,62 Вт/(м*К);
369,04 кДж/моль; S o 298 31,09 Дж/(моль*К); давление пара 0,665 Па (938 °С); температурный коэф. линейного расширения 6,1*10 -6 К -1 (273-603 К) и 6,6*10 -6 К -1 (573-923 К); теплопроводность 5,62 Вт/(м*К);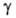
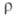 0,47 Ом*м (300 К); концентрация носителей тока с собств. проводимостью 2*10 7 м -3 (300 К); при 300 К подвижность электронов 0,39 м 2 /(В*с), дырок-0,19 м 2 /(В*с). Для получения германия с дырочной проводимостью используют легирующие добавки В, Al, Ga, In, с электронной — Р, As, Sb.
0,47 Ом*м (300 К); концентрация носителей тока с собств. проводимостью 2*10 7 м -3 (300 К); при 300 К подвижность электронов 0,39 м 2 /(В*с), дырок-0,19 м 2 /(В*с). Для получения германия с дырочной проводимостью используют легирующие добавки В, Al, Ga, In, с электронной — Р, As, Sb.
Германий хрупок: не поддается холодной и горячей обработке давлением до ~ 550 °С, выше этой т-ры становится пластичным. Твердость по минералогич. шкале 6,0-6,5 (его распиливают на пластины с помощью алмазного или ме-талдич. диска с применением абразива). Прозрачен для ИК-света при длинах волны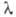
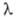 от 2,06 до 16,00 мкм), 3,4 (
от 2,06 до 16,00 мкм), 3,4 (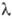 = SB 550 мкм) и 4,1 (
= SB 550 мкм) и 4,1 (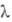 =690 мкм); коэф. отражения света с
=690 мкм); коэф. отражения света с 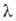 = 1-10 мкм-36-39%.
= 1-10 мкм-36-39%.
Германий — Полуметалл, Создающий СКОРОСТНОЙ ИНТЕРНЕТ!
Германий устойчив к действию воздуха, воды, О2, соляной к-ты и разб. H2SO4, медленно взаимод. с конц. H2SO4. Реагирует с царской водкой и HNO3 с образованием на пов-сти пленки GeO2. Слабо взаимод. с р-рами едких щелочей, в присут. Н2О2-легко, при этом образуются соли германаты.
Выше 700 °С быстро окисляется на воздухе до GeO2, в токе О2 или СО2-до германия оксидов GeO и GeO2. Образует с S при 600-700°С GeS, при 1000-1100°C-GeS2, с Se при ~ 500°C-GeSe. Легко взаимод. с галогенами, давая тетрагалогениды (см. Германия галогениды). С N2, Si, Н2 и С не реагирует.
Известны летучие германоводороды GenН2n+2, а также нитрид. Образует германипорганические соединения,
С более электроположит. элементами германий образует германиды двойные (напр., FeGe, Cu3Ge) и тройные (напр., MnAlGe)-хрупкие твердые в-ва с металлич. блеском. Большинство имеет высокие т-ры плавления; наиб. тугоплавкие-Zr,Ge3 (т. пл. 2330 °С), Hf5Ge3 (2200 °С), Th3Ge2 (2000 °С).
Многие обладают металлич. проводимостью, для нек-рых характерны высокие т-ры перехода в сверхпроводящее состояние (напр., 6,0 К для V3Ge и 6,9 К для Nb3Ge). Среди германидов есть полупроводники (напр., Mg2Ge), ферромагнетики (напр., Mn5Ge3). Германиды щелочных и щел.-зем. металлов окисляются на воздухе, гидролизуются водой, разлагаются к-тами; более стойки к действию агрессивных сред соед. переходных металлов. Получают германиды в осн. спеканием или сплавлением элементов, а также электролизом расплавов, восстановлением оксидов и др. способами. Нек-рые германиды — перспективные полупроводниковые и магн. материалы, материалы для термоэлементов и ядерной техники, упрочнители сплавов.
Наиб. практически важным соед. германия — оксидам и галогенидам посвящены специальные статьи. Ниже приводятся сведения о нек-рых др. соед. этого элемента.
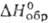
Моносульфид GeS-темно-серые кристаллы; т. пл. 658°С; плотн. 4,01 г/см 3 ; -73,40 кДж/моль; не взаимод. с водой; реагирует с разб. неорг, к-тами и р-рами щелочей. Получают взаимод. Ge с S при 600-700 °С, восстановлением GeS2 водородом, р-цией H2S с солями Ge(II).
GeS — полупроводниковый материал.
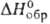
Дисульфид GeS2-белое аморфное (получают осаждением H2S из кислых р-ров GeCl4) или кристаллич. (образуется при взаимод. S и Ge при 1000-1100°С) в-во; т. пл. 840°С; плотн. 2,94 г/см 3 ; — 150,06 кДж/моль; водой гидролизуется, реагирует с соляной к-той и р-рами щелочей, с (NH4)2S образует (NH4)6Ge2S7. Дисульфид германия — перспективный полупроводниковый материал.
Селенид GeSe — темно-коричневые кристаллы; т. пл. 670°С (с разл.); не взаимод. с водой; окисляется HNO3. Получают взаимод, Ge с So при 500 °С в атмосфере СО2 с послед, плавлением продукта р-ции и быстрым охлаждением. Обладает полупроводниковыми св-вами.
Теллурид GeTe-сероватые кристаллы с металлич. блеском; т. пл. 725°С; не взаимод. с водой; разлагается царской водкой и смесью соляной к-ты с Н2О2. Получают сплавлением Ge с Те. Обладает полупроводниковыми св-вами, выше 375 °С-ярко выраженными термоэлектрич. св-вами. Компонент сплавов с Мп, Сr и др.
Гидрид GeH4 — бесцв. газ; т. пл. — 165 °С, т. кип. — 88,5 Р С; т. разл, ок. 300 °С; раств. в воде и полярных орг. р-рителях. Получают взаимод. GeO2 с водным р-ром Na[BH4]. Применяют для получения полупроводникового
Нитрид Ge3N4-бесцв, или светло-желтые кристаллы; т. разл. ок. 1400°С, начинает выделять N2 ок. 450 °С; плотн. 5,25 г/см 3 ; диамагнитен; не взаимод. с водой, р-рами щелочей и разб. к-тами. Получают действием NH3 на Ge или GeO2.
Получение. В кач-ве сырья для получения германия используют побочные продукты переработки руд цветных металлов, золу от сжигания углей, нек-рые продукты коксохим. произ-ва (напр., смолы и надсмольные воды). Германийсодержащее сырье обогащают методами флотации, магнитным или др., а затем выделяют концентрат германия При пирометаллургич. способе процесс обычно проводят при 800-1800 °С в восстановит. атмосфере (СО, Н2) в присут. S (или H2SO4, сульфатов щелочных или щел.-зем. металлов); Германий частично или полностью переходит в газовую фазу в виде GeO, GeO2, GeS, GeS2, Ge, к-рые улавливают вместе с др. летучими компонентами и пылью.
Содержащие германий пыли, получающиеся при переработке руд цветных металлов, обычно выщелачивают разб. р-ром H2SO4. Из р-ров выделяют концентрат германия (соосаждением с др. элементами, напр. с Fe в виде Fe(OH)3 при рН 4,8-5,4), к-рый затем сушат, обжигают, обрабатывают конц. соляной к-той и извлекают образовавшийся GeCl4 дистилляцией. Из сернокислых р-ров германия извлекают также методом ионного обмена с использованием в кач-ве элюента соляной к-ты. Солянокислый р-р подвергают дистилляции с получением GeCl4 либо растворенный тетрахлорид гидролизуют р-ром щелочи до GeO2.
При переработке коксующихся углей германий частично (5-10%) попадает в смолу и надсмольную воду, откуда его извлекают в виде комплекса с таннином, затем его сушат и обжигают (400-500 °С); при этом получают концентрат, содержащий 30-40% германия, из к-рого выделяют германий в виде GeCl4. При сжигании углей или их газификации германия возгоняется вместе с летучими частями золы. Золу подвергают восстановит. плавке с флюсом и коллектором германия — CuO или Fe2O3. Полученный сплав Си или Fe с германием растворяют в водном р-ре FeCl3 в токе С12, подкисляют р-р H2SO4 и извлекают германий в виде GeCl4. По др. способу пыль сплавляют с NaOH, плав выщелачивают водой, очищают р-р от примесей А1 и Si и выделяют образовавшийся в результате гидролиза GeO2.
Из золы, богатой германием (более 1%), его извлекают также обработкой 31%-ной соляной к-той при 105-110°С. Применяют также метод, по к-рому золу, содержащую менее 1% германия, подвергают пирометаллургич. обработке в электрич. или циклонных печах; сублимат выщелачивают конц. НCl либо разб. H2SO4, из р-ра германия выделяют соосаждением, ионным обменом, цементацией или др. способами.
Определение. Гравиметрически германий определяют: в виде GeO2, образующегося при прокаливании GeS2, получаемого осаждением сероводородом из соляно- или сернокислых р-ров соед. Ge 4+ ; в виде MgGeO3; в виде гидроксихинолиниевой соли германомолибденовой к-ты (C9H7NO)4*H4[Ge(Mo2O7)6].
Германий определяют также алкалиметрически в присут. пирокатехина или пирогаллола, образующих с соед. Ge 4+ растворимые комплексные двухосновные к-ты (индикатор бромкрезоловый пурпуровый).
При комплексонометрич. определении германия избыток комплексона (двунатриевой соли этилендиаминтетрауксусной к-ты) после взаимод. с Ge 4+ оттитровывают р-ром ZnSO4 в присут. ксиленолового оранжевого в кач-ве индикатора при рН 5,2-6,1. Определению германия данным методом мешают щел.-зем., тяжелые и цветные металлы. наиб. чувствительный метод определения малых кол-в германия — фотометрический с помощью фенилфлуорона в солянокислой или сернокислой среде. Отделение германия от мешающих элементов осуществляется дистилляцией GeCl4 из 6 М соляной к-ты в присут. Н3РО4 или его экстракцией СС14 из 8-9 М соляной к-ты.
Качественно германия обнаруживают с помощью эмиссионного спектрального анализа (источник возбуждения-дуга), а также по цветным р-циям, напр. по образованию ярко-желтой германомолибденовой к-ты H8[Ge(MO2O7)6] с послед. восстановлением Mo 6+ бензидином или щелочным р-ром Na2SriO2. Специфич. р-ции на германий — взаимод. с хинализарином или с гидроксинафталинсульфоновой к-той.
Применение. Германий — полупроводниковый материал, используемый в виде монокристаллов очень высокой чистоты для изготовления диодов, транзисторов, фотодиодов и фоторезисторов.
Из него производят датчики Холла, линзы для приборов ИК-техники, рентгеновской спектроскопии и детекторы ионизирующих излучений (чувствительность 10 14 ат/см 3 ), термометры сопротивления, эксплуатируемые при т-ре жидкого Не. Сплавы германия с Аи, обладающие высокой твердостью и прочностью, используют в ювелирной и зубопротезной технике для прецизионных отливок. Сплавы с Si или с В-высокоэффективные термоэлектрич. материалы, с Nb и Ti- сверхпроводники, с Al, Si и Fe-термоэмиссионные материалы, с Мп и А1 — магнитные. Нек-рые сплавы германия применяют в кач-ве припоев (напр., с Al, Si и Аи), антикоррозионных покрытий (со Sn или со Sb).
Мировое произ-во германия (без СССР) 65 кг в год. Германий открыт в 1886 К. А. Винклером.
===
Исп. литература для статьи «ГЕРМАНИЙ» : Тананаев И. В., Шпирт М. Я., Химия германия, М., 1968; Самсонов Г. В., Бондарев В. Н., Германиды, М., 1968; Назаренко В. А., Аналитическая химия элементов. Германий, М., 1973; Шпирт М. Я., Физико-химические основы переработки германиевого сырья, М., 1977; Нашельский А. Я., Производство полупроводниковых материалов, М., 1982. Н.М. Эльхонес, Л. И. Локшина.
Страница «ГЕРМАНИЙ» подготовлена по материалам химической энциклопедии.
Источник: xumuk.ru
Как получают германий
![]()
Германий получают восстановлением двуокиси германия водородом или углеродом. Затрудняющим обстоятельством является образование при восстановлении низшего окисла германия GeO5 который легко возгоняется выше 700°, что снижает выход металла. Наиболее чистый металл получают восстановлением GeO2 водородом по реакции
GeO2 + 2Н3 = Ge + 2Н2О.
Восстановление ведут в графитовых лодочках при температуре 600—700° в трубчатых печах. При этом получают темносерый порошок. После восстановления водород вытесняют азотом и в атмосфере азота поднимают температуру печи до 1000° для переплавки порошка в слиток. Пои плавке в водороде получается пористый металл, так как жидкий германий поглощает водород, который выделяется в момент затвердевания. Общее извлечение в металл составляет около 95%.
Другой способ получения чистого германия состоит в восстановлении четыреххлористого германия парами цинка по реакции:
GeCl4газ + 2Znгаз = Geтв + 2ZnCl2газ.
Восстановление производится при температуре 930° в установке, схема которой приведена на рис. 214.

Реакционная камера представляет собой трубу из плавленого кварца (диаметр трубы 110—120 мм, длина 90—100 мм). В запаянный конец трубы впаяны кварцевые трубки для подачи в камеру паров хлорида германия и цинка, поступающих из испарителей. Пары хлорида германия до поступления в камеру предварительно подогреваются в трубках длиной около 4,2 м, расположенных внутри печи.
Пары хлористого цинка и избыточного цинка выходят через кварцевый патрубок в кварцевый конденсатор.
Получаемый при температуре процесса германий конденсируется в виде сплава с цинком на стенках реакционной камеры.
Содержание цинка в сплаве достигает 40%. Большая часть цинка удаляется при длительном нагревании сплава при температуре 980—950° в атмосфере азота.
Оставшиеся примерно 0,2% цинка удаляются плавкой германия в вакууме
Менее чистый металл получается восстановлением углеродом. Двуокись смешивают с углем, цианидом натрия и хлористым натрием, последний служит защитным флюсом. Процесс ведется при температуре 1200° в графитовых тиглях.
В литературе описан процесс электролитического получения германия из GeO2. Электролиз GeO2 ведется в ванне из расплавленного фторогерманата калия (K2GeF ) или криолита (Na3AlF6) в графитовом тигле с графитовым катодом. На катоде выделяются маленькие корольки металлa. Выход в процессе низкий вследствие улетучивания части германия в виде GeO.
Основной примесью в плавленом германии является кислород (в виде окиси), от которого он может быть очищен плавкой в вакууме или переплавкой в атмосфере водорода.
- Извлечение германия из отходов переработки углей
- Извлечение германия из отходов цинкового производства
- Источники сырья германия
- Области применения германия
- Гидриды германия (германоводороды)
- Сульфиды германия
- Галогениды германия
- Германаты
- Окислы германия
- Свойства германия
Источник: metal-archive.ru
Получение германия применение

Основное нахождение германия в земной каре в виде вольфрамовых , никелевых и полиметаллических руд , иногда встречается силикатах . Из них германий получают восстановлением оксида германия GeO 2 .
Основное применение его в электронной промышленности , но основная задача заключается в том , чтобы радиодетали которые содержат германий работали корректно , это достигается в создании металла сверх высокой чистоты 99,99999999% .
Германий это
Серебристо-серое вещество с металлическим блеском. В хим. соединениях проявляет степени окисления + 2 и +4. Природный германий состоит из четырех стабильных изотопов с массовыми числами 70 (20,55%), 72 (27,37%), 73(7, 67%) и 74 (36,74%) и одного радиоактивного изотопа с массовым числом 76 (7,67%) и периодом полураспада 2 • 106 лет. Германий относится к рассеянным элементам и редко встречается в виде собственных минералов. Известно семь минералов, в к-рых его концентрация больше 1 %. При плавлении германий уменьшается в объеме (примерно на 5,6%), плотность его увеличивается на 4% ч
Зонная плавка германия
Получение германия высокой чистоты и иногда применяется для замещения предварительных реакций для очищения тетрахлорида германия . Этот метод является разновидностью направленной кристаллизации и отличается только тем ,что в период некоторого времени определённая часть металла находится в расплавленном состоянии . Его применяют в тех случаях когда примеси других металлов лучше растворяется в жидкой фазе расплавленного металла и тем самым передвигаясь по расплавленной зоне , в результате чего примеси накапливаются в одной из части образца . Этот метод широко используют нейтрализации примесей для получения многих сверх чистых металлов .
Описание процесса для зонной плавки германия
Прибор для зонной плавки германия изготавливают из материала с высокой температурой плавления и его материал не должен вступать в реакцию или растворятся в германии , в основном это высокочистый графит .
Прибор представляет собой трубку в которую помещена графитовая лодочка с выемкой для германия , концы трубки запаивают и выкачивают воздух .
Для того , чтобы расплавить германий используют прибор с принципом на индукционных полях (пример индукционная печь для плавления металлов с температуры плавления 1550 градусов ) .
Для расплава один конец помещают в индукционный виток и по мере расплава продвигают , скорость передвижения составляет от нескольких миллиметров в час в зависимости от степени чистоты германия . Если материал лодочки вступает в реакцию с германием , то после одной очистки германия с помощью зонной плавки используют способ плавки без тигля .
Получения германия без тигельный метод
Без тигельный метод заключается в том , что место расплава индукционными полями рассчитывается со временем замерзания германия , своими словами если скорость нагрева будет больше скорости замерзания германия то материал просто будет вытекать , что приведёт к повторению трудоёмкого процесса . В основном это случается с большими размерами германия и за этого с начало производят предварительную зонную плавку германия в лодочке , а затем используют без тигельный способ .
Далее проверяют германий на соответствие параметров , при этом сопротивление его должно быть порядка 70 Ом·см , что примерно составляет один атом примеси на 1010 атомов чистого германия .
Основное применение германия в производстве радиодеталей и микросхем , в ядерной физике как детектор гамма — излучений , в производстве оптоволокна , в производстве инфракрасной техники и так далее .
Получение германия с помощью химических реакций.
Для того , чтобы германий приобрёл свои уникальные свойства его тщательно неоднократно очищают разными способами .
Для получения металла в основном берут оксид германия , его получают гидролизом очищенного тетрахлорида германия GeCl 4 , некоторые примеси хлорида мышьяка удаляют ректификацией с дополнительной очисткой хлорида германия . Это достигается за счёт растворимости солей германия , помимо применяют и другие методы методы при применении концентрированной соляной кислоты HCl в результате такой переработки получается чистота примесей тетрахлорида германия не превышающая примесей до 10 ³ ⁻ % .
Гидролиз хлорида германия :
Основные требования к чистое германия это его чистота именно за неё зависит дальнейшая работа радиодеталей и так далее . Для создания удовлетворяющих всех требований свойств нужно брать для очистки также все компоненты с очень высокой чистотой , так для гидролиза тетрахлорида германия используется вода которая прошла множество предварительных дистилляций и очищение с помощью ионообменных смол . Материал в которой производится дистилляция изготовлена только из кислотостойких полимеров . Основное ударение уделяют сушке , для этого используют специальные камеры в которых создаётся вакуум при температуре 150 градусов .
После проведения множеств реакций по очищению , нужно узнать , а соответствует ли оксид германия своим нормам . Для этого берут небольшую порцию оксида германия и восстанавливают его до металла , для восстановления используют чистый водород , а температура для реакции колеблется от 600 до 750 градусов .
Также нужно учесть тот факт , что восстановление производится только в специальной термостойкой таре .
После получения металлического германия его нужно про верить на чистоту , для этого проверяют его удельное сопротивление , так как сопротивление в прямую связано с чистотой германия . Если удельное сопротивление не соответствует норме , то весь процесс повторяют обратно :
получение тетрахлорида германия > очистка тетрахлорида германия > гидролиз хлорида германия > пробное восстановление с проверкой параметров .
Вы читаете, статья на тему получение германия
Похожие страницы:
ИСТОРИЯ ПОЛУЧЕНИЯ ГЕРМАНИЯ КАК БЫЛ ОТКРЫТ [no_toc] В земной коре германия не очень мало — 7 · 10-4 % ее.
Германий это химический элемент, простое вещество находиться в 14 группе 4 периода периодической системы химических элементов, имеет формулу Ge и атомный номер.
ПОДГРУППА ГЕРМАНИЯ Элемент Символ Атомный вес Порядковый номер Распределение электронов по слоям Германий Ge 72,60 32 2 8 18 4 .
Что такое германий содержащие сплавы Это сплавы германия с другими химическими элементами. С металлами германий образует германиды, с кремнием —.
Получение металлов высокой чистоты Развитие в последние годы ряда новых отраслей техники ставит перед промышленностью задачу получения металлов значительно более.
СУРЬМА ПОЛУЧЕНИЕ Сурьма это сравнительно редкий элемент, в земной коре ее имеется не более 4 х 10-5%. Несмотря на это.
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
Источник: znaesh-kak.com