Второй, после золота, популярный в мировом масштабе благородный металл – серебро. Сегодня из серебра изготовляют не только украшения и предметы быта, но и используют в промышленности для производства разного технического оборудования и материалов. В состав многих предметов, которыми человек пользуется ежедневно, входит серебро (телефоны, компьютеры, зеркала и т.д.).

Залежей серебра по всему миру в самородочном или россыпном виде много, это практически чистое серебро. Но процесс поиска таких месторождений трудоемкий. Поэтому массовое распространение получили различные способы выделения драгметалла из сплавов и серебросодержащих руд при добыче его на рудниках.
- Способы и методы получения серебра
- Добыча серебра в мире
- Где добывают серебро в России История добычи серебра
- Компании, занимающиеся добычей серебра
-
Гидрометаллургия
Серебро на Руси
В древней Руси мерой стоимости различных предметов являлись бруски серебра. В тех случаях, когда какой-то предмет торговли стоил меньше всего бруска, от него отрубали часть, соответствующую указываемой стоимости вещи. Эти части назывались «рублями», Именно от них пошло название принятой в России денежной единицы — рубль.
Добыча и производство серебра как это сделано how this is done
Еще за 2500 лет до нашей эры египетские воины применяли серебро для лечения боевых ран. Они накладывали на них тонкие пластины серебра, и раны быстро заживали. В русской православной церкви святую воду для прихожан выдерживали только в серебряных сосудах. С середины прошлого века появились такие отрасли промышленности, как фотография, электротехника, радиоэлектроника, что привело к резкому росту спроса на серебро, его изъятию из денежного оборота.
Высокая электропроводность, хорошая пластичность, невысокая температура плавления, небольшая химическая активность серебра заинтересовала и радиотехников.

Фильтрация
Для отделения металла из раствора применяется воронка и фильтровальная бумага. В специально подготовленную емкость раствор с цементом сливается: соль меди стекает через слой пергамента, а серебро остается на поверхности. Впоследствии требуется еще 5 раз промыть фильтрат дистиллированной водой.
В растворе вероятно присутствие некоторого количества оставшегося серебра. Для его извлечения в медную соль добавляется поваренная до выпадения творожистого осадка.
Серебряный цемент высушивается. Сплавление производится в тигле, использование которого для работы с более чистыми образцами не предполагается. Нагревать образец нужно равномерно во избежание разлетания серебряной или окисленной пыли. Можно на поверхность расплава добавить пищевую соду и буру, смешанные в равных соотношениях – состав создаст над металлом стекловидную пленку, защищающую от потерь.
Полученное вещество является низкопробным. Для его более тщательного очищения требуется провести электролиз серебра. Аффинаж в данном случае производится по уже описанному выше методу – для этого удобно переплавлять металл в гранулы.

Характеристика свойств
Все способы получения серебра основываются на его свойствах. Это металл белого цвета, практически не меняющийся под действием кислорода воздуха при комнатной температуре. Из-за присутствия в воздухе сероводорода, он со временем покрывается темным налетом сульфида серебра Ag2S. Удаляют данное соединение с поверхности серебряного изделия механически, применяя чистящие пасты либо тонкий зубной порошок.
Серебро довольно устойчиво к воде. Соляная, а также разбавленная серная кислота и царская водка на него не действуют, так как на поверхности металла образуется защитная пленка его хлорида AgCl.
Получение нитрата серебра основывается на способности металла вступать в реакцию с азотной кислотой. В зависимости от ее концентрации в продуктах реакции помимо серебра могут находиться оксиды азота (2 или 4).
Получение оксида серебра осуществляется путем добавления раствора щелочи к нитрату серебра. Получаемое соединение имеет темно-коричневый цвет.

Серебряная магия
Магические свойства благородного металла признаны даже церковью. Крещенскую воду освящают серебряным крестом, вода эта целебна. Каждому крещенному человеку хорошо носить серебряный крестик.
Магия серебра поглощает негатив, направленный на владельца украшения. Если драгоценный металл не справляется с потоком отрицательной энергии (подумайте, кому вы так насолили), он темнеет или даже чернеет. Кстати, это же происходит, если обладатель серебряного украшения болен. При любом варианте желательно посетить врача и эзотерика.
Если есть возможность, поставьте в квартире серебряную статуэтку, подсвечник, вазочку. Это очистит помещение от негатива. Не забывайте осматривать изделие — потемнело, изменило цвет — набралось негатива, пора устраивать «магическую чистку».

Вазы из серебра
Обычай дарить младенцу «на зубок» серебряную ложечку полезен, в этом не сомневаются исследователи благородного металла.

Серебряные ложки
Для женщин носить браслеты лунного металла — значит, усиливать свою женскую привлекательность. Серьги помогут справиться с мигренью, головными болями.
Мужчинам и женщинам поможет укрепить здоровье пояс-ремень с серебряной пряжкой. Только следите, чтобы пряжка находилась чуть ниже пупка.
Области применения
Благодаря физическим и механическим свойствам именно серебром покрывают радиодетали для повышения электрической проводимости и коррозионной устойчивости. Металлическое серебро используется при изготовлении серебряных электродов для различных видов современных аккумуляторов.
Вопросами электролитического серебрения и никелирования достаточно долго занимались специалисты в области гальванотехники: А. Ф. и П.Ф. Симоненко, А. П. Сапожников и др. И.М. Федоровский перенес вопрос, касающийся антикоррозийной стойкости покрытий, из лаборатории в промышленное производство. Соединения серебра (AgBr, AgCl, AgI) применяются для производства кино- и фотоматериалов.
Электролиз растворов солей
Рассмотрим получение серебра электролизом его солей. Собирается электрическая схема, в которой в качестве источника тока выступает гальванический сухой элемент. Максимальный ток в цепи не должен превышать 0,01 А. При применении сухой батарейки (4,5 В) ток ограничивается с помощью добавки проводника с сопротивлением не больше 1000 Ом.
Ванной для процесса серебрения может служить любой стеклянный сосуд. Анодом ванны выступает пластинка металла, имеющего толщину 1 мм и площадь чуть побольше, чем у самой детали. Серебро выбирают для анодного покрытия. В качестве рабочего раствора (электролита) для получения серебра выступает раствор ляписа. До опускания в ванну для серебрения необходимо обезжирить и отполировать деталь, затем протереть ее зубной пастой.
После удаления жира она промывается проточной водой. Судить о полном обезжиривании можно по равномерному смачиванию всей поверхности детали водой. При промывке пользуются пинцетом, чтобы на детали не оставались жировые следы от пальцев. Сразу после промывки деталь фиксируется на проволоке и помещается в ванну. Время получения серебра при серебряном аноде составляет 30 — 40 минут.
Если в качестве анода выбирается нержавеющая сталь, в таком случае скорость процесса меняется. Получение серебра из нитрата будет составлять 30 минут.
Вынутую из ванны деталь качественно промывают, обсушивают, начищают до блеска. При образовании темного осадка серебра ток снижается, для этого подключается дополнительное сопротивление. Это позволяет повысить качество получения серебра электрохимическим способом. Для равномерности покрытия в процессе электролиза деталь периодически поворачивается. Можно отложить металл на латунь, сталь, бронзу.
Как выбирается путь
Для изначально высокопробного серебра применяется электролитический аффинаж. Обычно при использовании данного метода имеет место ежедневный выпуск продукции. Электролиз помогает получить серебро исключительной чистоты за счет окислительно-восстановительного взаимодействия, в которое примеси не вступают в момент очистки.

В случае когда аргентум находится в виде раствора (нерастворимые сульфаты и хлориды), самым экономичным и удобным способом осаждения металла является химический (в некоторых ситуациях — электрохимический) метод.
Низкопробные сплавы чаще всего разделяются при помощи купелирования – в данном случае повысить чистоту смеси проще всего.
Химизм процесса
4Ag NO3 + 2Н2О электролиз 4Ag + О2 + 4HNO3

Получение в лаборатории
Рабочим раствором (электролитом) может стать отработанный фиксаж, в котором присутствуют катионы серебра. Галогениды этого металла образуют с тиосульфатом ряд комплексных солей. При электролизе на катоде выделяется серебро – металл. Получение его подобным способом сопровождается и выделением серы, что приводит к появлению на его поверхности тонкого черного слоя сульфида серебра.

Физиологическое действие
Серебро, которое обладает способностью убивать микробы, присутствует в малых дозах в тканях растений и животных. Его ионы участвуют в обменных процессах. Под влиянием этого вещества:
- Увеличивается количество нуклеиновых кислот.
- Улучшается работа головного мозга.
- Оказывается благотворное влияние на печень.
При дефиците в организме серебра нарушается функционирование желез. Длительное использование больших доз драгоценного металла способно привести к изменению цвета кожи. Исследования показали, что это не влияет на состояние внутренних органов, а у человека вырабатывается устойчивость к бактериям и вирусам.
Добыча и открытие
Первые упоминания о добыче серебра связаны с месторождениями, которые были обнаружены финикиянами на Кипре, в Сардинии, Испании, Армении. Металл присутствовал в них в соединении с серой, хлором, мышьяком. Удавалось обнаруживать и самородное серебро внушительных размеров.
К примеру, крупнейшим самородком серебра является образец, вес которого составлял тринадцать с половиной тонн. При очистке природных самородков расплавленным свинцом получался тусклый металл. В Древней Греции его именовали Электроном, предугадывая его отличные электропроводные свойства.
В настоящее время электролизом получают плотный слой металлического серебра. В качестве электролита применяют не только нитрат, но и цианиды. Отделение от меди серебра осуществляют выполняя электролиз из холодного раствора, в составе которого около одного процента серной кислоты, 2-3% персульфата калия. Порядка 20 мг металла можно отделить от меди за 20 минут, используя напряжение около 2 В.

В процессе электролиза в растворе должен оставаться избыток персульфата калия. Также среди вариантов разделения этих металлов можно рассмотреть электролиз кипящей уксуснокислой смеси. В настоящее время используются методики, предполагающие применение комплексантов. В растворе, который содержит ион этилендиаминтетрауксусной кислоты (ЭДТА) при кислой среде, серебро осаждается за 25 минут. Его отделяют от пластины путем электролитического осаждения на протяжении 2,5-3 часов.
От висмута и алюминия серебро отделяют путем проведения электролиза азотнокислого раствора при условиях, аналогичных разделению его смеси с медью.

Метод купелирования
Для данного типа аффинажа требуется наличие печи с чашеподобным (пробирным) тиглем. В процессе очистки применяется свинец, расплав которого с серебром окисляется в присутствии кислорода. Все примесные вещества, включая растворитель, отделяются от благородного металла, придавая ему относительную чистоту: в сплаве остается золото и металлы платинового семейства.
Для проведения аффинажа печь требуется предварительно разогреть. В нее помещается техническая свинцово-серебряная смесь, которая накаляется до полного расплавления. В печь запускаются потоки атмосферного воздуха, вызывающие окисление компонентов содержимого. При завершении термической обработки тигель извлекается и разливается в формы.
Изнутри печь выстлана мергелью – одним из видов глины, обогащенной известняком и имеющей пористую структуру. Она поглощает оксиды свинца, образующиеся в процессе аффинажа, так как последние склонны к испарению при воздействии потоков воздуха. На выходе, после окисления примесей, получается сплав с радужно переливающейся поверхностью. При ее растрескивании в смеси можно увидеть яркий серебряный блеск, который свидетельствует о завершении аффинирования.

Купелирование считается самым грубым методом очистки за счет того, что достигается не полное избавление от примесей: все благородные металлы в сплаве остаются на месте. Аффинаж золота, серебра и металлов платиновой группы для их разделения производится другими методами.
Источник: xn--g1amf0a.xn--p1ai
Как получают серебро: технология
Покрытие серебра золотом. О том, как позолотить серебро, все знают со школьной скамьи. Способов позолочения металлов (в том числе и серебра) существует множество. Вот для примера два из них: 1) Золочение натиранием хлорным золотом. Золото растворяется в «царской водке», а потом из раствора полностью выпаривается жидкость.
То, что осталось в осадке, и является хлорным золотом, ;- его еще раз растворяют (в цианистом калии) и размешивают с мелом до консистенции кашицы. Этой кашицей покрывают серебро, промывают и полируют. 2) Золочение гальваническим методом. Позолочение серебра этим методом является ;лучшим способом закрепления позолоты на его поверхности.
Метод основан на использовании золотых ванн и опускании в них металла. Во время нахождения серебра в ванне через нее пропускают ток.
Чистка серебра. Серебро быстро окисляется, покрываясь чернотой. Бытует поверье, что потемнение серебряных изделий на теле владельца подтверждает факт какого-либо заболевания. Но это все домыслы. Если такое случилось, то следует знать ;как почистить серебро от черноты. Это можно сделать в домашних условиях.
Например, с помощью мыльного раствора, в который следует добавить немного нашатыря (1 ложка на литр раствора). Или же нарезать почищенный картофель, положить его в сосуд с водой. Дать немного настояться и поместить серебро в сосуд с картофелем и водой на 1 час. После очистки серебра этими способами нужно промыть его и вытереть насухо.
Определение подлинности серебра. Если нет специального клейма на предполагаемом серебряном изделии, то есть надежные способы ;как отличить серебро. Например, если поднести к изделию магнит, то серебро к нему не должно прилипнуть. Но такой способ не совсем надежный, так как имеются и другие металлы, на которые магнит не действует.
Более надежно покрытие изделия (или его части) аптечной серной мазью, йодом или мелом. Если образец почернеет, то он является серебром и ничем иным.
Источник: uznay-kak.ru
главная > справочник > химическая энциклопедия:
Свойства. Серебро — белый блестящий металл, в тонких пленках и проходящем свете — голубого цвета. Кристаллизуется в гранецентрированной кубической решетке, а = 0,4086 нм, z = 4, пространственная группа Fm 3 m ; т. пл. 961,93 °С, т. кип.
2167°С; плотность 10,491 г/см 3 ;  25,36 Дж/(моль•К); D H пл 11,30 кДж/моль, D H исп 251,5 кДж/моль;
25,36 Дж/(моль•К); D H пл 11,30 кДж/моль, D H исп 251,5 кДж/моль; 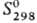 42,55 Дж/(моль•К); уравнения температурной зависимости давления пара над жидким серебро lg p (aтм) = -1,368•10 4 / Т+ 5.615, плотность жидкого серебра d = = 10,465 — 9,67•10 -4 Т г/см 3 ; t крит 4395°С, p крит 33,6 МПа и u крит 339 см 3 /моль. Серебро обладает наибольшей теплопроводностью и электрической проводимостью: r 1,59 (0°С) и 8,4 мкОм•см (960 °С), теплопроводность 419 (293 К) и 377 Вт/(м•К) при 773 К. Примеси в серебро уменьшают его теплопроводность и электрическую проводимость. Серебро диамагнитно, его магнитная восприимчивость (–0,181•10 -9 ) не зависит от температуры; коэффициент Холла –0,9•10 10 . серебро обладает высокой отражательной способностью: в ИК диапазоне степень отражения лучей составляет 98%, в видимой области спектра-95% и снижается до 10% при длине волны 320 нм. Серебро — мягкий и пластичный металл; предел текучести составляет 10-50 МПа; твердость по Бринеллю 245-250 МПа, по Виккерсу 148-154 МПа; модуль упругости 82,7 ГПа, модуль сдвига 30,3 ГПа.
42,55 Дж/(моль•К); уравнения температурной зависимости давления пара над жидким серебро lg p (aтм) = -1,368•10 4 / Т+ 5.615, плотность жидкого серебра d = = 10,465 — 9,67•10 -4 Т г/см 3 ; t крит 4395°С, p крит 33,6 МПа и u крит 339 см 3 /моль. Серебро обладает наибольшей теплопроводностью и электрической проводимостью: r 1,59 (0°С) и 8,4 мкОм•см (960 °С), теплопроводность 419 (293 К) и 377 Вт/(м•К) при 773 К. Примеси в серебро уменьшают его теплопроводность и электрическую проводимость. Серебро диамагнитно, его магнитная восприимчивость (–0,181•10 -9 ) не зависит от температуры; коэффициент Холла –0,9•10 10 . серебро обладает высокой отражательной способностью: в ИК диапазоне степень отражения лучей составляет 98%, в видимой области спектра-95% и снижается до 10% при длине волны 320 нм. Серебро — мягкий и пластичный металл; предел текучести составляет 10-50 МПа; твердость по Бринеллю 245-250 МПа, по Виккерсу 148-154 МПа; модуль упругости 82,7 ГПа, модуль сдвига 30,3 ГПа.
Из благородных металлов серебро-наиболее реакционноспособно. Тем не менее, серебро химически мало активно и легко вытесняется из своих соединений более активными металлами. Углем, Н 2 и другими восстановителями ионы серебро восстанавливаются до Ag 0 . Стандартный электродный потенциал Ag + /Ag 0 0,799 В. При комнатной температуре серебро не взаимодействует с О 2 воздуха, но при нагревании до 170°С покрывается пленкой оксида Ag 2 O. Озон в присутствии влаги окисляет серебро до высших оксидов — Ag 2 O 2 и Ag 2 O 3 . При взаимодействии нагретого серебра с S или Н 2 S в присутствии О 2 образуется серебра сульфид Ag 2 S. Халькогены. фосфор. мышьяк и углерод реагируют с нагретым серебро с образованием соответствующих бинарных соединений. Серебро легко растворяется в разбавленной и концентрированной HNO 3 с образованием серебра нитрата AgNO 3 . При нагревании Ag растворяется и в концентрированной H 2 SO 4 , давая сульфат Ag 2 SO 4 . Галогены в присутствии влаги, а также концированные галогеноводородные кислоты медленно реагируют с металлическим серебро, давая серебра галогениды AgX. В присутствии О 2 серебро легко растворимо в растворах цианидов щелочных металлов с образованием комплексных цианидов M 1 [Ag(CN) 2 ]. Расплавленные щелочи и орг. кислоты не действуют на металлическое серебро
Известны многочисленные комплексные соединения серебро, в которых координац. число серебро равно 2, 3 и 4.
Большинство соединений Ag(I) плохо растворимо в воде, за исключением AgF, AgNO 3 , AgClO 4 и AgClO 3 . Соли серебра — бесцветные или слегка желтоватые вещества. На свету почти все соединения Ag(I) разлагаются до свободного серебро и при этом окрашиваются в серый или черный цвет, что используется в фотографии. Соединения серебра термодинамически мало устойчивы, причем углерод- и азотсодержащие соединения Ag(I) способны к разложению со взрывом.

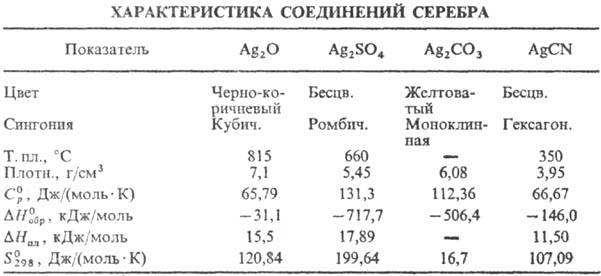
Оксид Ag(I) (гемиоксид) Ag 2 O при нагревании выше 100°С разлагается до Ag и О 2 ; растворимость в воде 1,3•10 3 г в 100 г воды (см. также табл.); водные растворы Ag 2 O имеют щелочную реакцию вследствие частичного образования AgOH; в водной суспензии легко восстанавливается до металлического серебро водородом, СО, металлами и др. восстановителями; растворимы в кислотах, водном NH 3 , цианидах и тиосульфатах щелочных металлов с образованием соответствующих простых и комплексных солей Ag(I); теряет на свету О 2 ; диамагнитен; получают при обработке раствора AgNO 3 щелочами, применяют в гопкалитовых патронах противогазов. как окислитель в органическом синтезе; водные растворы — антисептическое средство. Монооксид Ag 2 O 2 (или Ag I Ag III O 2 ) — серые кристаллы моноклинной сингонии; разлагается выше 100 °С; —24,7 кДж/моль; получают окислением серебро или Ag 2 О озоном, анодным окислением серебро, используют для изготовления электродов в серебряно-цинковых элементах и аккумуляторах.
Гидроксид AgOH, по непроверенным сведениям, может быть получен в виде неустойчивого белого осадка при обработке раствора AgNO 3 в этаноле спиртовым раствором КОН при — 45 °С; обладает амфотерными свойствами с преобладанием диссоциации по щелочному типу; для бесконечно разбавленных растворов 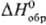 -124,36 кДж/моль,
-124,36 кДж/моль, 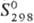 61,70 Дж/(моль • К).
61,70 Дж/(моль • К).
Сульфат Ag 2 SO 4 при 427°С переходит из ромбической α-модификации в гексагональную β-модификацию, D H перехода 18,64 кДж/моль; выше 1100°С разлагается до Ag, SO 2 и О 2 ; растворимость в воде 0,8 г в 100 г при 20°С; в сернокислотных растворах легко восстанавливается FeSO 4 , Zn и Mg до Ag 0 ; получают действием концентрированной H 2 SO 4 на Ag или Ag 2 O или обменной реакцией растворимых солей серебро с сульфатами металлов, в избытке H 2 SO 4 образуются гидросульфат AgHSO 4 и аддукты Ag 2 SO 4 c H 2 SO 4 .
Карбонат Ag 2 СО 3 выше 120 °С разлагается до Ag, CO 2 и О 2 ; растворимость в воде 3•10 -3 г в 100 г, растворяется в водном NH 3 , цианидах и тиосульфатах щелочных металлов. с карбонатами др. металлов образует двойные карбонаты; получают действием растворов карбонатов или гидрокарбонатов металлов на AgNO 3 .
Цианид AgCN практически не растворяется в воде (2•10 -5 г в 100 г), в водном растворе с избытком KCN образует комплексный цианоаргентат K[Ag(CN) 2 ], при действии кислот на цианоаргентаты выделяется синильная кислота HCN; получают действием растворов KCN или NaCN на стехиометрическое количество AgNO 3 ; компонент электролитов при гальванич. серебрении, применяют также в производстве нитрилов и изо-нитрилов; ПДК 0,3 мг/м 3 (в пересчете на HCN).
Специфическое химическое свойство серебра — способность легко образовывать коллоидное серебро в растворе при восстановлении соединений серебро или при диспергировании компактного металла. Золи серебро окрашены в различные цвета — от фиолетового до оранжевого—в зависимости от размера частиц металла и способа получения золя. серебро в коллоидном состоянии — энергичный восстановитель, катализатор окисления, бактерицидный препарат (колларгол, протаргол). Бактерицидные свойства присущи и металлическому серебро: при концентрации серебро в растворе 40-200 мкг/л погибают неспоровые бактерии, а при более высоких концентрациях — споровые.
серебро хорошо адсорбирует газы, такие, как Н 2 , О 2 , Аr и др. Так, при 500 °С Ag может поглощать до 5 объемов О 2 . При охлаждении жидкого серебро, содержащего растворенный в нем О 2 , выделение газа может происходить со взрывом.
серебро образует множество интерметаллидов и сплавов с др. металлами. Так, с Pd и Аu серебро дает непрерывный ряд твердых растворов, с Сu, Ni и Pb-эвтектические сплавы, а с остальными металлами — интерметаллиды различного состава. Введение металлов в серебро часто улучшает его механические и химические свойства.
Получение. Первая стадия переработки всех серебросодержащих руд — флотационное и гравитационное обогащение. Дальнейшие методы выделения серебра зависят от типа руды и содержания серебро и делятся на пирометаллургические и гидрометаллургические.
Полиметаллические сульфидные руды не поддаются прямой гидрометаллургической переработке и их вначале подвергают обжигу — окислительному, восстановительному (или хлорирующему). При обжиге свинцовых руд Ag 2 S концентрируется в оксиде Рb и затем в металлическом Рb. Для выделения серебро из Рb применяют методы Паркеса и Паттинсона. По методу Паркеса серебросодержащий Рb плавят вместе с Zn и серебро концентрируется в Zn в виде интерметаллидов. После отгонки Zn остаток купелируют (нагревают в печи в потоке воздуха. и отделяют сырое металлическое серебро от оксидов остальных металлов.
При переработке медных руд после окислительных и восстановительных плавок получают сплавы Сu с Ag, из которых серебро выделяют электролизом. Из сплава отливают аноды и при их растворении Си осаждается на катоде, а серебро концентрируется в шламе.
Собственно серебряные руды перерабатывают после обогащения методом цианирования, для чего руду обрабатывают в водном растворе NaCN или KCN в присутствии О 2 и затем серебро извлекают из комплексных цианидов восстановлением металлами или с использованием анионитов. В основном история, интерес представляет сейчас амальгамный метод извлечения серебро, по которому руда смешивается в растворе с Hg и хлоридами, при этом образуется амальгама серебро; из нее после отгонки Hg получают сырое серебро
Для получения серебро высокой чистоты (99,999%) сырой металл подвергают электролитическому аффинажу в растворе AgNO 3 с осаждением серебра на катоде (примеси переходят в шлам).
Все серебросодержащие отходы промышленности (отработанные фотоматериалы, контакты, источники питания и т. п.) также подвергаются переработке с целью извлечения вторичного серебро, которое вновь расходуется в промышленности в кол-ве 60-70% от общего потребления серебро
Определение. Качественно серебро обнаруживают по цветным реакциям образования комплексов серебро с использованием орг. N- и S-содержащих реагентов (производные роданина, фенилтиомочевины, дитизона и т.п.). Применяют также восстановление серебро из раствора до металла и микрокристаллич. реакции образования AgCl, Ag 2 Cr 2 O 7 и комплекса серебро с уротропином.
Количественно серебро определяют гравиметрически (осаждение серебро в виде AgCl или комплекса серебро с бензотриазолом), титриметрически по Фольгарду с использованием растворов KCNS или NH 4 CNS в присутствии железо-аммониевых квасцов. Применяют колориметрические методы с использованием производных роданина и дитизона, каталиметрические (основанные на измерении скорости реакции в присутствии микроколичеств серебро), а также эмиссионно-спектральный и атомно-абсорбционный методы анализа.
Применение. Примерно 30-40% производимого серебро расходуют на изготовление кино- и фотоматериалов. Около 20% сереброа в виде сплавов с Pd, Аu, Сu, Zn и др. металлами идет на изготовление контактов, припоев, проводящих слоев, элементов реле и других устройств в электротехнике и электронике.
Сплавы серебра с Аu и Сu, а также с Hg, Sn, Zn и Си используют в стоматологии для пломбирования и протезирования. 20-25% Серебра расходуют на изготовление элементов питания — серебряно-цинковых аккумуляторов, обладающих высокой энергоемкостью (космическая и оборонная техника), оксидно-серебряных элементов питания часов и т.п. Из серебро изготовляют монеты, ювелирные изделия, украшения, столовую посуду. Серебро используют для серебрения зеркал, аппаратов в пищевой промышленности, как катализатор процессов дожигания СО, восстановления NO и реакций окисления в органическом синтезе.
Объем производства первичного серебра в мире колеблется в зависимости от цен на рынке. В связи с тем, что серебро-второй валютный металл, сведения о масштабах его произ-ва и потребления являются оценочными. В сер. 80-х гг. производство первичного серебро в развитых и развивающихся странах оценивалось в 10-15 тысяч т/год.
ПДК серебро в воздухе 0,1-0,5 мг/м 3 . При попадании растворимых соединений серебро на кожу и слизистые оболочки происходит восстановление серебро до серо-черного коллоидного металла. Это окрашивание поверхности тканей (аргирия) исчезает в результате растворения и истирания коллоидного серебро вместе с кожей.
серебро известно человеку с древнейших времен, еще в 4-м тысячелетии до н.э. Оно использовалось для изготовления украшений, служило торговым эквивалентом в странах Востока.
Лит.: Пятницкий И. В., Сухан В. В., Аналитическая химия серебра, М., 1975; Малышев В.М., Румянцев Д. В., Серебро, 2 изд., М., 1987; Silver. Economics, metallurgy and use, Princeton (N.Y.), 1967; Thompson N. R., в кн.: Masscy A. G., The chemistry of cooper, Oxf., 1975. П.М. Чукуров.
Источник: www.chemport.ru