К щелочным металлам относятся металлы IA группы Периодической системы Д.И. Менделеева – литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). На внешнем энергетическом уровне щелочных металлов находится один валентный электрон. Электронная конфигурация внешнего энергетического уровня щелочных металлов – ns 1 . В своих соединениях они проявляют единственную степень окисления равную +1. В ОВР являются восстановителями, т.е. отдают электрон.
Физические свойства щелочных металлов
Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).
В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
Щелочные металлы
Щелочные металлы обладают высокой тепло- и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки
Получение щелочных металлов
Все щелочные металлы возможно получить электролизом расплава их солей, однако на практике таким способом получают только Li и Na, что связано с высокой химической активностью K, Rb, Cs:
2MeCl + Ca = 2Mе↑ + CaCl2,
Известен способ получения лития из его оксида. Реакцию проводят при нагревании до 300°С и под вакуумом:
Получение калия возможно по реакции между расплавленным гидроксидом калия и жидким натрием. Реакцию проводят при нагревании до 440°С:
KOH + Na = K + NaOH
Химические свойства щелочных металлов
Все щелочные металлы активно взаимодействуют с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий. Уравнение реакции в общем виде:
Щелочные металлы взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
Все щелочные металлы при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.). Например:
Щелочные металлы способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
Взаимодействие щелочных металлов с солями происходит по следующему принципу –вытесняют менее активные металлы (см. ряд активности металлов) из их солей:
3Na + AlCl3 = 3NaCl + Al
Взаимодействие щелочных металлов с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
Щелочные металлы. Видеоурок 14. Химия 9 класс
Щелочные металлы реагируют с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
Качественные реакции
Качественной реакцией на щелочные металлы является окрашивание пламени их катионами: Li + окрашивает пламя в красный цвет, Na + — в желтый, а K + , Rb + , Cs + — в фиолетовый.
Примеры решения задач
| Задание | Осуществите химические превращения Na→Na2O→NaOH→Na2SO4 |
| Решение | 4Na + O2→2Na2O |
| Задание | При электролизе расплава хлорида натрия на аноде выделилось 6,4 л хлора. Сколько граммов натрия выделилось на катоде? |
| Решение | Запишем уравнение реакции: |
Найдем количество вещества хлора:
Исходя из уравнения реакции, количество вещества натрия равно:
v(Na) = 0,3/2 =0,15 моль
Найдем массу натрия, выделившегося на катоде:
m(Na) = 0,15×23 = 3,45г
Источник: ru.solverbook.com
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
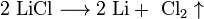
катод: Li + + e → Li
анод: 2Cl − — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
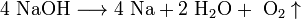
катод: Na + + e → Na
3. Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:
Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием из хромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка. [ источник не указан 401 день ]
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
35. Соли щелочных металлов
Из-за высокой химической активности щелочные металлы встречаются на Земле исключительно в виде соединений, главным образом солей. Литий является редким элементом. Он входит в состав некоторых алюмосиликатов (в частности, сподумена
Li2O•Аl2О3•4SiO2), а также в форме хлорида LiСl присутствует в морской воде, подземных водах, водах соляных озёр. Рубидий и цезий встречаются в виде примесей к алюмосиликатам, содержащим калий.
галит (поваренная соль) NaCl, сильвин КСl, сильвинит КС1•NaCl, знакомы людям с глубокой древности. Из морской воды кристаллизуется также мирабилит (или глауберова соль) Na2SO4•10Н2О. Большинство солей щелочных металлов хорошо растворимы в воде; исключение составляют лишь соединения лития, а также соли некоторых кислот, например хлорной КСlО4.
Интересно, что многие соли лития выделяются из растворов в виде кристаллогидратов, тогда как для солей тяжёлых щелочных металлов (например, цезия или даже калия) кристаллогидраты оказываются неустойчивыми. Это связано с последовательным увеличением ионного радиуса катиона при движении вниз по подгруппе. Чем больше радиус иона, тем ниже плотность заряда на его поверхности и тем сложнее иону удерживать молекулы воды. Вот почему соли калия менее гигроскопичны, чем аналогичные соли натрия. По этой причине в
пиротехнике и при производстве пороха предпочитают использовать калийную селитру, а не натриевую: она меньше отсыревает.
Среди соединений натрия важная роль принадлежит карбонату, или соде. Безводный средний карбонат натрия Na2CO3 называют кальцинированной содой, десятиводный кристаллогидрат Na2CO3•10H2O — стиральной содой, а гидрокарбонат NaHCO3— питьевой (или пищевой) содой.
Растворы среднего карбоната Na2CO3 имеют сильнощелочную реакцию среды, их используют при стирке белья и при обработке шерсти. Кроме того, кальцинированная сода находит широкое применение в производстве стекла, мыла, сульфита натрия, органических красителей. Растворы гидрокарбоната имеют слабощелочную реакцию среды, поэтому питьевую соду используют в медицине (например, для полоскания горла), а также при приготовлении пищи.
Гидрокси́ды (гидроо́киси) — соединения оксидов химических элементов с водой. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами.
Источник: studfile.net
Щелочные металлы


С детства мы знаем, что существуют металлы и неметаллы. Металлы – это твердые вещества, обладающие металлическим блеском, проводящие электрический ток и тепло. Они ковкие, благодаря чему металлические изделия можно использовать во вторичном производстве. Но, оказывается, как химические элементы, металлы сильно отличаются друг от друга.
Существуют такие металлы, которые нельзя брать в руки и мочить, потому что это может привести к травмам и серьезным ожогам. О таких металлах поговорим в этой статье.


План урока:
Представители щелочных металлов
Щелочные металлы – это группа высокоактивных металлов. Название происходит от продукта взаимодействия этих веществ с водой, в результате которой образуется щелочь (сложное химическое соединение). Найти в природе такие металлы, сделать из них изделие или просто хранить в виде слитка невозможно. Эти металлы сразу окисляются кислородом воздуха.
К щелочным металлам относятся: литий, натрий, калий, рубидий, цезий, франций.
Строение атомов щелочных металлов
В таблице Менделеева щелочные металлы расположены в первой группе. Такое положение не случайно, а отражает строение атома и химические свойства.
Химические свойства элементов напрямую зависят от строения атома. Атом любого элемента состоят из ядра, имеющего положительный заряд и электронов, образующих энергетически облака вокруг ядра.
Ядро и электроны притягиваются за счет электростатического напряжения. Соответственно, чем меньше у электрона силы сопротивления, тем ближе он будет к ядру. Электроны с большей энергией способны отдаляться на периферию атома.

По мере смены периодом, количество электронов и энергетических уровней будет увеличиваться. Общий параметр атомов всех щелочных металлов является 1 электрон на внешнем энергетическом уровне.
Изменение химических свойств щелочных металлов
По мере продвижения от первого до последнего периода, в атомах щелочных металлов происходит увеличение количества атомов и электронных облаков. Чем дальше атом оказался от ядра, тем меньше притяжение между ними. За счет этого, отдаленный (последний) электрон проще отсоединить от атома. Легкость отщепления электронов определяет реакционную способность. Отщепление электрона приводит к окислению собственного атома и восстановлению окислителя.
Таким образом, восстановительные свойства щелочных металлов увеличиваются сверху вниз в группе. Самый активный металл – цезий.
Внешний вид и физические свойства щелочных металлов
Щелочные металлы обладают всеми характерными свойствами: серебристый цвет (исключение: цезий – золотистого цвета) металлический блеск, электро- и теплопроводность, ковкость, пластичность.
Особенным качеством является мягкость и легкость за счет низкой плотности вещества. Эти металлы можно резать ножом, разминать руками (в перчатках) и ломать.

Нахождение в природе щелочных металлов
Из-за высокой реакционной активности, щелочные металлы не встречаются в природе в виде самородков или чистых залежей. Обнаружить их можно в составе солей. Многие природные минералы содержат ион щелочного металла в своей структуре.
Таблица. Минералы, в состав которых входят ионы щелочных металлов

Обнаружение ионов металлов в соединениях
Самый простой способ определения иона металла – окраска пламени. Для соли каждого металла характерен свой цвет:
- Литий – красный,
- Калий – фиолетовый,
- Натрий – желтый,
- Рубидий – розовый,
- Цезий – синий.
Соли франция такой проверке не подвергаются.

Для такой проверки важно, чтобы в пламени не было других примесей, меняющий цвет, иначе проверка будет недостоверна.
Качественные реакции
Обнаружение катионов лития
Обнаружить ионы металлов в соли можно с помощью качественной реакции.

Для обнаружения катионов лития используют фосфорную кислоту. Получившийся белый фосфат лития растворим только в концентрированной азотной кислоте и солях аммония:
В растворимых солях литий можно обнаружить с помощью фторида аммония. При реакции образуется белый нерастворимый осадок фторида лития:
Обнаружение катиона натрия
Ионы натрия можно обнаружить реакцией с комплексной солью гексагидроксостибатом (V). При низких температурах и в нейтральной среде образуется мелкокристаллическая белая соль натрия:
Эту реакцию проводят на предметном стекле. За образованием и формой кристаллов наблюдают под микроскопом или бинокуляром.
Обнаружение катиона калия
В кислой и нейтральной среде ионы калия образуют двойную комплексную соль с гексанитрокабальтатом натрия (III). Эта соль нерастворима в воде и имеет желтый цвет:
Особенность реакции в ее медленном течении. Реакционную смесь оставляют на несколько часов. Для ускорения реакции можно тереть стеклянной палочкой по стенке пробирки. Это приводит к формированию статического электричества, что усиливает притяжение ионов друг к другу.
Еще одним способом обнаружения катионов калия служит реакция с гидротартратом натрия NaHC4H4O6. В этом случае образуется соль белого цвета. Реакцию можно ускорить потиранием стеклянной палочной о поверхность пробирки:
Обнаружение катионов рубидия, цезия
Катионы рубидия и цезия – высокоактивные ионы, поэтому не обнаруживаются качественными реакциями. Все соединения прозрачные и хорошо растворимы в воде. Основными способами их обнаружения в составе соли служит осаждение органическими ароматическими растворами. Способа разделения цезия и рубидия из смеси в настоящее время нет.
Обнаружение ионов франция
Как радиоактивный металл, франций не входит в состав обычных солей. Его обнаружение проводится методом спектрометрии и радиационных приборов.
Химические свойства щелочных металлов
Все металлы являются восстановителями, поэтому они вступают в реакцию с различными окислителями. К таким относятся простые неметаллы и сложные соединения, обладающие окислительными свойствами.
Реакция с простыми неметаллами
Щелочные металлы активно вступают в реакции с галогенами. При этом образуется соответствующий галогенид. С серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов реагируют только при нагревании:
В реакции с кислородом щелочные металлы образуют пероксиды (кроме лития), повторное окисление которых приводит к образованию оксидов:
Специальных условий для окисления металлов кислородом не требуется, поэтому щелочные металлы хранят под слоем парафина, вазелина или масла без доступа кислорода.

Взаимодействие с водой
Реакция щелочных металлов с водой происходит с выделением большого количества тепла. Выделяющийся в ходе реакции водород может воспламеняться, что в некоторых случаях приводит к взрыву.

Взаимодействие с сильными кислотами
В реакциях щелочных металлов с кислотами образуются соответствующие соли. Особенных проявлений свойств щелочных металлов здесь нет:
Специфические химические свойства лития
В некоторых реакциях литий проявляет отличные от остальных щелочных металлов свойства. Например, это единственный металл, реагирующий с азотом без нагревания:
Нитрид лития подвергается необратимому гидролизу.
В реакции с лития с кислородом образуется оксид лития:
Получение щелочных металлов
Получить щелочные металлы в чистом виде можно только электролизом расплавов их солей:

катод (–) (Na + ): Na + + е = Na 0 ,
анод (–) (Cl – ): Cl – – е = Cl 0 , 2Cl 0 = Cl2;
Если использовать раствор соли, катионы металла будут сразу вступать в реакцию с образованием щелочей:
катод (–) (Na + ; Н + ): H + + е = H 0 , 2H 0 = H2
анод (+) (Cl – ; OН – ): Cl – – е = Cl 0 , 2Cl 0 = Cl2;
Применение соединений щелочных металлов
Основные области применения данных солей – медицина, кулинария, строительство, химическая промышленность.
Наиболее используемый щелочной металл – натрий. Он служит катализатором синтеза металлов, служит теплоносителем в атомных реакторах.
Хлорид натрия – соединение, используемое в каждом доме. Это безопасная соль, используемая в кулинарии. Так же, хлорид натрия применяется в медицине для приготовления физиологических растворов.

Литий и его щелочи служат основой изготовления щелочных батареек. Длительное время это был единственный способ создания портативных энергоносителей.
Калий и натрий используются для изготовления мыла в качестве омыляющего компонента.
Соли калия используются в сельском хозяйстве в качестве удобрения.
Калий, рубидий и натрий используются в атомной промышленности и атомной энергетике. Эти металлы служат катализаторами многих реакций.
Литий добавляется во многие сплавы для улучшения металлических свойств.
Соединения лития, рубидия и цезия используют при изготовлении цветных стекол.
Франций пока не имеет практического применения в связи с высокой радиоактивностью.
Источник: 100urokov.ru