Приборы и реактивы: стеклянные пробирки; водяная баня; стеклянные стаканы на 50 и 100 мл.
Растворы: сероводородной воды; гидроксида натрия (2 н. ); гидроксида аммония (2 н.; 25%-й); азотной кислоты (2 н. ); иодида калия (0, 1 н. ); тиосульфата натрия (0, 5 н. ); нитрата серебра (0, 1 н. ); хлорида олова (II) (0, 5 н. ); глюкозы (10%-й); хлорида калия (0, 5 н. ); бромида калия (0, 5 н. ); сульфита натрия (0, 5 н. ); хромата калия (0, 5 н. ).
Опыт 1. Получение оксида серебра
Выполнение работы. В пробирку с раствором нитрата серебра (3–4 кап-ли) прибавить несколько капель 2 н. раствора гидроксида натрия до выпадения осадка оксида серебра. Осадок Ag2O сохранить для опыта 3Б.
Запись данных опыта. Какое заключение о прочности гидроксида серебра можно сделать на основании этого опыта? Чем это объясняется? Написать уравнения реакций образования гидроксида серебра и его распада.
Опыт 2. Окислительные свойства оксида серебра
А. Взаимодействие оксида серебра с хлоридом олова (II) в щелочной среде
Получение СЕРЕБРА. Реакция НИТРАТА СЕРЕБРА, ПЕРЕКИСИ ВОДОРОДА и ГИДРОКСИДА НАТРИЯ. Опыты по химии.
Выполнение работы. Внести в пробирку 2–3 капли раствора хлорида олова (II) и добавить по каплям 2 н. раствор гидроксида натрия до растворения выпавшего вначале осадка гидроксида олова (II). К полученному щелочному раствору Na2[Sn(OH)4] прибавить 1–2 капли раствора нитрата серебра. Наблюдать выпадение черного порошка металлического серебра.
Образование серебра может быть доказано тем, что выпавший осадок не растворяется при добавлении 5–6 капель 2 н. раствора гидроксида аммония в отличие от оксида серебра. Проверить опытным путем.
Запись данных опыта. Написать уравнения реакций:
а) образования тетрагидроксостанната (II) натрия из хлорида олова (II);
б) взаимодействия нитрата серебра со щелочью;
в) взаимодействия тетрагидроксостанната (II) натрия с оксидом серебра с образованием гексагидроксостанната (IV) натрия и элементного серебра, учитывая, что в реакции принимает участие вода;
г) общее уравнение реакции взаимодействия хлорида олова (II) с оксидом серебра в присутствии щелочи.
Б. Получение серебряного зеркала
Выполнение работы. В стеклянном стакане нагреть до кипения 25–50 мл воды, после чего отставить горелку. В пробирку внести 4–5 капель раствора нитрата серебра и прибавить 2–5 капель 2 н. раствора гидроксида аммония, встряхивая пробирку после прибавления каждой капли до растворения выпавшего вначале осадка Ag2O (избегать избытка NH3).
К полученному прозрачному раствору прибавить 10%-й раствор глюкозы С5Н6(ОН)5СНО в объеме, равном суммарному объему нитрата серебра и гидроксида аммония, находящихся в пробирке. Перемешать раствор и поставить пробирку в стаканчик с горячей водой. Через 2–3 минуты вынуть пробирку из стаканчика и, вылив раствор, ополоснуть ее водой из промывалки. Какое вещество выделилось из раствора на стенках пробирки? Написать уравнение реакции, считая, что глюкоза переходит в глюконовую кислоту С5Н6(ОН)5СООН.
Опыт 3. Малорастворимые и комплексные соединения серебра
Опыт СЕРЕБРЯНОЕ ЗЕРКАЛО. Реакция ФОРМАЛИНА, НИТРАТА СЕРЕБРА и АММИАКА. Получение СЕРЕБРА Ag. Опыты
А. Получение амминокомплексов серебра (I)
Выполнение работы. В 4 пробирки внести по 2 капли раствора нитрата серебра. В одну пробирку добавить 2 капли хлорида калия, во вторую – бромида калия, в третью – иодида калия, в четвертую – хромата калия К2СrO4. Отметить цвет выпавших осадков. Добавить во все четыре пробирки по 3 капли 25%-го раствора гидроксида аммония.
Осадки каких веществ практически полностью растворились в гидроксида аммония? Одинаково ли активно идет взаимодействие хлорида, бромида и иодида серебра с гидроксидом аммония?
Запись данных опыта. Написать в молекулярном и ионном виде уравнения реакций:
а) образования малорастворимых солей серебра;
б) образованием комплексных соединений, учитывая, что координа-ционное число иона Ag + равно 2. На основании своих наблюдений и значений произведений растворимости галогенидов серебра объяснить различие их растворимости в гидроксиде аммония.
Б. Получение комплексного основания серебра
Выполнение работы. К осадку оксида серебра, полученному в опыте 1, прибавлять по каплям 2 н. раствор гидроксида аммония. Наблюдать раство-рение осадка вследствие образования растворимого комплексного основания серебра. Написать уравнение протекающей реакции.
Опыт 4. Контрольный
Запись данных опыта, Описать все наблюдения. Написать уравнения реакций:
а) получения хлорида серебра и растворения его в гидроксиде аммония;
б) взаимодействия хлорида диамминсеребра с азотной кислотой, учитывая, что при этом образуется комплексный ион NH4 + , более прочный, чем аммиачно-серебряный комплекс;
в) взаимодействия хлорида диамминсеребра с иодидом калия, принимая во внимание, что вследствие малого значения ПРAgI иодид серебра, в отличие от хлорида, нерастворим в аммиачных растворах;
г) взаимодействия хлорида диамминсеребра с сероводородной водой с образованием очень мало растворимого сульфида серебра Ag2S.
Источник: megalektsii.ru
Большая Энциклопедия Нефти и Газа
Аммиачный раствор нитрата серебра — к 5 % — ному раствору AgNO3 добавляют концентрированный раствор NHS до растворения выпадающего осадка. Орциновый реактив — 1 г орцина растворяют в 500 мл 30 % — ного раствора НС1 и добавляют 4 — 5 мл 10 % — ного раствора FeCl3, реактив хранят в темной плотнозакупоренной склянке. Молибденовый реактив — 7 5 г ( NH4) eMo7O24 растворяют в 100 мл 32 % — ного раствора HNOS. Магнезиальная смесь — 3 5 г MgCl2, 1 8 г МН4С1 и 2 мл 25 % — ного раствора NHS доводят водой до объема 100 мл. [1]
Аммиачные растворы нитрата серебра немедленно после реакции вылить в соляную кислоту ( специальная склянка для отходов серебра у лаборанта); посуду обмыть водой, так как при стоянии образуется чрезвычайно взрывчатое гремучее серебро, взрывающееся без всяких причин. [2]
Аммиачный раствор нитрата серебра и фелинго-ву жидкость используют для обнаружения альдегидов; спирты и кетоны их не восстанавливают. Необходимо, однако, иметь в виду, что кетозы восстанавливают фелингову жидкость аналогично альдозам, поскольку в щелочной среде они легко изомеризуются в альдозы, а частично подвергаются деструкции в низшие альдозы. [3]
Аммиачные растворы нитрата серебра немедленно после реакции вылить в соляную кислоту ( специальная склянка для отходов серебра у лаборанта); посуду обмыть водой, так как при стоянии образуется чрезвычайно взрывчатое гремучее серебро, взрывающееся без всяких причин. [4]
Аммиачный раствор нитрата серебра также действует как слабый окислитель и дает с различными веществами ( восстанавливающие соединения, фенольные соединения, многие серу-содержащие соединения и др.) пятна от оранжевого до черного цвета. Концентрированная серная кислота образует окрашенные и флуоресцирующие пятна с различными соединениями, но она разрушает бумагу, и поэтому перед опрыскиванием хрома-тограмму необходимо поместить на стеклянную пластинку, а в некоторых случаях закрыть ее другой стеклянной пластинкой. [5]
Аммиачный раствор нитрата серебра окисляет при нагревании соли церия ( III) до гидроокиси церия ( IV); образующееся тонкодисперсное металлическое серебро окрашивает объемистый осадок в черный цвет. Таким путем обнаруживают ионы Се3 в присутствии ионов других лантанидов. [6]
Аммиачный раствор нитрата серебра готовят следующим образом: 5 г AgNO3 взвешивают с точностью до 0 001 г и растворяют в 100 мл дистиллированной воды, к раствору приливают по каплям при постоянном помешивании 10 % — ный раствор аммиака, пока осадок не будет почти ( но не полностью) растворен; раствор фильтруют и хранят в хорошо закупоренных склянках из темного стекла, в затемненном месте. [7]
Из аммиачного раствора нитрата серебра ацетилен выделяет желтоватый осадок ацетиленистого серебра ( М. В. Нифонтова); из аммиачного раствора нитрата меди ацетилен выделяет красную ацетиленистую медь. Последняя реакция очень чувствительна, ее применяют для количественного определения ацетилена в воздухе. [8]
Восстановление аммиачного раствора нитрата серебра , приводящее к выпадению черного осадка серебра или образованию серебряного зеркала. [9]
В аммиачном растворе нитрата серебра карбонильная группа альдегида окисляется до карбоксильной; при этом выделяется эквивалентное количество металлического серебра. [10]
Гваякол восстанавливает аммиачный раствор нитрата серебра , особенно при нагревании. [11]
Серпинин восстанавливает аммиачный раствор нитрата серебра . С концентрированной азотной кислотой и сульфатом церия дает светло-красное окрашивание. [12]
Бутин-1 осаждают аммиачным раствором нитрата серебра ; б) па-продуктам окисления; в) дифенилацетилен обесцвечивает бромную воду. [13]
Алкин осадить аммиачным раствором нитрата серебра , отфильтровать осадок, фильтрат обработать бромом ( алкен превратится в более высококипящее соединение) и отогнать алкзн. [14]
Обнаруживающим реактивом служил аммиачный раствор нитрата серебра . [15]
Источник: www.ngpedia.ru
8*. При постепенном приливании водного раствора аммиака к раствору нитрата серебра (I) вначале выпал осадок . цвета, который затем растворился, образовав так называемый «аммиачный раствор оксида серебра». Напишите уравнения происходящих реакций.
Раствор аммиака — это раствор основания (хотя и слабого). Поэтому из водных растворов солей он осаждает нерастворимые основания. Однако, как указывается в параграфе, гидроксид серебра совершенно неустойчив и разлагается в момент образования, выделяя воду. Поэтому в осадок выпадает оксид серебра:
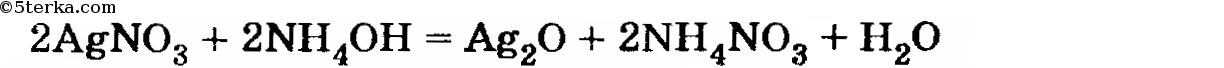
В избытке раствора аммиака образуется гидроксид (а не «оксид») диамминсеребра:
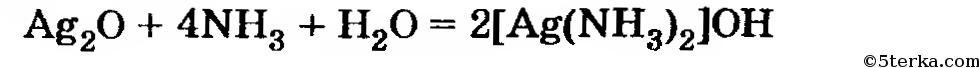
Источник:
Решебник по химии за 10 класс (Л.С. Гузей, Р.П. Суровцева, 1999 год),
задача №8
к главе «Задачи к § 29.2».
Источник: 5terka.com