Как кислотный оксид при взаимодействии с водой образует фосфористую кислоту:
Но при растворении в горячей воде происходит очень бурная реакция диспропорционирования Р2О3:
Взаимодействие Р2О3 со щелочами приводит к образованию солей фосфористой кислоты:
Р2О3 — очень сильный восстановитель
1. Окисление кислородом воздуха:
2. Окисление галогенами:
Р2О5 — оксид фосфора (V)
При обычной температуре — белая снегоподобная масса, не имеет запаха, существует в виде димеров Р4О10. При соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Способ получения
Фосфорный ангидрид образуется в результате сжигания фосфора в избытке воздуха:
Химические свойства
Р2О5 — типичный кислотный оксид
Как кислотный оксид Р2О5 взаимодействует:
а) с водой, образуя при этом различные кислоты
Мясной факт №4. Как правильно проводить пересчет содержания оксида фосфора в фосфатных смесях ?
б) с основными оксидами, образуя фосфаты Р2О5 + ЗВаО = Ва3(PO4)2
в) со щелочами, образуя средние и кислые соли
Р2О5 — водоотнимающий агент
Фосфорный ангидрид отнимает у других веществ не только гигроскопическую влагу, но и химически связанную воду. Он способен даже дегидратировать оксокислоты:
Это используется для получения ангидридов кислот.
Фосфорные кислоты
Фосфор образует только 2 устойчивых оксида, но большое число кислот, в которых он находится в степенях окисления +5, +4, +3, +1. Строение наиболее известных кислот выражается следующими формулами

Как видно из этих формул, фосфор во всех случаях образует пять ковалентных связей, т.е. имеет валентность, равную V. В то же время степени окисления фосфора и основность кислот различаются.
Наибольшее практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая (фосфористая) кислоты.
H3PO4 — фосфористая кислота
Важная особенность фосфористой кислоты обусловлена строением ее молекул. Один из 3-х атомов водорода связан непосредственно с атомом фосфора, поэтому не способен к замещению атомами металла, вследствие чего эта кислота является двухосновной. Формулу фосфористой кислоты записывают с учетом этого факта следующим образом: Н2[НРО3]
Является слабой кислотой.
Способы получения
1. Растворение Р2О3 в воде (см. выше).
2. Гидролиз галогенидов фосфора (III): PCl3 + ЗН2О = Н2[НРО3] + 3HCl
3. Окисление белого фосфора хлором: 2Р + 3Cl2 + 6Н2О = 2Н2[НРО3] + 6HCl
Физические свойства
При обычной температуре H3PO3 — бесцветные кристаллы с т. пл. 74°С, хорошо растворимые в воде.
Химические свойства
Кислотные функции
Фосфористая кислота проявляет все свойства, характерные для класса кислот: взаимодействует с металлами с выделением Н2; с оксидами металлов и со щелочами. При этом образуются одно — и двухзамещенные фосфиты, например:
Оксид фосфора(V). Фосфорные кислоты
Восстановительные свойства
Кислота и ее соли — очень сильные восстановители; они вступают в окислительно-восстановительные реакции как с сильными окислителями (галогены, H2SО4 конц., К2Сr2O2), так и с достаточно слабыми (например, восстанавливают Au, Ag, Pt, Pd из растворов их солей). Фосфористая кислота при этом превращается в фосфорную.
При нагревании в воде Н3РO3 окисляется до H3PO4 с выделением водорода:
Восстановительные свойства
При нагревании безводной кислоты происходит диспропорционирование: 4Н3РO3 = ЗН3РO4 + РН3
Фосфиты — соли фосфористой кислоты
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2Р03.
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2- 1 анионами HPO3.
Большинство фосфитов плохо растворимы в во-де, хорошо растворяются только фосфиты щелочных металлов и кальция.
Н3РO4 — ортофосфорная кислота
3-основная кислота средней силы. Диссоциация протекает в основном по 1-й ступени:
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Физические свойства
При обычной температуре безводная Н3РO4 представляет собой прозрачное кристаллическое вещество, очень гигроскопичное и легкоплавкое (т. пл. 42°’С). Смешивается с водой в любых соотношениях.
Способы получения
Исходным сырьем для промышленного получения Н3РO4 служит природный фосфат Са3(РO4)2:
I. 3-стадийный синтез:
II. Обменное разложение фосфорита серной кислотой
Получаемая по этому способу кислота загрязнена сульфатом кальция.
III. Окисление фосфора азотной кислотой (лабораторный способ):
Химические свойства
Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами, с основными оксидами и основаниями, образует соли аммония.
Кислотные функции
в) со щелочами, образуя средние и кислые соли
В отличие от аниона NO3 — в азотной кислоте, анион РO4 3- окисляющим действием не обладает.
Качественная реакция на анион РO4 3-
Реактивом для обнаружения анионов РO4 3- (а также НРO4 2- , Н2РO4 — ) является раствор AgNO3, при добавлении которого образуется нерастворимый желтый фосфат серебра:
Образование сложных эфиров
Сложные эфиры нуклеозидов и фосфорной кислоты являются структурными фрагментами природных биополимеров — нуклеиновых кислот.
Фосфатные группы входят также в состав ферментов и витаминов.
Фосфаты. Фосфорные удобрения.
Н3РO4 как 3-основная кислота образует 3 типа солей, которые имеют большое практическое значение.
Растворимость в воде
большинство нерастворимо (кроме фосфатов щелочных Me и аммония)
Источник: examchemistry.com
Нужно составить схема: фосфор-оксид фосфора (V) — фосфорная кислота-фосфат калия-фосфат серебра
Найди верный ответ на вопрос ✅ «Нужно составить схема: фосфор-оксид фосфора (V) — фосфорная кислота-фосфат калия-фосфат серебра . » по предмету Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Новые вопросы по химии
Что произойдёт с железом при взаимодействии с водой? 3 класс.
C8h18 формула глюкозы
1. Цинк растворили в концентрированной азотной кислоте. Полученный газ растворили в горячей воде. В ходе этого взаимодействия образовался бесцветный газ. Он легко окисляется кислородом воздуха до образования бурого газа.
Закончите формулы. H2+CuO= Na+HCl =
Что такое макроэлементы и ультромикроэлементы?
Главная » Химия » Нужно составить схема: фосфор-оксид фосфора (V) — фосфорная кислота-фосфат калия-фосфат серебра
Источник: urokam.net
Фосфор и его соединения

Видеоурок позволяет узнать о строении атома фосфора, его возможных степенях окисления в соединениях. В виде таблицы собран материал по аллотропным модификациям фосфора. Здесь рассматриваются физические и химические свойства не только фосфора, но и его соединений: фосфина, оксида фосфора (V), фосфорной кислоты. Кроме этого, приведены названия кислых солей фосфорной кислоты, качественная реакция на фосфат-ион в виде демонстрации, круговорот фосфора в природе, а также применение фосфора и его соединений.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет.
Получите невероятные возможности

1. Откройте доступ ко всем видеоурокам комплекта.

2. Раздавайте видеоуроки в личные кабинеты ученикам.

3. Смотрите статистику просмотра видеоуроков учениками.
Получить доступ
Конспект урока «Фосфор и его соединения»
Фосфор и его соединения
Фосфор, как и азот – элемент V A группы. Значит, на внешнем энергетическом уровне у него 5 электронов. Атом фосфора в соединениях может проявлять различные степени окисления: от -3 до +5. Атомы фосфора по сравнению с атомами азота имеют больший радиус, меньшее значение электроотрицательности. Фосфор чаще проявляет в соединениях степень окисления +5.
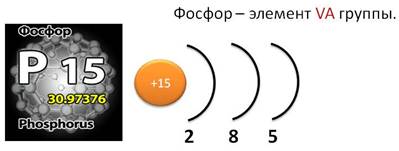
В природе фосфор встречается только в виде соединений, важнейшими из которых являются минералы фосфориты и апатиты, содержащие фосфат кальция – Ca3(PO4)2.
Часть фосфора в организме человека распределена в мышечной, нервной и мозговой тканях. В виде производной фосфорной кислоты фосфор входит в состав нуклеиновых кислот – ДНК и РНК, осуществляющих передачу наследственных свойств организма. Из фосфора, поступающего в организм человека с пищей, главным образом с яйцами, мясом, молоком и хлебом, строится АТФ – аденозинтрифосфорная кислота.
Фосфор был открыт немецким алхимиком Брандом в 1669 году и получил своё название за способность светиться в темноте (от греческого фосфор – светоносный).


Химический элемент фосфор образует несколько аллотропных модификаций, различающихся между собой по строению, физическим свойствам и химической активности.
Белый фосфор состоит из молекул P4, имеющих форму тэтраэдра. Молекулярное строение этого вещества обуславливает его легкоплавкость и летучесть. Этот фосфор не растворим в воде, но хорошо растворим в сероуглероде. На воздухе легко окисляется, а в порошкообразном состоянии даже воспламеняется.

Белый фосфор очень ядовит. Он светится в темноте и его хранят под водой.
Красный фосфор имеет атомную структуру, в которой каждый атом фосфора связан с тремя другими атомами ковалентными связями. При нагревании красного фосфора в пробирке, закрытой ватным тампоном, он превращается в белый фосфор.


Красный фосфор – порошок тёмно-красного цвета, он неядовит, не растворяется ни в каких растворителях, нелетуч и в химическом отношении менее активен, чем белый.
При нагревании под давлением, белый фосфор переходит в чёрный, который имеет атомную кристаллическую решетку. Чёрный фосфор по своим физическим свойствам похож на металл: он проводит электрический ток и блестит. По внешнему виду он похож на графит и жирен на ощупь.
При взаимодействии с кислородом фосфор проявляет восстановительные свойства, а в реакциях с металлами – окислительные. В реакциях фосфора с металлами образуются соединения – фосфиды. Например, в реакции с фосфором образуется фосфид кальция.
В этой реакции кальций повышает свою степень окисления с 0 до +2, а фосфор понижает с 0 до -3. Каждый атом кальция отдаёт по 6 электронов молекуле фосфора. При этом кальция является восстановителем, а фосфор – окислителем.

Белый фосфор самовоспламеняется на воздухе, а красный горит при поджигании. При этом образуется оксид фосфора (V).

В этой реакции фосфор повышает свою степень окисления с 0 до +5, а кислород понижает с 0 до -2. Фосфор выступает в роли восстановителя, а кислород – в роли окислителя.
С водородом фосфор не реагирует, но его водородное соединение – фосфин – PH3 можно получить из фосфидов действием на них кислот. Например, при взаимодействии фосфида кальция с соляной кислотой образуется соль – хлорид кальция и фосфин.

Фосфин – это ядовитый газ с неприятным запахом. Он легко воспламеняется на воздухе.
Появление блуждающих огней на старых кладбищах и болотах вызвано воспламенением на воздухе фосфина и других соединений фосфора с водородом. Эти газообразные вещества образуются при разложении органических соединений, содержащих фосфор. На воздухе продукты соединения фосфора с водородом самовоспламеняются с образованием светящегося пламени и капелек фосфорной кислоты – продукта взаимодействия оксида фосфора (V) с водой. Эти капельки создают размытый контур «привидения».

Красный фосфор используют для производства спичек, фосфорной кислоты, которая идёт на производство фосфорных удобрений и кормовых добавок для животных, его применяют для производства ядохимикатов.

Фосфор образует оксид фосфора (V) и оксид фосфора (III), а также кислородсодержащие кислоты, среди которых наиболее важное промышленное применение находит фосфорная кислота.
Оксид фосфора (V) образуется при сгорании фосфора в кислороде.
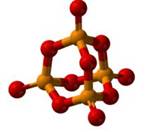
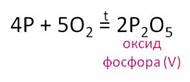
При недостатке кислорода образуется оксид фосфора (III).
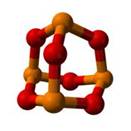
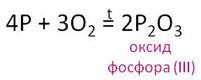
Оксид фосфора (V) представляет собой белый порошок, энергично поглощает пары воды из воздуха и постепенно превращается в прозрачную расплывшуюся массу. Благодаря этому свойству оксид фосфора (V) способен отнимать воду и у других веществ. Поэтому он широко используется как осушитель. Многие органические вещества обугливаются при действии на них этого оксида, кроме того, при попадании на кожу он может вызвать сильные ожоги.
Оксид фосфора (V) – типичный кислотный оксид, он взаимодействует с основными оксидами и щелочами, образуя соли фосфорной кислоты – фосфаты.
Так, в реакции оксида фосфора (V) с оксидом кальция образуется соль – фосфат кальция. В реакции оксида фосфора (V) с гидроксидом натрия образуется соль – фосфат натрия и вода.
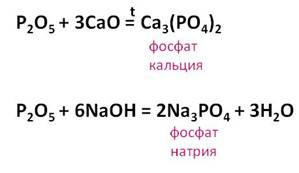
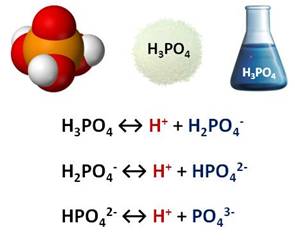
При взаимодействии оксида фосфора (V) с избытком воды образуется фосфорная кислота.

Фосфорная кислота представляет собой твёрдое прозрачное кристаллическое вещество, хорошо растворимое в воде в любых соотношениях. Это слабая кислота, поэтому в водном растворе диссоциирует ступенчато: на первой ступени образуется катион водорода и дигидрофосфат-ион, на второй ступени опять образуется катион водорода и гидрофосфат-ион, а на третьей ступени образуется катион водорода и фосфат-ион.
Фосфорная кислота проявляет свойства, характерные для кислот. Она взаимодействует с металлами, стоящими в ряду активности до водорода. Например, в реакции фосфорной кислоты с цинком, образуется соль – дигидрофосфат цинка и выделяется газ – водород.
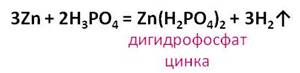
Фосфорная кислота вступает во взаимодействие с основными оксидами. Так в реакции оксида лития с фосфорной кислотой образуется соль – фосфат лития и вода.
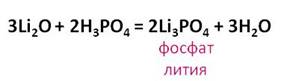
Фосфорная кислота реагирует и с основаниями. В реакции гидроксида натрия с фосфорной кислотой образуется соль – фосфат натрия и вода.
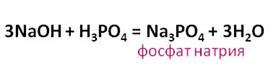
Фосфорная кислота – трёхосновная кислота, поэтому она может образовывать кроме средних солей кислые соли. Например, Ca3(PO4)2– средняя соль, она называется фосфат кальция, CaHPO4 – кислая соль и называется гидрофосфат кальция, Ca(H2PO4)2 тоже кислая соль и называется дигидрофосфат кальция. Фосфаты всех металлов в воде нерастворимы (исключение – фосфаты щелочных металлов), дигидрофосфаты всех металлов хорошо растворимы, а гидрофосфаты занимают промежуточное положение.
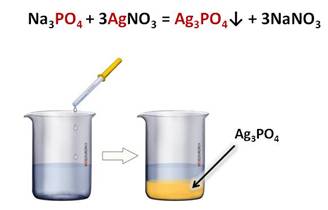
Качественной реакцией на фосфат-ион является реакция с нитратом серебра, при этом образуется фосфат серебра (I) – осадок жёлтого цвета и соль – нитрат натрия.
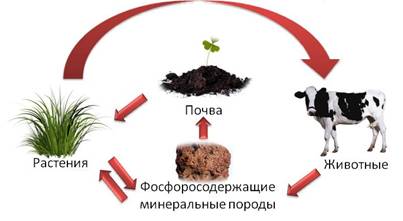
В природе постоянно происходит круговорот фосфора. Фосфор из почвы извлекается растениями, а животные получают фосфор с растительной пищей. После отмирания растительных и животных организмов фосфор снова переходит в почву.
Фосфорная кислота используется как катализатор в органическом синтезе, для производства кормовых добавок, придании кисловатого вкуса безалкогольным напиткам, осветления сахара. Но основная часть фосфорной кислоты расходуется на производство фосфатов, использующихся в качестве минеральных удобрений. Фосфаты применяются и в медицине, для пропитки тканей, древесины и пластмасс с целью придания им огнестойкости, также при производстве стиральных порошков.

Таким образом, фосфор является элементом V A группы. На внешнем энергетическом уровне у него 5 электронов, для него характерны степени окисления от -3 до +5, но наиболее типична +5. В природе он встречается в виде соединений – фосфоритов и апатитов. Фосфор образует несколько аллотропных модификаций: белый, красный и чёрный фосфор.
Наиболее распространёнными соединениями фосфора являются – оксид фосфора (III), оксид фосфора (V), фосфин и фосфорная кислота. В реакциях с металлами фосфор проявляет окислительные свойства, а в реакции с кислородом – восстановительные. Фосфорная кислота – трёхосновная кислота, которая образует три вида солей: фосфаты, гидрофосфаты и дигидрофосфаты. Качественным реактивом на фосфат-ион является нитрат серебра один, потому что в результате взаимодействия образуется осадок жёлтого цвета. Фосфор и его соединения имею большое значение в химической промышленности.
Источник: videouroki.net