Характеристики и физические свойства карбоната кальция
ОПРЕДЕЛЕНИЕ
Карбонат кальция в обычных условиях представляет собой вещество белого цвета (рис. 1), которое при прокаливании разлагается, однако плавится без разложения (условие – избыточное давление CO2).
Практически не растворяется в воде.

Рис. 1. Карбонат кальция. Внешний вид.
Основные характеристики карбоната кальция приведены в таблице ниже:
Молярная масса, г/моль
Плотность, г/см 3
Температура плавления, o С
Температура разложения, o С
Растворимость в воде (25 o С), г/100 мл
Получение карбоната кальция
Основной способ получения карбоната кальция заключается в смешивании твердого оксида кальция с водой — образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диоксида углерода.
Получение Карбоната Кальция — чистого мела. CaCO3.
Химические свойства карбоната кальция
Карбонат кальция — это средняя соль, образованная сильным основанием (гидроксид кальция Ca(OH)2) и слабой кислотой (угольная H2CO3). В водном растворе он гидролизуется. Гидролиз протекает по аниону. Наличие анионов OH — свидетельствует о щелочном характере среды.
Ca 2+ +CO3 2- + HOH ↔ HCO3 — + Ca 2+ + OH — ;
Карбонат кальция взаимодействует с концентрированными растворами сильных минеральных кислот:
Он способен реагировать с щелочами в водных растворах:
Взаимодействие карбоната кальция с другими солями возможно только если продукт взаимодействия выводится из реакционной среды:
При нагревании данная соль разлагается:
CaCO3 = CaO + CO2↑ (t, o С = 900 — 1000).
Пропускание диоксида углерода через раствор карбоната кальция приводит к образованию кислой соли – гидрокарбоната кальция:
Применение карбоната кальция
Карбонат кальция нашел широкое применение в различных отраслях промышленности. Так, например, его используют в пищевой (добавка Е710 – белый краситель) и бумажной промышленности, при производстве полимеров, лакокрасочных материалов, бытовой химии и т.д.
Примеры решения задач
| Задание | Вычислите массу карбоната кальция, который может прореагировать с концентрированным раствором соляной кислоты объемом 200 мл (массовая доля HCl 34%, плотность 1,168кг/л). Определите объем диоксида углерода, выделяющийся в результате этой реакции. |
| Решение | Запишем уравнение реакции: |
Найдем массу раствора соляной кислоты, а также массу растворенного вещества HCl в нем:
msolution =0,2 × 1,168 = 0,2336 кг = 233,6 г.
msolute (HCl) = ω (HCl) / 100% ×msolution;
msolute (HCl) = 34 / 100% × 233,6 = 79,424 г.
Рассчитаем количество моль соляной кислоты (молярная масса равна 36,5 г/моль):
n(HCl) = m (HCl) / M (HCl);
n (HCl) = 79,424 / 36,5 = 2,176 моль.
Согласно уравнению реакции n (HCl) :n (CO2) =2: 1. Значит,
n(CO2) = ½ n(HCl) = ½×2,176 = 1,088моль.
Тогда, объем выделившегося диоксида углерода будет равен:
V (CO2) = 1,088 × 22,4 = 24,37л.
Согласно уравнению реакции n(HCl) :n (CaCO3) =2: 1. Значит,количество вещества карбоната кальция будет равно:
n (CaCO3) = ½ ×n (NaOH) = ½× 2,176 = 1,088моль.
Тогда масса карбоната кальция, вступившего в реакцию будет равна (молярная масса – 100 г/моль):
m (CaCO3) = 1,088 × 100 = 108,8г.
| Задание | Вычислите массу оксида кальция, который потребуется для получения карбоната кальция по реакции взаимодействия с диоксидом углерода массой 3,5 г. |
| Решение | Запишем уравнение реакции взаимодействия оксида кальция и диоксида углерода с образованием карбоната кальция: |
Рассчитаем количество вещества диоксида углерода (молярная масса – 44 г/моль):
n (CO2) = 3,5 / 44 = 0,08 моль.
Согласно уравнению реакции n(CO2) : n(CaO) = 1:1 . Тогда количество моль оксида кальция будет равно:
n (CaO) = n (CO2) = 0,08 моль.
Найдем массу оксида кальция (молярная масса – 56 г/моль):
m (CaO) = n (CaO) × M (CaO);
m (CaO) = 0,08 × 56 = 4,48 г.
Источник: ru.solverbook.com
Карбонат кальция

Карбонат кальция (углекислый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула CaCO3 .
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Применение
Используется как белый пищевой краситель E170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование


Таблетки из карбоната кальция
Очищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей.
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок.
В строительстве
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
Нахождение в природе
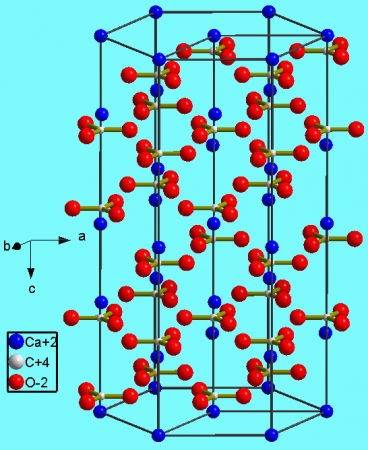
Кристаллическая структура кальцита
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:



Геология
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов.
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Получение
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция:
Химические свойства
См. также: Карбонаты
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
Соединения кальция
- Кальций (Ca)
- Азид кальция (Ca(N3)2) Тринидрид кальция
- Альгинат кальция ((C12H14O12Ca)n) Кальций альгиновокислый
- Арсенат кальция (Ca3(AsO4)2) Кальций мышьяковокислый
- Ацетат кальция (Ca(CH3COO)2) Кальций уксуснокислый
- Бензоат кальция (Ca(C6H5COO)2) Кальций бензойнокислый
- Борат кальция (Ca3(BO3)2) Кальций борнокислый
- Борат кальция-натрия (NaCaBO3) Кальций натрий борнокислый
- Бромат кальция (Ca(BrO3)2) Кальций бромноватокислый
- Бромид кальция (CaBr2) Кальций бромистый
- Вольфрамат кальция (CaWO4) Кальций вольфрамовокислый
- Гексафторосиликат кальция (CaSiF6) Кальций-кремний фтористые
- Гексацианоферрат II кальция (Ca2[Fe(CN)6]) Кальций железистосинеродистый
- Гексацианоферрат III кальция (Ca3[Fe(CN)6]2) Кальций железосинеродистый
- Гидрокарбонат кальция (Ca(HCO3)2) Кальций двууглекислый
- Гидроксид кальция (Ca(OH)2) Гашеная известь
- Гидросульфид кальция (Сa(HS)2) Бисульфид кальция
- Гидросульфит кальция (Ca(HSO3)2) Бисульфит кальция
- Гипофосфит кальция (Ca(PH2O2)2) Кальций фосфорноватистокислый
- Гипохлорит кальция (Сa(ClO)2) Кальций хлорноватистокислый
- Глюконат кальция (C12H22CaO14) Кальций глюконат
- Дитионат кальция (CaS2O6) Кальций дитионовокислый
- Дихромат кальция (CaCr2O7) Бихромат кальция (Кальций хромовокислый)
- Добезилат кальция (C12H10CaO10S2)
- Йодат кальция (Ca(IO3)2) Кальций йодноватокислый
- Йодид кальция (CaI2) Кальций йодистый
- Карбид кальция (CaC2) Кальций углеродистый
- Карбонат кальция (CaCO3) Кальций углекислый
- Карбонат кальция-калия (K2Ca(CO3)2) Кальций-калий углекислый
- Карбонат магния-кальция (CaMg(CO3)2) Магний-кальций углекислый
- Лактат кальция (2(C3H5O3)·Ca) Кальций молочнокислый
- Метаборат кальция (Ca(BO2)2) Тетраоксодиборат кальция
- Метасиликат магния-кальция (CaMg(SiO3)2) Магний-кальций кремнекислые мета
- Молибдат кальция (CaMoO4) Кальций молибденовокислый
- Нитрат кальция (Ca(NO3)2) Кальций азотнокислый
- Нитрит кальция (Ca(NO2)2) Кальций азотистокислый
- Оксалат кальция (CaC2O4) Кальций щавелевокислый
- Олеат кальция (Ca(C18H33O2)2) Кальций олеиновокислый
- Пальмитат кальция (Ca(C15H31COO)2) Кальций пальмитиновокислый
- Перманганат кальция (Ca(MnO4)2) Кальций марганцовокислый
- Перхлорат кальция (Ca(ClO4)2) Кальций хлорнокислый
- Пропионат кальция (Ca(C2H5COO)2) Кальций пропионовокислый
- Селенат кальция (CaSeO4) Кальций селеновокислый
- Селенид кальция (CaSe) Кальций селенистый
- Силикат кальция (CaSiO3) Кальций кремнекислый
- Станнат кальция (CaSnO3) Кальций оловяннокислый
- Стеарат кальция (Ca(C17H35COO)2) Кальций стеариновокислый
- Сукцинат кальция (CaC4H4O4) Кальций янтарнокислый
- Сульфат кальция (CaSO4) Кальций сернокислый
- Сульфид кальция (CaS) Кальций сернистый
- Сульфит кальция (CaSO3) Кальций сернистокислый
- Тартрат кальция (CaC4H4O6) Кальций виннокислый
- Теллурит кальция (CaTeO3) Кальций теллуристокислый
- Тетраборат кальция (CaB4O7) Кальций борнокислый тетра
- Тиосульфат кальция (CaS2O3) Кальций тиосернокислый
- Тиоцианат кальция (Ca(SCN)2) Кальций роданистый
- Формиат кальция (Ca(HCOO)2) Кальций муравьинокислый
- Фосфонат кальция (CaPHO3) Кальций фосфористокислый
- Фторид кальция (CaF2) Кальций фтористый
- Хлорат кальция (Ca(ClO3)2) Кальций хлорноватокислый
- Хлорид кальция (CaCl2) Кальций хлористый
- Хлорит кальция (Ca(ClO2)2) Кальций хлористокислый
- Хромат кальция (CaCrO4) Жёлтый ультрамарин
- Цианамид кальция (CaCN2)
- Цианид кальция (Ca(CN)2) Кальций цианистый
- Цианплав Чёрный цианид
- Цирконат кальция (CaZrO3) Кальций циркониевокислый
- Цитрат кальция (Ca3(C6H5O7)2) Кальций лимоннокислый
Источник: chem.ru
Карбонат кальция


Кальция карбонат представляет собой твердые белые кристаллы без запаха и вкуса нерастворимые в воде, этаноле и легко растворимые в кислотах с выделением углекислого газа. Это неорганическое химическое соединение, соль угольной кислоты и кальция. В природе встречается в виде минералов, различающиеся кристаллической структурой — широко распространённый кальцит, арагонит и ватерит, является главной составной частью известняка, мела и мрамора, одно из самых распространенных на Земле соединений.
Плотность карбоната кальция
Плотность (кальцит) 2,74 г/см³, (арагонит) 2,83 г/см³.
Температура плавления карбонат кальция
Температура плавления (кальцит) 825° C, (арагонит) 1339° C,
Температура разложения карбоната кальция
Температура разложения 900-1000° C.
Формула карбоната кальция
Химическая формула: CaCO3.
Получение карбоната кальция
Кальция карбонат получают взаимодействием известкового молока с углекислотой или хлоридом кальция (СаСl2) с карбонатом натрия (Na2CO3) в водном растворе.
Применение карбоната кальция
Кальция карбонат (углекислый кальций, мел, кальциевая соль угольной кислоты) применяется:
- в лакокрасочной промышленности, в производстве красок и отделочных материалов;
- в химической промышленности при производстве карбида кальция;
- в стекольной промышленности при изготовлении стекла;
- в строительстве при производстве шпатлевок, различных герметиков и др.;
- в сельском хозяйстве, как известковое удобрение и для комплексного агрохимического окультуривания полей;
- в качестве наполнителя для резиновых смесей, бумаги, линолеума;
- в медицине как антацидное, противоязвенное, восполняющее дефицит кальция средство;
- в косметической промышленности при производстве зубного порошка, как наполнитель косметических средств;
- в пишевой промышленности, как пищевая добавка краситель E170.
Таблица 1. Физико-химические показатели карбоната кальция
| Содержание хлоридов, %, не более | 0,033 |
| Содержание cульфатов, %, не более | 0,25 |
| Содержание мышьяка (As), %, не более | 0,0001 |
| Содержание бария (Ba), %, не более | 0,0001 |
| Содержание железа (Fe), %, не более | 0,01 |
| Содержание фтора (F), %, не более | 0,005 |
| Содержание ртути (Hg), %, не более | 0,00005 |
| Содержание свинца (Pb), %, не более | 0,0003 |
| Содержание тяжелых металлов, %, не более | 0,002 |
Электрические свойства наполнителей на основе карбоната кальция (2 таблицы):
| кальцит в направлении, перпендикулярном оптической оси | 8,5 |
| кальцит в направлении параллельном оптической оси | 8,0 |
| доломит, в направлении, перпендикулярном оптической оси | 8,0 |
| доломит, в направлении параллельном оптической оси | 6,8 |
| объемное, Ом·см | 10 9 -10 11 |
| поверхностное при 50%-ной отн. влажности, Ом | (3-8)·10 9 |
| поверхностное при 90%-ной отн. влажности, Ом | (1-3)·10 7 |
| кальцит (CaCO3) | 17 000-25 000 |
| доломит (CaCO3·MgCO3) | 3 000-5 000 |
| pH кальцита | 9,0-9,5 |
| pH доломита | 9-10 |
| Удельное объемное электрическое сопротивление ПВХ композиции электроизоляционного назначения при 50°C, Ом·см | >4·10 14 |
Таблица 4. Физические свойства различных типов карбонатов.
| Плотность, кг/м 3 | 2600 — 2750 | 2920 — 2940 | 2800 — 2900 | 3000 — 3100 |
| Твердость по Мосу | 3,0 | 3,5 — 4,0 | 3,5 — 4,0 | 3,5 — 4,5 |
| Содержание растворимых фракций | 0,99·10 -8 (при 15°C)0,87·10 -8 (при 25°C) | — | — | 2,6·10 -5 (при 12°C) |
| Растворимость при 18°С | ||||
| г/100 г воды | 0,0013 | 0,0019 | 0,032 | 0,0106 |
| г/100 г водного раствора СО2 | 0,13 | 0,19 | 3,2 | 1,06 |
| Температура разложения, °C | 900 | 825, переходит в кальцит при Т>400°C | 730-760 | 350 |
| Природные источники | Известняк, мрамор, известковый шпат, яичная скорлупа, кости (с примесью фосфата кальция), горные породы (в сочетании с доломитом) | Панцири моллюсков, кораллы.Образуется при Т>30°C; переходит в кальцит при Т>400°C и Т | — | — |
Статьи по теме

Основные пигменты
Название элемента хрома происходит от греческого слова «хром», что означает «цвет», «краска». Оксид хрома — лишь одно из ярко окрашенных соединений элемента № 24.

Окрашивание пигментами
Пигменты полидисперсны; гранулометрии, (дисперсионный) состав их оказывает большое влияние на оптич. и технико-эко-номич. характеристики.

Красящие пигменты
Сегодня лакокрасочная продукция является достаточно распространенной. Она предназначена не только для нанесения декоративного слоя на различные виды поверхностей, но и для защиты отдельных видов материалов от появления ржавчины или коррозии.
Источник: lkmprom.ru