

Этот химический элемент известен человеку давно и сегодня используется буквально повсеместно. Электрические провода, посуда, монеты, строительные материалы – в наши дни медь и сплавы на её основе применяются в самых разных отраслях промышленности. Начало применения Cu относят к «Бронзовому веку» (3 тыс. лет до н.э.). Уже тогда люди умели добывать этот розово-золотистый металл и даже получать медно-оловяные сплавы. Вместе с тем, нахождение в природе меди совсем невелико: если изучить состав земной коры нашей планеты, то элемента Cu в неё окажется всего около 0,01% (23 место).
Медь: нахождение в природе

В природе медь встречается как в чистом виде (самородки могут достигать общего веса в несколько сотен тонн), так и в составе различных соединений. Обычно приходится иметь дело с сульфидами, сформировавшимися в осадочных горных породах, либо с субстратами. Получить медь из этих соединений легко благодаря низкой температуре плавления, чем и пользовались наши предки при изготовлении самых разных медных изделий.
Трансмутация — получение золота из меди.
Что касается названия элемента – Cuprum, то историки соотносят его с наименованием некогда древнегреческого острова Кипр (Cyprus), когда-то являвшегося наиболее крупным в Европе центром выработки материала. Вполне возможно впервые выплавлять медь научились именно на Кипре.
Физические свойства меди

Прежде всего, медь очень пластична, а потому крайне удобна в использовании, в частности, в плавке. Отличает этот металл и такая характеристика, как ярко выраженная окраска, которая делает материал декоративным (+ отжиг меди). Если для большинства известных металлов характерен серебристо-серый цвет, то Cu, наравне с золотом и осмием входит в число трёх с уникальной цветовой окраской.
Еще одно достоинство меди – высокая электропроводность, которая предопределяет использование данного металла в составе самой разной электропроводниковой продукции. Здесь же стоит сказать и о таком свойстве Cu, как отсутствие искры при ударе. Эта уникальная особенность меди делает её отличным материалом для изготовления деталей, работающих в условиях повышенной пожароопасности.
Химические свойства соединений меди

Особого внимания заслуживает взаимодействие Cu с кислотами. Так, этот элемент никак не реагирует на воду, растворы щелочей, соляную или разбавленную серную кислоты. При этом сильные окислители, такие как концентрированная серная или азотная кислота, очень быстро медь растворяют. Cu также называют коррозийностойким металлом, однако влажная атмосфера и углекислые газы, взаимодействуя с медью, способствуют образованию на её поверхности зеленоватого налета (карбонат меди).
Сегодня широкое применение находят оксид (СuО), гидроксид (Си(ОН)2) и сульфид меди (CuS). Уникальное свойство сульфида меди – высокая электропроводность, позволяющая получать сверхпроводники. Химические свойства гидроксида меди позволяют легко получать оксиды (путем разложения гидроксида меди 2 при нагревании).
This entry was posted in Полезные статьи by admin. Bookmark the permalink.
Источник: fx-commodities.ru
Химик.ПРО – решение задач по химии бесплатно
По условию задачи медь (Cu) получили восстановлением из оксида меди (II) (CuO) при помощи водорода (H2). Запишем уравнение реакции получения меди (Cu):
![]()
Учитывая, что молярная масса меди (Cu) равна 63,5 г/моль, рассчитаем молярную массу оксида меди (II) (CuO):
M (CuO) = 63,5 + 16 = 79,5 (г/моль).
По уравнению реакции найдем массу полученной меди (Cu):
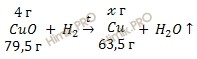
из 79,5 грамм CuO образуется 63,5 грамма Cu
из 4 грамм CuO образуется грамм Cu
![]()
Ответ:
получение меди 3,2 грамма.
Источник: himik.pro
Какая химическая формула меди
Медь характеризуется исключительной пластичностью и превосходит другие металлы по теплопроводности и электрической проводимости. Плотность 8,94 г/см 3 . Температура плавления 1084,5 o C, кипения 2540 o C.

Химическая формула меди
Химическое обозначение меди – Cu от латинского слова «cyprum». Этот химический элемент расположен в четвертом периоде в IВ группе Периодической таблицы Д.И. Менделеева.Относится к элементам d-семейства. Металл. Относительная атомная масса меди равна 63,546 а.е.м.
Электронная формула меди
В ядре атома меди содержится 29 протонов и 35 нейтронов (массовое число равно 64). В атоме меди есть четыре энергетических уровня, на которых находятся 29 электронов (рис. 2).
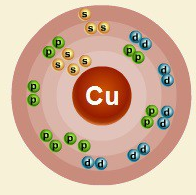
Рис. 2. Строение атома меди.
Электронная формула атома меди в основном состоянии имеет следующий вид:
Примеры решения задач
| Задание | Определите простейшую формулу вещества, в котором массовые доли натрия, фосфора и кислорода составляют 34,59, 23,31 и 42,10% соответственно. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
Обозначим число атомов натрия в молекуле через «х», число атомов фосфора через «у» и число атомов кислорода за «z».
Найдем соответствующие относительные атомные массы элементов натрия, фосфора и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
x:y:z = m(Na)/Ar(Na) : m(P)/Ar(P) : m(O)/Ar(O);
x:y:z = 34,59/23 : 23,31/31 : 42,10/16;
x:y:z = 1,5 : 0,75 : 2,63 = 2: 1 : 3,5 = 4 : 4: 7
Значит простейшая формула соединения натрия, фосфора и кислорода имеет вид Na4P4O7.
| Задание | Определите молекулярную формулу вещества, состоящего из кислорода, азота, фосфора и водорода, если известно, что оно содержит по массе 48,48% кислорода, число атомов азота в нем в два раза больше числа атомов фосфора, а количество атомов водорода в соединении в 2,25 раза больше количества атомов кислорода. Молярная масса вещества меньше 200 г/моль. |
| Решение | Обозначим число атомов кислорода в молекуле через «х», число атомов азота через «у», число атомов фосфора за «z» и число атомов водорода за «k». |
Найдем соответствующие относительные атомные массы элементов азота, фосфора, водорода и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(N) = 14; Ar(P) = 31; Ar(H) = 14; Ar(O) = 16
Пусть масса неорганического вещества равна 100 г, тогда масса кислорода составляет m(О) = 48,48 г. Найдем количество вещества кислорода:
Согласно условию задачи n(Н) = n(О) ×2,25, т.е.
Тогда масса водорода будет равна:
Найдем суммарную массу элементов азота и фосфора, входящих в состав соединения:
m (N + P) = msubstance — m(О) — m(Н);
m (N + P)= 100 – 48,5 – 6,82 = 44,68 г
Запишем уравнения для нахождения массы каждого из элементов в отдельности:
Составим систему уравнений и решим ее:
x:y:z:k= 3,03 : 1,514 : 0,757 : 6,82;
Значит простейшая формула соединения будет иметь вид O4N2PH9.
Молекулярная формула вещества может содержать удвоенное, утроенное и т.д. число атомов. Чтобы убедиться в том, что молекулярная формула вещества совпадает с простейшей, подсчитаем молярную массу:
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Медь, свойства атома, химические и физические свойства
Медь, свойства атома, химические и физические свойства.










63,546(3) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1
Медь — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 29. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), четвертом периоде периодической системы.
Атом и молекула меди. Формула меди. Строение атома меди:
Медь (лат. Cuprum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Cu и атомным номером 29. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), четвертом периоде периодической системы.
Медь – металл. Относится к группе переходных металлов. Относится к тяжёлым и цветным металлам.
Как простое вещество медь при нормальных условиях представляет собой пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки). Наряду с осмием, цезием и золотом, медь – один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов.
Молекула меди одноатомна.
Химическая формула меди Cu.
Электронная конфигурация атома меди 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 . Потенциал ионизации (первый электрон) атома меди равен 745,48 кДж/моль (7,726380(4) эВ).
Строение атома меди. Атом меди состоит из положительно заряженного ядра (+29), вокруг которого по четырем оболочкам движутся 29 электронов. При этом 28 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку медь расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью.
Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома меди – на s-орбитали находится один неспаренный электрон. В свою очередь ядро атома меди состоит из 29 протонов и 35 нейтронов.
Радиус атома меди (вычисленный) составляет 145 пм.
Атомная масса атома меди составляет 63,546(3) а. е. м.
Медь с давних пор широко используется человеком.
Изотопы и модификации меди:
Свойства меди (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Медь |
| 102 | Прежнее название | |
| 103 | Латинское название | Cuprum |
| 104 | Английское название | Copper |
| 105 | Символ | Cu |
| 106 | Атомный номер (номер в таблице) | 29 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый, цветной металл |
| 109 | Открыт | Известна с глубокой древности |
| 110 | Год открытия | 9000 г. до н. э. |
| 111 | Внешний вид и пр. | Пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки) |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0068 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10 -7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10 -6 % |
| 122 | Содержание в Солнце (по массе) | 0,00007 % |
| 123 | Содержание в метеоритах (по массе) | 0,011 % |
| 124 | Содержание в организме человека (по массе) | 0,0001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 63,546(3) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 |
| 203 | Электронная оболочка | K2 L8 M18 N1 O0 P0 Q0 R0 |
Cu 2+ + e – → Cu + , E o = +0,153 В,
8,02 г/см 3 (при температуре плавления 1084,62 °C и иных стандартных условиях , состояние вещества – жидкость),
7,962 г/см 3 (при 1127 °C и иных стандартных условиях , состояние вещества – жидкость),
7,881 г/см 3 (при 1227 °C и иных стандартных условиях , состояние вещества – жидкость),
7,799 г/см 3 (при 1327 °C и иных стандартных условиях , состояние вещества – жидкость),
7,471 г/см 3 (при 1727 °C и иных стандартных условиях , состояние вещества – жидкость),
7,307 г/см 3 (при 1927 °C и иных стандартных условиях , состояние вещества – жидкость),
205* Эмпирический радиус атома меди согласно [1] и [3] составляет 128 пм.
206* Ковалентный радиус меди согласно [1] и [3] составляет 132±4 пм и 117 пм соответственно.
401* Плотность меди согласно [3] составляет 8,92 г/см 3 (при 0 °C и при иных стандартных условиях , состояние вещества – твердое тело).
402* Температура плавления меди согласно [3] и [4] составляет 1083,4 °С (1356,55 K, 1982,12 °F) и 1083 °С (1356,15 K, 1981,4 °F) соответственно.
403* Температура кипения меди согласно [3] и [4] составляет 2567 °С (2840,15 K, 4652,6 °F) и 2543 °C (2816,15 К, 4609,4 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) меди согласно [3] и [4] составляет 13,01 кДж/моль и 13 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) меди согласно [3] и [4] составляет 304,6 кДж/моль и 302 кДж/моль соответственно.
Источник: ollimpia.ru