Задача 39.
Вычислить массу газа, выделившегося на аноде при электролизе раствора серной кислоты, производившегося в течение 10 мин при силе тока 3 А.
Решение:
р-р H2SO4;
t = 10 мин = 600 с;
I = 3 A;
F = 96 500 Кл/моль
m (O2) — ?
Электролиз раствора серый кислоты сводится к электролизу воды:
На электродах протекают следующие реакции:
После сокращения ионов водорода в левой и правой частях уравнения, получим:
Так как на аноде выделяется кислород:
m(O2) = [M(O2) . I . t]/(n . F) = (32 г/моль . 3 А . 600 с)/ (4 .
96500 A . c/моль) = 0,15 г.
Электролиз растворов солей нитрата серебра (I), сульфата меди (II) и хлорида золота (III)
Задача 40.
Через последовательно включенные в цепь постоянного тока растворы нитрата серебра (I), сульфата меди (II) и хлорида золота (III) пропускали ток силой в течение 20 мин. Рассчитайте массы металлов, осевших на катоде.
Решение:
р-ры AgNO3; CuSO4; AuCl3
Снятие серебряного покрытия электролизом | Removing the silver plating
I = 2,5 A
t = 20 мин = 1200 с
F = 96500 Кл/моль
m (Ag) — ?
m (Cu) — ?
m (Au) — ?
1) Все металлы, катионами которых образованы данные соли, находятся в ряду активности металлов «после водорода», значит на катодах будет протекать реакция восстановления только металлов:
►Ag + + 1 = Ag 0 ; n = 1, M(Ag) = 108 г/моль;
►Cu 2+ + 2 = Cu 0 ; n = 2, M(Cu) = 64 г/моль;
►Au 3+ + 3 = Au 0 ; n = 3, M(Au) = 197 г/моль.
2) По формуле объединенного закона электролиза:
m (в-ва) = [M(в-ва) . I . t]/(n . F)
Вычисляем массы металлов, получим:
m(Ag) = (108 г/моль . 2,5 А . 1200 с)/ (1 . 96500 A . c/моль) = 3,358 = 3,36 г;
m(Cu) = (64 г/моль . 2,5 А . 1200 с)/ (2 . 96500 A . c/моль) = 0,995 = 1,00 г;
m(Au) = (197 г/моль . 2,5 А . 1200 с)/ (3 . 96500 A . c/моль) = 2,042 = 2,00 г;
Ответ: m(Cu) = 1 г, m(Ag) = 3,36 г, m(Au) = 2 г.
- Вы здесь:
- Главная

- Задачи

- Общая химия

- Радиоактивный распад. Задачи 67 — 69
Источник: buzani.ru
Осаждение серебра электролизом. — От идеи, до результата!

Серебро из отработанных фиксажных растворов . В отработанный фиксажный раствор и первую промывную воду после промывки отфиксированных отпечатков переходит до 85% серебра из отрабатываемых фотоматериалов. Отработанные фиксажные растворы предварительно обрабатывают одним из рекомендуемых методов: электролизом растворов , восстановлением серебра металлами, осаждением серебра сернистым натрием, восстановлением серебра формалином и выпариванием растворов до получения сухих солей серебра.
Электролиз серебра по колхозному
Осаждение серебра электролизом рекомендуется проводить в аппаратах М-1 и М-2 конструкции завода вторичных драгоценных металлов, которые характеризуются следующими показателями
рис .

В аппаратах М-1 и М-2 электролиз ведут до полного выделения из раствора серебра в виде металлического порошка.
- Во избежание появления при электролизе запаха сероводорода добавляют 0,5—1 г кальцинированной соды на 1 л электролита.
После полного выделения серебра отработанный электролит из электролизной ванны вместе с образовавшимся осадком серебра спускают в осадительную камеру. В осадительной камере аппарата М-2 (без нагревателя) отстаивание осадка продолжается 16—18 ч, а в осадительной камере аппарата М-1 (с электронагревателем) раствор нагревают до 60—70° С, вследствие чего отстаивание заканчивается за 1,5 ч. Осветленный раствор сливают сифоном в стоки, а осадок серебра разгружают через люк бункера в мешочный фильтр, находящийся под бункерной частью аппарата. Осадок серебра перед опробованием подсушивают на воздухе или в сушильном шкафу при температуре до 100° С. Описанный метод является наилучшим.
Источник: www.abramovae.ru
Тема №34 «Электролиз расплавов и растворов»
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Поделиться в Facebook
Твитнуть в Twitter
Электролиз расплавов и растворов
Оглавление
- Электролиз расплавленных солей
- Электролитические диссоциация и ассоциация
- Шпаргалка
- Задания для самопроверки
Электролиз расплавленных солей
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
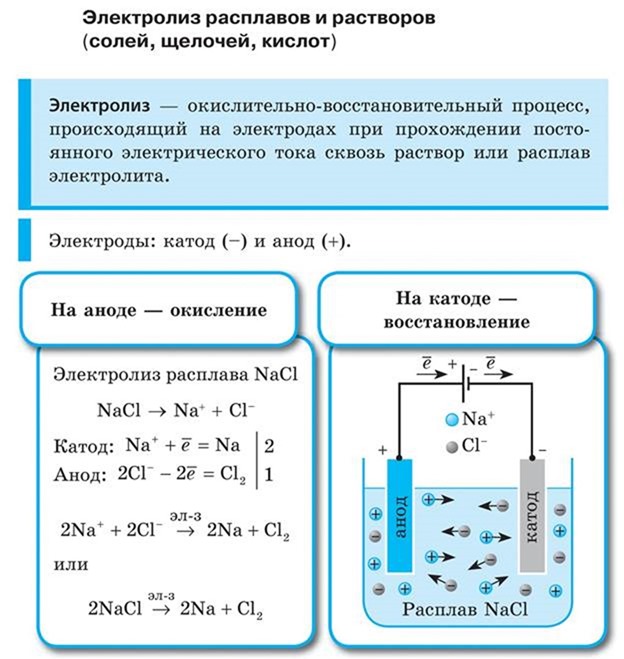
Рассмотрим процесс электролиза расплава хлорида натрия. В расплаве идет процесс термической диссоциации:
![]()
Под действием электрического тока катионы Na + движутся к катоду и принимают от него электроны:
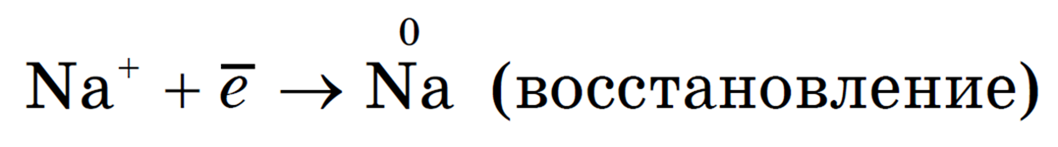
Анионы Cl — движутся к аноду и отдают электроны:
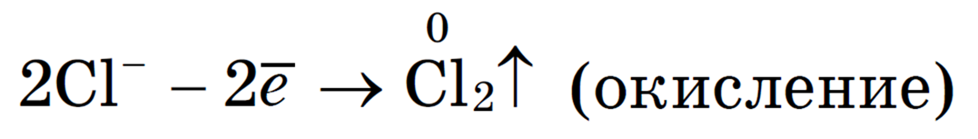
Суммарное уравнение процессов:
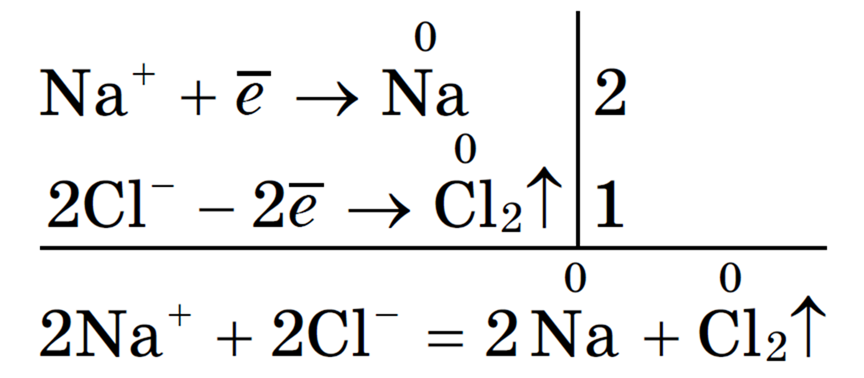
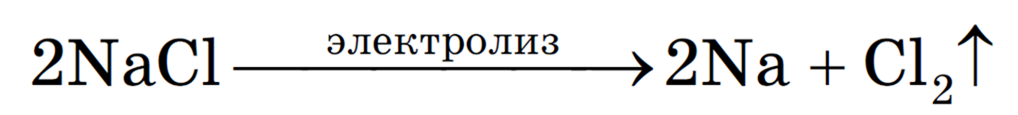
На катоде образуется металлический натрий, на аноде — газообразный хлор.
Главное, что вы должны помнить: в процессе электролиза за счет электрической энергии осуществляется химическая реакция, которая самопроизвольно идти не может.
Электролитические диссоциация и ассоциация
Более сложный случай — электролиз растворов электролитов. В растворе соли кроме ионов металла и кислотного остатка присутствуют молекулы воды. Поэтому при рассмотрении процессов на электродах необходимо учитывать их участие в электролизе.
Для определения продуктов электролиза водных растворов электролитов существуют следующие правила.
1. Процесс на катоде зависит не от материала катода, из которого он сделан, а от положения металла (катиона электролита) в электрохимическом ряду напряжений, при этом, если:
1) катион электролита расположен в ряду напряжений в начале ряда по Al включительно, то на катоде идет процесс восстановления воды (выделяется водород H2↑). Катионы металла не восстанавливаются, они остаются в растворе;
2) катион электролита находится в ряду напряжений между алюминием и водородом, то на катоде восстанавливаются одновременно и ионы металла, и молекулы воды;
3) катион электролита находится в ряду напряжений после водорода, то на катоде восстанавливаются катионы металла;
4) в растворе содержатся катионы разных металлов, то сначала восстанавливается катион металла, стоящий в ряду напряжений правее.
2. Процесс на аноде зависит от материала анода и от природы аниона:
1) если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в процессе электролиза), то окисляется металл анода, несмотря на природу аниона;
2) если анод не растворяется (его называют инертным — графит, золото, платина), то:
• при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона;
• при электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления воды (выделяется 02↑). Анионы не окисляются, они остаются в растворе;
• анионы по их способности окисляться располагаются в следующем порядке:

Попробуем применить эти правила в конкретных ситуациях.
Рассмотрим электролиз раствора хлорида натрия в случае, если анод нерастворимый и если анод растворимый.
1. Анод нерастворимый (например, графитовый).
В растворе идет процесс электролитической диссоциации:
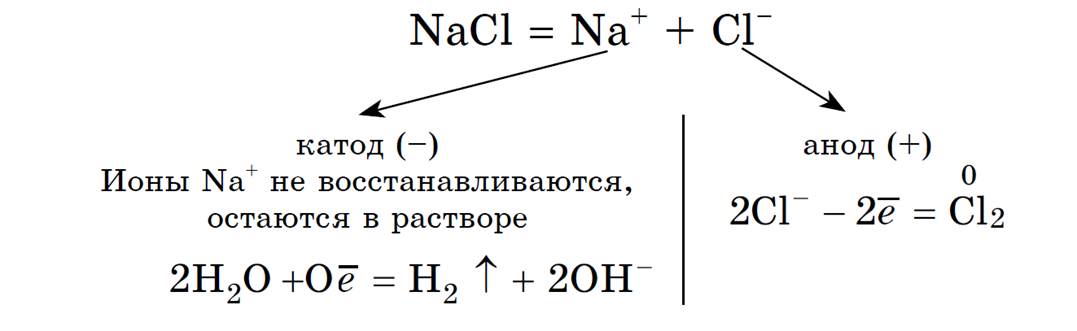
![]()
Учитывая присутствие ионов Na + в растворе, составляем молекулярное уравнение:
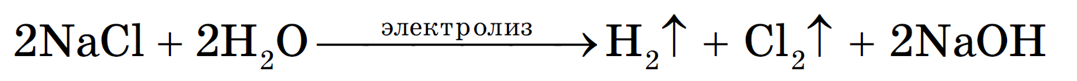
(гидроксид натрия образуется в катодном пространстве)
2. Анод растворимый (например, медный):
![]()
Если анод растворимый, то металл анода будет окисляться:
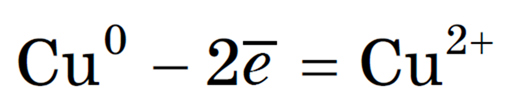
Катионы Cu 2+ в ряду напряжений стоят после (Н + ), поэтому они и будут восстанавливаться на катоде.
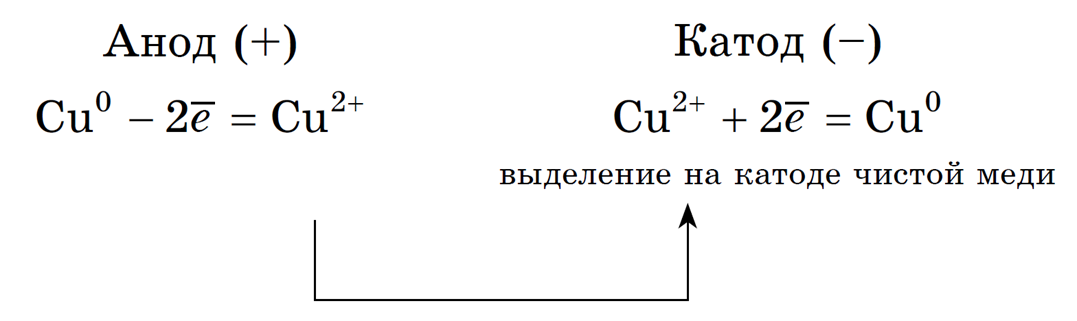
Концентрация NaCl в растворе не меняется. Рассмотрим электролиз раствора сульфата меди (II) на нерастворимом аноде:
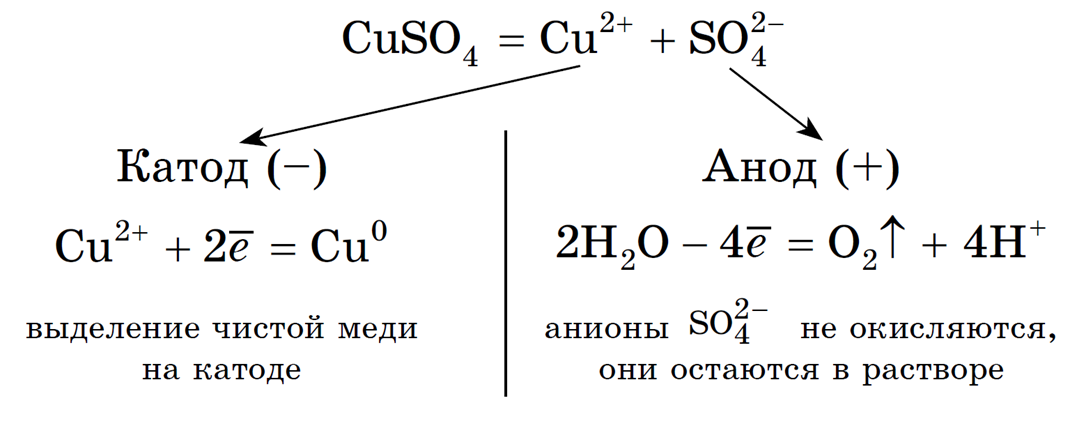
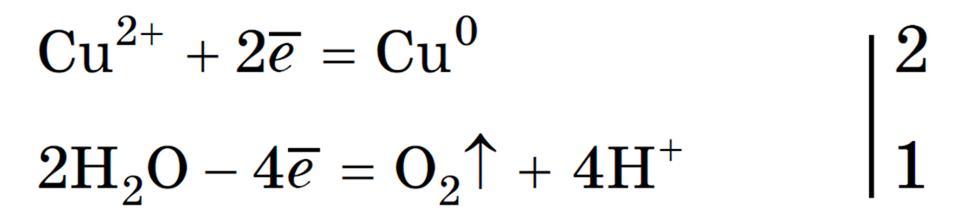
Суммарное ионное уравнение:
![]()
Суммарное молекулярное уравнение с учетом присутствия анионов SO4 2- в растворе:
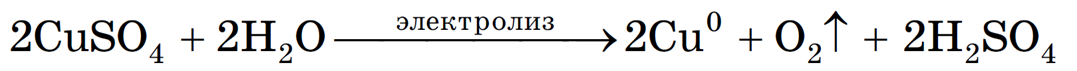
(серная кислота образуется в анодном пространстве)
Рассмотрим электролиз раствора гидроксида калия на нерастворимом аноде:

Суммарное ионное уравнение:
![]()
Суммарное молекулярное уравнение:
![]()
В данном случае, оказывается, идет только электролиз воды. Аналогичный результат получим и в случае электролиза растворов H2SO4, NaNO3, K2SO4 и др.
Электролиз расплавов и растворов веществ широко используется в промышленности.


Шпаргалка
Справочный материал для прохождения тестирования:
- ТЕГИ
- Электролиз
- Электролиз расплавленных солей
- Электролитические диссоциация и ассоциация
Источник: chem-mind.com