- ЦЕЛЬ РАБОТЫ: изучить лабораторный способ получения уксусной кислоты и характерные свойства альдегидов и карбоновых кислот.
- РАБОЧЕЕ ЗАДАНИЕ:
- получить уксусную кислоту из ацетата натрия и изучить ее свойства;
- получить из мыла жирную кислоту и изучить ее свойства;
- изучить свойства альдегидов на примере метаналя (формальдегида) или этаналя (ацетальдегида).
- ОБЩИЕ СВЕДЕНИЯ
Альдегиды – это органические вещества, в молекулах которых содержится функциональная группа (– С – Н), называемая карбонильной.||О Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов, для которых наиболее характерными являются реакции окисления и присоединения. Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:  Продуктом гидрирования альдегидов являются первичные спирты. Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт:
Продуктом гидрирования альдегидов являются первичные спирты. Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт:  Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу. Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу. Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так: 
 Например:
Например:  Более точно этот процесс отражают уравнения:
Более точно этот процесс отражают уравнения:  Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее тонкой ровной пленкой. Получается замечательное серебряное зеркало. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек. Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек. Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, Сu 2+ восстанавливается до Сu + . Образующийся в ходе реакции гидроксид меди (I) СuОН сразу разлагается на оксид меди (I) красного цвета и воду:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее тонкой ровной пленкой. Получается замечательное серебряное зеркало. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек. Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек. Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, Сu 2+ восстанавливается до Сu + . Образующийся в ходе реакции гидроксид меди (I) СuОН сразу разлагается на оксид меди (I) красного цвета и воду:  Альдегиды могут раздражать слизистые оболочки глаз и верхних дыхательных путей, вредно влиять на нервную систему. Формальдегид присутствует в организме не в свободной форме, которая токсична, а в гидратной, связанной с коферментом. Формальдегид содержится в древесном дыме и является одним из агентов, обеспечивающих консервирующее действие в ходе копчения пищевых продуктов. Бактерицидное действие формальдегида связано с его способностью реагировать с типичными для белков группами —NH—и —NH2, соединяя соседние белковые молекулы. Это приводит к повышению твердости веществ и лишает белки возможности выполнять их функции. Карбоновые кислоты – соединения, молекулы которых содержат карбоксильную группу – СООН (карбоксильная группа атомов может рассматриваться как объединение двух функциональных групп – карбонильной и гидрокисльной). Общая формула карбоновых кислот R–COOH. В отличие от альдегидов, карбонильная группа в карбоксиле неактивна, но повышает кислотность гидрокисльной группы, сдвигая на связи О-Н электронную плотность в сторону атома кислорода. При этом протон может отщепиться – кислота диссоциирует:
Альдегиды могут раздражать слизистые оболочки глаз и верхних дыхательных путей, вредно влиять на нервную систему. Формальдегид присутствует в организме не в свободной форме, которая токсична, а в гидратной, связанной с коферментом. Формальдегид содержится в древесном дыме и является одним из агентов, обеспечивающих консервирующее действие в ходе копчения пищевых продуктов. Бактерицидное действие формальдегида связано с его способностью реагировать с типичными для белков группами —NH—и —NH2, соединяя соседние белковые молекулы. Это приводит к повышению твердости веществ и лишает белки возможности выполнять их функции. Карбоновые кислоты – соединения, молекулы которых содержат карбоксильную группу – СООН (карбоксильная группа атомов может рассматриваться как объединение двух функциональных групп – карбонильной и гидрокисльной). Общая формула карбоновых кислот R–COOH. В отличие от альдегидов, карбонильная группа в карбоксиле неактивна, но повышает кислотность гидрокисльной группы, сдвигая на связи О-Н электронную плотность в сторону атома кислорода. При этом протон может отщепиться – кислота диссоциирует:  Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот: молекулы кислот в водном растворе диссоциируют, кислоты реагируют с металлами, с основными и амфотерными оксидами и гидроксидами, с солями более слабых и летучих кислот, могут образовывать кислотные оксиды (ангидриды), реагируют со спиртами. Карбоновые кислоты значительно слабее минеральных.
Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот: молекулы кислот в водном растворе диссоциируют, кислоты реагируют с металлами, с основными и амфотерными оксидами и гидроксидами, с солями более слабых и летучих кислот, могут образовывать кислотные оксиды (ангидриды), реагируют со спиртами. Карбоновые кислоты значительно слабее минеральных. 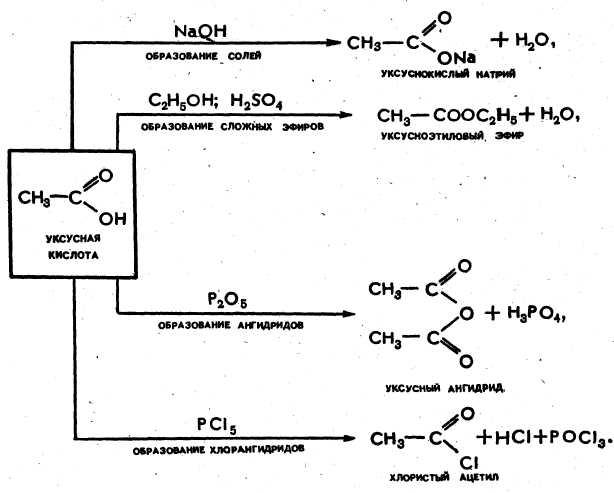 Карбоновые кислоты обладают и некоторыми специфическими свойствами, обусловленными наличием в их молекулах радикалов. Так, например, уксусная кислота реагирует с хлором:
Карбоновые кислоты обладают и некоторыми специфическими свойствами, обусловленными наличием в их молекулах радикалов. Так, например, уксусная кислота реагирует с хлором: 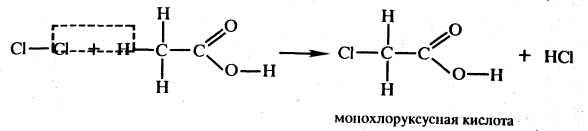
 Современный синтетический способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получается из ацетилена по реакции М.Г. Кучерова (ацетилен получается из очень доступного сырья — метана):
Современный синтетический способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получается из ацетилена по реакции М.Г. Кучерова (ацетилен получается из очень доступного сырья — метана): 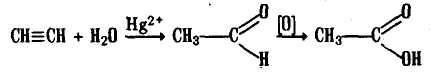 Большое значение приобретает новый способ получения уксусной кислоты, основанный на окислении бутана:
Большое значение приобретает новый способ получения уксусной кислоты, основанный на окислении бутана:  В то время как процесс получения уксусной кислоты из метана является многостадийным (метан→ацетилен→уксусный альдегид→уксусная кислота), ее получение окислением бутана сокращает число стадий, что дает большой экономический эффект. В лабораторных условиях уксусную кислоту можно получить из ацетата натрия действием серной кислоты:
В то время как процесс получения уксусной кислоты из метана является многостадийным (метан→ацетилен→уксусный альдегид→уксусная кислота), ее получение окислением бутана сокращает число стадий, что дает большой экономический эффект. В лабораторных условиях уксусную кислоту можно получить из ацетата натрия действием серной кислоты:  Уксусная кислота СН3СООН образуется при уксуснокислом брожении разбавленных водных растворов этанола, это основной компонент винного уксуса. В метаболических процессах участвует как сама кислота, так и ее соли.
Уксусная кислота СН3СООН образуется при уксуснокислом брожении разбавленных водных растворов этанола, это основной компонент винного уксуса. В метаболических процессах участвует как сама кислота, так и ее соли.
- ОБОРУДОВАНИЕ, МАТЕРИАЛЫ, РЕАКТИВЫ:
- для опыта №1 – штатив лабораторный, штатив с пробирками, пробка с газоотводной трубкой, шпатель, стеклянная палочка, химический стакан (100 мл), горелка (спиртовка), спички, фильтровальная бумага; магний (порошок), оксид магния, 20%-ный раствор гидроксида натрия, растворы серной и соляной кислот (1:1), раствор мыла, раствор лакмуса, кристаллический ацетат натрия, 10% -ный раствор карбоната натрия, вода (в стакане).
- для опыта №2 – штатив с мерными пробирками, горелка (спиртовка), спички; растворы уксусной кислоты и метаналя (1%), гранулированный цинк и магний (порошок), 10% -ный раствор гидроксида натрия, концентрированный раствор гидроксида натрия, 2%-ный раствор сульфата меди (II), свежеприготовленный 2% раствор нитрата серебра (I), раствор аммиака (5%), дистиллированная вода.
- ХОД РАБОТЫ
Опыт №1. Получение и изучение свойств уксусной кислоты
Получение искуственного шелка — интересная полимерная реакция!
Как развести 70 процентный уксус до 9 процентов таблица
Источник: studfile.net
Как получить уксусную кислоту реакцией серебряного зеркала
I. Получение карбоновых кислот
1. В промышленности
(жиров, восков, эфирных и растительных масел)
метан муравьиная кислота
н-бутан уксусная кислота
СH3-CH=CH2 + 4[O] t,kat → CH3COOH + HCOOH (уксусная кислота+муравьиная кислота )
Слева – раствор перманганата калия, справа – результат его взаимодействия с алкеном.

Рис. 1. Окисление непредельных углеводородов
- Окисление гомологов бензола (получение бензойной кислоты)
толуол бензойная кислота
1 стадия: CO + NaOH t , p → HCOONa (формиат натрия – соль )
- Ферментативное окисление водных растворов этилового спирта:

CH3CH2OH + O2 CH3COOH + H2O
- Каталитическое окисление бутана кислородом воздуха (в промышленности) (Рис. 2):

Рис. 2. Центральный пульт управления цеха уксусной кислоты (Источник)

2CH3–CH2–CH2–CH3 + 5O2 4CH3COOH + 2H2O
2. В лаборатории

R-COONa + HCl → R-COOH + NaCl
- Растворением ангидридов карбоновых кислот в воде
- Щелочной гидролиз галоген производных карбоновых кислот

3. Общие способы получения карбоновых кислот
Например, реакция «серебряного зеркала» или окисление гидроксидом меди (II) – качественные реакции альдегидов.
R-CHO + Ag2O → R-COOH + 2Ag¯


Рис. 3. Окисление альдегидов
Слева – раствор дихромата калия, справа – результат его взаимодействия с этиловым спиртом.

Рис. 4. Окисление спиртов
- Гидролиз галогензамещённых углеводородов, содержащих три атома галогена у одного атома углерода

- Из цианидов (нитрилов) – способ позволяет наращивать углеродную цепь
CH3-CN — метилцианид ( нитрил уксусной кислоты)
R-MgBr + CO2 → R-COO-MgBr H2O → R-COOH + Mg(OH)Br
II. Применение карбоновых кислот

- Муравьиная кислота – в медицине — муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
- Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
- Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
- Щавелевая кислота – в металлургической промышленности (удаление окалины).
- Стеариновая C17H35COOH и пальмитиноваякислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
- Олеиновая кислота C17H33COOH – флотореагент и собиратель при обогащении руд цветных металлов.
III. Отдельные представители одноосновных предельных карбоновых кислот
- Муравьиная кислота впервые была выделена в XVII веке из красных лесных муравьев. Содержится также в соке жгучей крапивы. Безводная муравьиная кислота – бесцветная жидкость с острым запахом и жгучим вкусом, вызывающая ожоги на коже. Применяется в текстильной промышленности в качестве протравы при крашении тканей, для дубления кож, а также для различных синтезов.
- Уксусная кислота широко распространена в природе – содержится в выделениях животных (моче, желчи, испражнениях), в растениях (в зеленых листьях). Образуется при брожении, гниении, скисании вина, пива, содержится в кислом молоке и сыре. Температура плавления безводной уксусной кислоты + 16,5°C, кристаллы ее прозрачны как лед, поэтому ее называют ледяной уксусной кислотой. Впервые получена в конце XVIII века русским ученым Т. Е. Ловицем. Натуральный уксус содержит около 5% уксусной кислоты. Из него приготовляют уксусную эссенцию, используемую в пищевой промышленности для консервирования овощей, грибов, рыбы. Уксусная кислота широко используется в химической промышленности для различных синтезов.
IV. Представители ароматических и непредельных карбоновых кислот
- Бензойная кислота C6H5COOH — наиболее важный представитель ароматических кислот. Распространена в природе в растительном мире: в бальзамах, ладане, эфирных маслах. В животных организмах она содержится в продуктах распада белковых веществ. Это кристаллическое вещество, температура плавления 122°C, легко возгоняется. В холодной воде растворяется плохо. Хорошо растворяется в спирте и эфире.
- Ненасыщенные непредельные кислоты с одной двойной связью в молекуле имеют общую формулу CnH2n-1COOH.
- Высокомолекулярные непредельные кислоты часто упоминаются диетологами (они называют их ненасыщенными). Самая распространенная из них – олеиновая СН3–(СН2)7–СН=СН–(СН2)7–СООН или C17H33COOH. Она представляет собой бесцветную жидкость, затвердевающую на холоде.
- Особенно важны полиненасыщенные кислоты с несколькими двойными связями: линолевая СН3–(СН2)4–(СН=СН–СН2)2–(СН2)6–СООН или C17H31COOH с двумя двойными связями, линоленовая СН3–СН2–(СН=СН–СН2)3–(СН2)6–СООН илиC17H29COOH с тремя двойными связями и арахидоновая СН3–(СН2)4–(СН=СН–СН2)4–(СН2)2–СООН с четырьмя двойными связями; их часто называют незаменимыми жирными кислотами. Именно эти кислоты обладают наибольшей биологической активностью: они участвуют в переносе и обмене холестерина, синтезе простагландинов и других жизненно важных веществ, поддерживают структуру клеточных мембран, необходимы для работы зрительного аппарата и нервной системы, влияют на иммунитет. Отсутствие в пище этих кислот тормозит рост животных, угнетает их репродуктивную функцию, вызывает различные заболевания. Линолевую и линоленовую кислоты организм человека сам синтезировать не может и должен получать их готовыми с пищей (как витамины). Для синтеза же арахидоновой кислоты в организме необходима линолевая кислота. Полиненасыщенные жирные кислоты с 18 атомами углерода в виде эфиров глицерина находятся в так называемых высыхающих маслах – льняном, конопляном, маковом и др.Линолевая кислота C17H31COOH и линоленовая кислота C17H29COOH входят в состав растительных масел. Например, льняное масло содержит около 25% линолевой кислоты и до 58% линоленовой.
- Сорбиновая(2,4-гексадиеновая) кислота СН3–СН=СН–СН=СНСООН была получена из ягод рябины (на латыни – sorbus). Эта кислота – прекрасный консервант, поэтому ягоды рябины не плесневеют.
- Простейшая непредельная кислота, акриловаяСН2=СНСООН, имеет острый запах (на латыни acris – острый, едкий). Акрилаты (эфиры акриловой кислоты) используются для получения органического стекла, а ее нитрил (акрилонитрил) – для изготовления синтетических волокон.
- Называя вновь выделенные кислоты, химики, нередко, дают волю фантазии. Так, название ближайшего гомолога акриловой кислоты, кротоновойСН3–СН=СН–СООН, происходит вовсе не от крота, а от растения Croton tiglium, из масла которого она была выделена. Очень важен синтетический изомер кротоновой кислоты –метакриловая кислота СН2=С(СН3)–СООН, из эфира которой (метилметакрилата), как и из метилакрилата, делают прозрачную пластмассу – оргстекло.
- Непредельные карбоновые кислоты способны к реакциям присоединения:
Две последние реакции протекают против правила Марковникова.
Непредельные карбоновые кислоты и их производные способны к реакциям полимеризации.
V. Тренажеры
ЦОРы
Источник: kardaeva.ru
Как получить уксусный альдегид
Уксусный альдегид (другие названия – этаналь, ацетальдегид) имеет химическую формулу CH3COH. Внешний вид – прозрачная бесцветная жидкость, с резким «обжигающим» запахом. Кипит при комнатной температуре. Легко растворяется в воде, и некоторых органических веществах. Широко распространен в природе, встречается в большинстве растений, продуктов питания.
Каким образом можно синтезировать это вещество?

Статьи по теме:
- Как получить уксусный альдегид
- Как получить этан из метана
- Как получить уксусную кислоту из метана
Инструкция
Самый распространенный и эффективный способ получения уксусного альдегида – окисление этилена. Реакция протекает таким образом:
2С2Н4 + О2 = 2СН3СОН
Синтез идет с использованием катализатора – хлористого палладия. Причем, если проводить прямое окисление этилена кислородом, он протекает медленно. Поэтому, в реакционную массу добавляют соли меди двухвалентной, чтобы она окисляла палладий, переходя сама в одновалентную медь, тут же окисляемую кислородом. То есть, медь в этом синтезе служит как бы переносчиком кислорода. Эта реакция получила название «Вакер-процесс».
Уксусный альдегид также можно получить, проведя гидратацию ацетилена. Такой синтез, проходящий в присутствии солей ртути, получил название «реакция Кучерова». Он протекает следующим образом:
C2H2 + H2O = CH3COН
В лаборатории уксусный альдегид можно получить также, используя в качестве сырья этиловый спирт, это способ, который многие посчитают чуть ли не святотатством. Реакция протекает таким образом:
С2Н5ОН = СН3СОН + Н2
То есть, для получения этаналя, осуществляется дегидрирование этанола при высокой температуре, с использованием катализаторов (медных или серебряных).
Можно не «отщеплять» водород у этанола, а подвергнуть его окислению, также при высоких температурах и тех же катализаторах. Тогда реакция пойдет следующим образом:
2С2Н5ОН + О2 = 2СН3СОН + 2Н2О
Источник: www.kakprosto.ru