КРОВАВО-КРАСНЫЙ И ХРУПКИЙ гематит — очень ЦЕННАЯ РУДА, из которой получают железо. Гематит сыграл немаловажную роль в ТЕХНОЛОГИЧЕСКОМ ПРОГРЕССЕ человечества.

Гематит.
Можно без преувеличения сказать, что на гематите держится современный мир. Он почти на 70 % состоит из железа — металла, из которого производят сталь. Гематит добывают повсеместно. Благодаря относительно легкому способу добычи и выплавки железа, а также прочности и универсальности этого металла без него не обходится ни один строительный объект.
Производство железа превратилось в огромную отрасль мировой промышленности.
Более твердый, но при этом и более хрупкий по сравнению с железом гематит получил свое название от греческого слова кровь .
Цвет черты, которую оставляет минерал, — красный, однако его облик весьма разнообразен.
Серую разновидность гематита с металлическим блеском называют спекуляритом. Кристаллы спекулярита обычно имеют форму ромбоэдров, но встречаются и в виде тонких чешуек — это так называемый слюдяной гематит (железная слюдка). Красная стеклянная голова — это плотные почковидные скопления гематита.
Как сделать железо доступным для растений

Гематит и Марс.
В БЕЗОБЛАЧНУЮ НОЧЬ в нашем небе можно наблюдать Марс, бросающий на Землю кровавый отсвет. Из-за этой окраски планета была названа в честь древнеримского бога войны. Причина необычного оттенка Марса весьма прозаична, ведь он скорее ржавый, чем кровавый. Все дело в оксиде железа, покрывающем поверхность планеты. Максимальная толщина слоя охристой пыли (то есть порошкового гематита) составляет всего 2 м. То, что эта пыль состоит из гематита, подтвердили данные спектрометра на борту станции Марс Глобал Сервейор в 2001 году. Марсоход Оппортьюнити обнаружил маленькие шарики гематита на поверхности Марса — их прозвали ягодами черники .
На основе этой находки ученые предположили, что некогда Марс был влажной планетой, ведь подобные кристаллы могли образоваться только под воздействием воды!
Гематит может иметь осадочное происхождение — мелкие глинистые зерна называют красной охрой.
Подобный минерал часто встречается в железистых кварцитах.
В осадочных месторождениях гематит обычно смешан с силикатными минералами, поэтому перед выплавкой его необходимо обогатить. Для обогащения измельченную железную руду опускают в ванну со специальным раствором, в котором частички минерала, содержащие железо, идут на дно, а силикаты всплывают на поверхность, после чего их удаляют.
КРОВАВИК
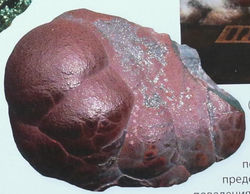
Кровавик.
Люди использовали гематит задолго до того, как открыли технологию получения железа. Красный порошковый гематит был известен в каменном веке в Пиннакл-Пойнт (Южная Африка). Данное открытие пошатнуло общепринятое представление о развитии символического поведения (то есть способов передавать информацию в форме знаков). Раскопки, начатые в 2000 году, поставили под сомнение популярную гипотезу о том, что ритуальное раскрашивание тела, наскальные рисунки и письмо появились относительно недавно. В Европе красную охру,
Делаю железо из камня
которой расписывали гончарные изделия, добывали в Польше и Венгрии с 5000 года до н. э.

Намного позже так называемый крокус — очищенную форму измельченного гематита — стали использовать для полировки стекла, драгоценных камней и ювелирных изделий, а спекулярит превращали в украшения, имевшие особый спрос в Викторианскую эпоху.
ОТКРЫТИЕ ТЕХНОЛОГИИ ВЫПЛАВКИ ЖЕЛЕЗА стало поворотной точкой в истории человечества. Железный век был эпохой, когда люди научились добывать и обрабатывать железо.
Железные предметы датируются 3000 годом до н. э., но ученые считают, что железная металлургия возникла в Анатолии (территория современной Турции) примерно в 1200 году до н. э. Получить железо из руды сложнее, чем медь, кроме того, в отличие от меди и олова, железо практически не поддается холодной обработке. Чтобы приручить железо, человечество накапливало опыт несколько тысячелетий бронзового века.

Металлурги у знаменитой старинной печи вАйрон-Бридж (Великобритания) разливают расплавленный металл в чушки.
Овладение технологией получения железа из руды позволило производить более прочное оружие и орудия труда, а также способствовало развитию искусства и культуры.
Руду, содержащую более 60 % железа, можно загружать прямиком в доменную печь. На фото справа металлурги у знаменитой старинной печи вАйрон-Бридж (Великобритания) разливают расплавленный металл в чушки.
По материалам журнала Чудеса природы, смотрите на сайте статью об этом журнале.
- Энергия Камней №48. Белый кварц
- Кварц — горный хрусталь
- Природные оксиды (окислы)
- Минералы. Сокровища земли
- Энергия камней №1. Голубой агат (окатанный камень)
- Энергия камней
- Энергия Камней №47. Топаз
Источник: www.treeland.ru
Как из железной окалины получить железо
Смесь оксидов железа, образовывающаяся при взаимодействии кислорода с раскалённым металлом, имеет обобщённое название — железная окалина. Она состоит из Fe3O4, FeO и Fe2O3 (магнетита, вьюстита и гематита соответственно) и представлена двумя легкоотделяемыми друг от друга слоями. При их суммарной толщине до 40 нм окалина невидима невооружённому взгляду, свыше 40 и до 500 нм — выдаёт себя цветами побежалости (радужным отливом). Постоянный же окрас появляется, если слой железной окалины на металле превышает 500 нм.

Состав
Наружный слой оксида железа — гематит. Он обладает большой твёрдостью (1030 ед. по шкале Виккерса), абразивностью и очень плохо растворяется в кислотах. Под ним в условиях частичной нехватки кислорода формируется более мягкий и почти нерастворимый в кислотах магнетит. Ближе всего к металлу находится рыхлый и мягкий вьюстит, который легко поддается устранению механическим путём или кислотным травлением.
Толщина каждого из трёх слоёв зависит от температуры обработки стали. Так, при превышении порога в 570 °C образуется чётко выраженная трёхслойная структура окалины. Дальнейшее повышение температуры ведёт к увеличению толщины вьюстита. Если же сталь обрабатывается при температурах ниже 570 °C, то в составе окалины преобладают магнетит и гематит.
По цвету железной окалины можно определить температуру обработки стали. Так, при температуре в 700–750 °C в составе окалины больше гематита, из-за чего она приобретает рыжевато-красный оттенок. Образовавшийся при высокотемпературном (900–1000 °C) прокате слой оксидов из-за более высокого процента вьюстита становится чёрным.
Особенности
Твёрдость окалины сочетается с её хрупкостью, из-за чего вкрапления оксида внутри структуры металла резко понижают его эксплуатационные характеристики. По этой же причине железная окалина не может быть использована в качестве защитного покрытия, хоть она и не взаимодействует с кислородом. Более того, в месте скола оксидов наблюдается усиленное окисление стали, что происходит из-за разности потенциалов окалины и стали. По этой причине её удаляют с готового проката.
Удаление окалины
Слой оксидов железа с прокатной стали удаляют со стальной заготовки несколькими способами.
- механическая;
- химическая;
- электрохимическая.
Возможно также сочетание вариантов.
Механическое воздействие на прокат сводится к пропуску проволоки или листа с окалиной через ряд роликов. При этом достигается частое изгибание заготовки, под воздействием которого железная окалина рассыпается на отдельные чешуйки и осыпается с металла. Для финишной очистки могут быть использованы абразивы, наждачные ленты, щётки из проволоки.
Достоинством этой технологии является сравнительная дешевизна и экологичность. Но поскольку отказ от смазки при такой обработке нецелесообразен, это приводит к замасливанию железной окалины, что затрудняет дальнейшую её переработку.
Читать также: Как отклеить пальцы от суперклея
Химический и электрохимический способы очистки стали называют травлением. Для этих целей используются серная и соляная кислоты, реже — фосфорная, азотная, плавиковая или их смесь. Главными недостатками такого способа является одноразовое использование травильных растворов (не восстанавливаются) и низкий спрос на побочный продукт преобразования окалины — железный купорос. По этой причине травление применяется довольно редко, и ему обычно предшествует механическая очистка проката от окалины.
Применение окалины
Опытными кузнецами давно было примечено повышение сопротивляемости металла коррозии при формировании на нём тонкого слоя окалины. Сейчас же воронение оружейной стали используется лишь в качестве декоративной отделки. Её цвет зависит от способа обработки (кислота, щёлочь, температура) и толщины оксидной плёнки, составляющей от 1 до 10 мкм.

Прокатная окалина, удельный вес которой достигает 3% от общего веса готовых изделий, является ценным сырьём для металлургического производства за счёт высокого содержания (до 75%) в ней железа. Основное направление её переработки — очистка от примесей и восстановление, после которого она превращается в низкоуглеродистую сталь.
Некоторые составы окалины успешно применяются в качестве красящих пигментов и активно используются в строительстве. Также из окалины производится железный порошок, применяемый в металлургии, при изготовлении самонагревающихся смесей и даже в пищевой промышленности.
Химический состав этого отхода металлургической промышленности стандартизирован. Её стоимость может колебаться в зависимости от преобладания определённых видов окислов и количества примесей. Усреднённая цена на начало 2019 года составляла 50 американских долларов за тонну железной окалины.
В свободном состоянии железо – серебристо-белый металл с сероватым оттенком. Чистое железо пластично, обладает ферромагнитными свойствами. На практике обычно используются сплавы железа – чугуны и стали.
Fe – самый главный и самый распространенный элемент из девяти d-металлов побочной подгруппы VIII группы. Вместе с кобальтом и никелем образует «семейство железа».
При образовании соединений с другими элементами чаще использует 2 или 3 электрона (В = II, III ).
Железо, как и почти все d-элементы VIII группы, не проявляет высшую валентность, равную номеру группы. Его максимальная валентность достигает VI и проявляется крайне редко.
Наиболее характерны соединения, в которых атомы Fe находятся в степенях окисления +2 и +3.
Железо – химический элемент
1. Положение железа в периодической таблице химических элементов и строение его атома
Железо – это d- элемент VIII группы; порядковый номер – 26; атомная масса Ar ( Fe ) = 56; состав атома: 26-протонов; 30 – нейтронов; 26 – электронов.
Схема строения атома:
Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Читать также: Приспособление для высверливания болтов
Металл средней активности, восстановитель:
Fe 0 -2 e – → Fe +2 , окисляется восстановитель
Fe 0 -3 e – → Fe +3 , окисляется восстановитель
Основные степени окисления: +2, +3
2. Распространённость железа
Железо – один из самых распространенных элементов в природе . В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию. Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила автоматическая станция “Луна”, обнаружено железо в неокисленном состоянии.
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа.
Основными железными рудами являются :
магнетит (магнитный железняк) – Fe3O4 содержит 72% железа, месторождения встречаются на Южном Урале, Курской магнитной аномалии:


гематит (железный блеск, кровавик)– Fe2O3 содержит до 65% железа, такие месторождения встречаются в Криворожском районе:


лимонит (бурый железняк) – Fe2O3*nH2O содержит до 60% железа, месторождения встречаются в Крыму:

пирит (серный колчедан, железный колчедан, кошачье золото) – FeS2 содержит примерно 47% железа, месторождения встречаются на Урале.

3. Роль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO2.
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет.
Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
4. Физические свойства железа.
Железо – это серебристо-белый металл с температурой плавления 1539 о С. Очень пластичный, поэтому легко обрабатывается, куется, прокатывается, штампуется. Железо обладает способностью намагничиваться и размагничиваться, поэтому применяется в качестве сердечников электромагнитов в различных электрических машинах и аппаратах. Ему можно придать большую прочность и твердость методами термического и механического воздействия, например, с помощью закалки и прокатки.
Читать также: Как тестером проверить напряжение в машине
Различают химически чистое и технически чистое железо. Технически чистое железо, по сути, представляет собой низкоуглеродистую сталь, оно содержит 0,02 -0,04% углерода, а кислорода, серы, азота и фосфора – еще меньше. Химически чистое железо содержит менее 0,01% примесей. Химически чистое железо – серебристо-серый, блестящий, по внешнему виду очень похожий на платину металл.
Химически чистое железо устойчиво к коррозии и хорошо сопротивляется действию кислот. Однако ничтожные доли примесей лишают его этих драгоценный свойств.
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
6. Химические свойства железа
Как элемент побочной подгруппы железо может проявлять несколько степеней окисления. Мы рассмотрим только соединения, в которых железо проявляет степени окисления +2 и +3. Таким образом, можно говорить, что у железа имеется два ряда соединений, в которых оно двух- и трехвалентно.
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
2) Накалённая железная проволока горит в кислороде, образуя окалину – оксид железа (II,III) – вещество чёрного цвета:
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
4) Железо реагирует с неметаллами при нагревании:
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании
На холоде концентрированные азотная и серная кислоты пассивируют железо!
7) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
8) Качественные реакции на
Основная часть получаемого в мире железа используется для получения чугуна и стали — сплавов железа с углеродом и другими металлами. Чугуны содержат около 4% углерода. Стали содержат углерода менее 1,4%.
Чугуны необходимы для производства различных отливок — станин тяжелых машин и т.п.
Стали используются для изготовления машин, различных строительных материалов, балок, листов, проката, рельсов, инструмента и множества других изделий. Для производства различных сортов сталей применяют так называемые легирующие добавки, которыми служат различные металлы: М n , С r , Мо и другие, улучшающие качество стали.
Задания для закрепления
№1. Составьте уравнения реакций получения железа из его оксидов Fe2O3 и Fe3O4 , используя в качестве восстановителя:
а) водород;
б) алюминий;
в) оксид углерода (II).
Для каждой реакции составьте электронный баланс.
№2. Осуществите превращения по схеме:
Fe2O3 -> Fe – +H2O, t -> X – +CO, t -> Y – +HCl -> Z
Назовите продукты X, Y, Z?
Источник: technictrends.ru
Как получить железо из гематита

В ключевое отличие между магнетитом и гематитом заключается в том, что железо в магнетите находится в степенях окисления +2 и +3, тогда как в гематите оно находится только в степени окисления +3.
Магнетит и гематит — минералы железа. Оба имеют железо в разных степенях окисления и находятся в форме оксидов железа. Еще одно важное различие между магнетитом и гематитом заключается в том, что магнетит имеет черный цвет, но гематит имеет множество цветов.
1. Обзор и основные отличия
2. Что такое магнетит
3. Что такое гематит
4. Сравнение бок о бок — магнетит и гематит в табличной форме
5. Резюме
Что такое магнетит?
Магнетит — это оксид железа с химической формулой Fe.3О4. Фактически это смесь двух оксидов железа, FeO и Fe.2О3. Следовательно, мы можем представить его как FeO · Fe2О3. Согласно номенклатуре IUPAC, его название — оксид железа (II, III). Но обычно мы называем это оксидом железа и железа.
Магнетит получил свое название, потому что это магнит.

Магнетит имеет черный цвет, и его полоса также черная. От металлического до тусклого блеска. По шкале Мооса его твердость составляет 5,5 — 6,5. Магнетит имеет октаэдрическую кристаллическую структуру, но мы редко можем увидеть типы ромбододекаэдра. На нем виден неровный перелом.
Более того, магнетит обычно встречается в Южной Африке, Германии, России и во многих местах США. Это также существует в метеоритах. Магнетит широко известен благодаря своим магнитным свойствам. Кроме того, это сорбент, поэтому он полезен для очистки воды. Более того, мы можем использовать его как катализатор и как материал покрытия.
Что такое гематит?
Это оксид железа, содержащий ион Fe (3+). Следовательно, он имеет молекулярную формулу Fe2О3. Это минерал, который может иметь несколько цветов. Минерал имеет полупрозрачный или непрозрачный характер. Встречается в красном, коричневом, красновато-коричневом, спине или серебристом цвете.
Однако все эти типы минералов гематита имеют одинаковую красновато-коричневую полосу. На самом деле гематит получил свое название из-за кроваво-красного цвета, который он имеет, когда находится в форме порошка.

По шкале Мооса его твердость 5-6. Гематит хрупкий, но тверже чистого железа. Гематит имеет ромбододекаэдрическую кристаллическую структуру. Это показывает нерегулярный / неровный перелом. При более низких температурах гематиты обладают антиферромагнитными свойствами.
Но при более высоких температурах проявляется парамагнетизм. Как показано ниже, существует несколько разновидностей гематита.
- Гематитовая роза — кристалл, расположенный в форме цветка розы.
- Почечная руда — имеет вид почечных масс.
- Тигровое железо — это очень старые месторождения. В месторождении чередуются слои серебристо-серого гематита и красной яшмы.
- Спекулярит — сверкающий серебристо-серый цвет; поэтому полезен как украшение.
- Гематит оолитовый — с округлыми зернами. Он имеет красновато-коричневый цвет и землистый блеск.
Гематит встречается в Англии, Мексике, Бразилии, Австралии и в районе Верхнего озера. Это важно для украшений и украшений.
В чем разница между магнетитом и гематитом?
Кроме того, есть разница между магнетитом и гематитом и в цвете. Магнетит имеет черный цвет, но гематит бывает разных цветов. Однако магнетит имеет черную полосу, а гематит — красновато-коричневую полосу. Еще одно различие между магнетитом и гематитом состоит в том, что гематит является компонентом ржавчины, а магнетит — нет.
Более того, если учесть магнитные свойства двух минералов, магнетит является от природы сильным магнитом, но в гематите магнетизм возникает при нагревании. В дополнение к этому, еще одним отличием магнетита от гематита является их структура. Гематит имеет ромбододекаэдрическую кристаллическую структуру, тогда как магнетит обычно имеет октаэдрическую кристаллическую структуру.

Резюме — Магнетит против гематита
Магнетит и гематит — важные оксиды железа. Хотя между ними есть несколько различий, ключевое различие между магнетитом и гематитом заключается в том, что железо в магнетите находится в степенях окисления +2 и +3, тогда как в гематите оно находится только в степени окисления +3.
Источник: ru.strephonsays.com