Соляная кислота применяется в изготовлении некоторых ВВ. Сейчас
является перекурсором, и приобрести ее в Химмаге не получится. Но ее
достаточно просто изготовить в домашних условиях. Химически чистая
концентрированная соляная кислота бесцветная, дымящаяся на воздухе
жидкость (выделяется хлороводород) с резким запахом. Плотность соляной
кислоты составляет 1.19, при концентрации 37 %.
Реактивы:
NaCl – поваренная соль. В принципе подойдет любой хлорид, KCl например.
H2SO4 – серная кислота. Обязательно
концентрированная (обугливает спичку в холодном состоянии), вполне
подойдет выпаренный электролит.
Защитное снаряжение:
Соляная кислота – ЗЛО! При попадании на кожу вызывает химические
ожоги. На одежду ей тоже не следует попадать – разъедает мгновенно.
Хлороводород ядовит! Получение соляной кислоты лучше производить на
открытом воздухе или в хорошо проветриваемом помещении.
Минимум защитных средств:
Как сделать соляную кислоту. Самый простой способ.
1. Резиновые перчатки (лучше как на фото).
2. Противогаз ну или респиратор (поможет вам быстро ликвидировать последствия возможной аварии без вреда для здоровья).
Оборудование:
1. Электрическая плитка или другой источник тепла.
2. Весы.
3. Мерный стакан.
4. Реакционный сосуд, я использовал плоскодонную колбу на 250 мл.
5. Предохранительная склянка. Прекрасно подойдет любая колба, (главное,
чтобы объем склянки не был меньше объема получаемой кислоты).
6. Пара резиновых пробок.
7. Трубки, можно использовать трубки от капельниц.
В итоге должен получиться вот такой прибор.
Правда тут есть пара нюансов:
1. Трубки, используемые в приборе должны быть одного диаметра, лучше
отказаться от использования иголок от шприцов в качестве штуцеров. Это
создаст разность в давлении и аппарат рванет (у меня так и случилось при
использовании иглы от шприца).
2. Трубку, из которой идет HCl лучше не опускать в воду, так как вода
может быть засосана в систему из-за большой растворимости HCl.
3. Предохранительная склянка в принципе необязательна, можно и без нее,
но если воду засосет в реакционную колбу и она может лопнуть,
разбрызгивая горячую серную кислоту.
Изготовление:
1. Отвешиваем соль примерно 10-20 граммов. Кислоты возьмите примерно
столько же 10-15 миллилитров. Я написал примерно потому что количество
кислоты зависит от ее концентрации. Я брал 1 : 1 по объему. Если кислота
60-80%, то хлороводород сначала растворится в воде, а только потом
будет выделяться.
Короче говоря, МЕНЬШЕ ВОДЫ – Меньше ПРОБЛЕМ!
Так что лучше потратить побольше времени на выпаривание электролита.
2. Помещаем соль в реакционную колбу.
3. Собираем установку, проверяем все соединения, они должны быть герметичны.
4. Наливаем в мерный стакан 50-100 мл. воды (желательно дистиллированной) и вставляем в него трубку.
СОЛЯНАЯ КИСЛОТА ЗА 5 МИНУТ! КАК СДЕЛАТЬ В ДОМАШНИХ УСЛОВИЯХ.
5. Надеваем противогаз.
6. Теперь главное быстро налить серную кислоту в реакционную колбу и
заткнуть горлышко газоотводной трубкой. Противогаз спасет вас от
хлороводорода, который начнет выделяться.
7. Сначала реакция идет сама, потом колбу нужно чуть-чуть нагреть.
NaCl + H2SO4 → Na2SO4 + 2HCl↑
Далее приведены фотографии прибора и всего процесса:
Таким способом можно получить кислоту максимальной концентрации
37-40%. В процессе получения вы увидите, как объем воды, которую вы
налили в стакан начнет увеличиваться. Продолжайте насыщать воду до тех
пор, пока газ не перестанет растворятся.
Хранить кислоту нужно в плотно закрытой таре, во избежании улетучивания HCl.
УДАЧИ!
Источник: how-make.ru
Получение соляной кислоты в домашних условиях

Алхимики, впервые получившие соляную кислоту в 15 веке, назвали её «spiritus salis», «дух из соли». Эта кислота обладала на тот момент волшебными свойствами: разъедала бумагу, растворяла металлы, отравляла людей. Эти свойства остались у неё и по сей день, но сейчас эта кислота достаточно изучена, и волшебства здесь нет.
Соляная кислота (HCl) — сильная одноосновная кислота, в чистом виде — прозрачная жидкость. При своей максимальной концентрации 38% «дымит» на воздухе. Мы же будем получать кислоту с концентрацией вдвое меньшей.
Итак, приступим.
Техника безопасности
Осторожно, работа с ядовитыми веществами!
Все опыты необходимо проводить в хорошо вентилируемом помещении либо под вытяжкой, Обязательно в защитных очках (можно приобрести в строй. магазине) и перчатках (если не найдёте специальные химические перчатки, подойдут хорошего качества для мытья посуды).

На месте проведения опыта обязательно должна присутствовать пищевая сода, чтобы в непредвиденной ситуации нейтрализовать ею кислоту (при этом выделится углекислый газ и вода).
Строго запрещено проводить эксперимент в металлической посуде.
Понадобится
- Кислотный электролит для аккумуляторов (продаётся в автомагазине);
- Дистиллированная вода (там же);
- Поваренная соль (есть на любой кухне);
- Пищевая сода (см. технику безопасности).

- Стеклянная колба;
- Сосуд с песком, куда можно колбу поместить;
- Несколько одноразовых стаканчиков 200 мл;


Если Вы располагаете термостойкой колбой, то можно нагревать её под открытым пламенем горелки. Но всё же рекомендую через песок, в случае чего он впитает в себя кислоту.
Также понадобятся пара сантехнических уголков диаметром 50 мм и горелка (в моём случае спиртовая, но рекомендую использовать газовую).

1 этап — выпаривание
Электролит для аккумуляторов — самая что ни на есть 36%-ая серная кислота (H2SO4). Вначале нам необходимо повысить её концентрацию.
Наливаем в стаканчик 200 мл, то есть почти до краёв и переливаем чуть больше половины стаканчика в колбу. Делаем маркером метку и доливаем остальное.

Поставил вокруг колбы отражатель из фольги для более эффективного нагревания, но позже снял, ибо начал плавиться.
Теперь ставим колбу на горелку и выпариваем до уровня поставленной ранее метки, даже чуть ниже.

Параллельно надеваем на уголок сложенную в несколько раз марлю и фиксируем резинкой. Готовим ненасыщенный раствор соды и макаем в него конец уголка с марлей.

Когда электролит начнёт кипеть, надеваем на колбу уголок, он плотно на неё садится. Марлевый конец направляем в открытое окно.

Это необходимо, если вдруг вместе с водой начнёт испаряться сама серная кислота. Если сильно не перегревать колбу, этого не произойдёт.
Горелка в действии:

Мощность моей горелки сравнительно мала, поэтому выпаривание заняло около часа. Газовая горелка или электрическая плита значительно бы ускорили этот процесс.
После завершения первого этапа в колбе должно остаться чуть меньше половины раствора, то есть кислота концентрацией около 75%. Не забываем про аккуратность.

Даём ей остыть до комнатной температуры.
2 этап — вычисления
Теперь, когда у нас есть концентрированная серная кислота, можем провести основную реакцию, она выглядит следующим образом:
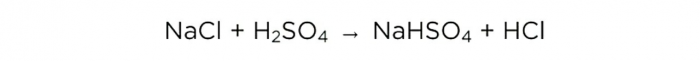
Но прежде давайте проведём некоторые вычисления, а в конце сравним их с тем, что получилось на практике.
Итак, изначально у нас было 200ml электролита плотностью 1,27 г/см³. Заглянув в таблицу плотностей серной кислоты увидим, что данная плотность соответствует концентрации 36%. Вычислим объём кислоты:
200ml*36%=72ml — V(H2SO4)
После того, как мы выпарили раствор, его концентрация, а соответственно, и плотность увеличилась. Глядим в ту же таблицу и видим, что концентрации 75% соответствует плотность 1,67 г/см³.
Зная текущую плотность(p) и объём(V) кислоты узнаем массу:
m=p*V;
m(H2SO4)=1,67г/см³ * 72ml=120г;
Теперь из школьной химии вспоминаем:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
где M — молярная масса вещества.
Молярные массы H2SO4, NaCl и HCl соответственно равны 98, 58.5 и 36.5 г/моль. Теперь мы можем узнать, сколько понадобится поваренной соли и сколько получится HCl.
А именно нам понадобится 72г NaCl, это 34 мл, возьмём в избытке — четверть стаканчика.
Отлично, а HCl в теории выйдет 44,7г.
В таблице плотностей HCl есть столбец г/л. Берём оттуда значение для концентрации 15% — 166,4 г/л. Объём воды, необходимый для получения 15% HCl равен 44,7/166,4≈270ml. Мы возьмём 200ml. В итоге в теории у меня выйдет 22%-ная соляная кислота.
3 этап — получение кислоты
Соединяем два уголка следующим образом:

А вся конструкция будет выглядеть так:

В сосуд с надписью HCl будет конденсироваться соответствующая кислота, объём воды в нём — 200ml. Также на этом сосуде отметьте текущий уровень жидкости.
Снимаем уголки и через воронку засыпаем в колбу вычисленное в расчётах количество соли.

Раствор желтеет.

Чтобы соляная кислота начала выделяться, необходимо включить горелку. Но вначале плотно присоединяем к колбе и получающему сосуду уголки.
При конденсации кислоты в воде, образуются “вертикальные волны”. Также при этом раствор нагревается, и его надо охлаждать. Например, можно снизу поставить ещё один сосуд со льдом.
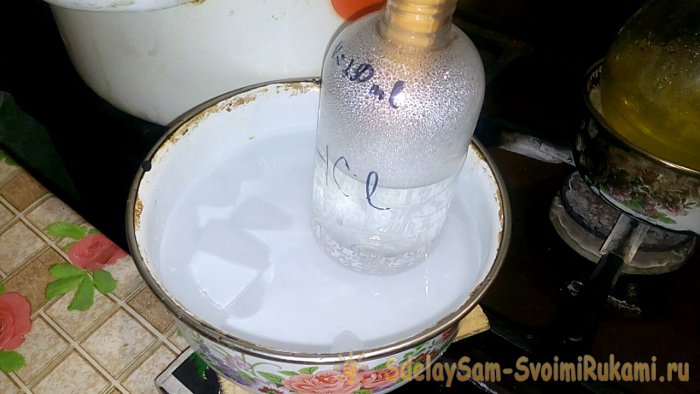
Реакция протекает относительно быстро — 20 минут, после чего можно выключать огонь. Даём последним парам соляной кислоты раствориться в воде, после чего герметично закрываем сосуд. Когда колба остынет, разбавляем оставшийся там раствор водой (примерно один к одному) и сливаем его в канализацию.
Итог

По метке на сосуде определяем, сколько жидкости прибавилось. У меня это ⅙, то есть 17%. Это и есть концентрация нашей соляной кислоты. Сравним её с той, которая получается в теории.
17%/22%*100%=77% — выход реакции.
Важно отметить, выхода равного 1 не бывает, всегда есть потери. В моём случае это недостаточно выпаренный электролит. В идеале концентрация серной кислоты должна быть 90-95%.
Проверим получившуюся кислоту на взаимодействие с металлом.

Наблюдаем бурное выделение водорода. Это означает, что кислота пригодна для дальнейших экспериментов.
Вариации
В качестве колбы можно воспользоваться чистой стеклянной бутылкой из-под пива или газировки, но при условии, что нагревание будет максимально плавным. Вместо ПВХ уголков можно взять полипропиленовые трубы и уголки меньшего диаметра (подходящего под Вашу колбу).
Ещё раз призываю соблюдать технику безопасности. Всем удачных опытов!
Источник: sdelaysam-svoimirukami.ru
Как приготовить соляную кислоту в домашних условиях для аффинажа серебра

Alex
Архиварий
Сообщений: 155
Темы: 5
Понравилось другим: 1 в 1 постах
Понравилось самому: 0
У нас с: Mar 2014
#2
31-03-2015, 11:09
Властелин колец Добавка любого хлорида в серную кислоту. Пока что самый практичный лабораторный способ. Пример конечной реакции
NaCl + H2SO4 = HCl + NaHSO4
из минусов — это дороговизна и желательная последующая очистка. Если нет желания перегонять, то могу посоветовать вместо поваренной соли хлорид кальция. После реакции с серной кислотой он просто упадёт гипсом и очистить раствор очень даже просто простой фильтровкой.
Реакция которую ты написал идет при комнатной температуре. Образуется хлороводород и гидросульфат натрия:
H2SO4 + NaCl = NaHSO4 + HCl (газ)

При нагревании реакция идет с образованием сульфата натрия и выход HCl удваивается :
H2SO4 + 2NaCl = Na2SO4 + 2HCl (газ)
Никаких особых минусов я не замечаю, т.к.
1. Если предварительно протравливать сырье в азотке, то расход соляной кислоты будет невелик, и ее относительная дороговизна большой роли не играет.
2. Полученная таким образом соляная кислота конечно будет содержать в себе небольшое количество серной кислоты. Но в нашем случае это скорее плюс, ибо ты сам писал в теме»растворение и осаждение золота в растворе царской водки»
Властелин колец теперь переливаем наш раствор в посудину для выпаривания и добавляем немного серной кислоты.
Во первых это поможет осадить свинец и в какой то степени хлорид серебра.
Во вторых уменьшает вероятность опадания золота в виде соли
В третьих значительно ускорит процесс выпаривания азотки.
Немного это немного, не пероборщите с серной кислотой но хотя бы пару капель стойт добавить. Хотя я всё же постараюсь дать какие нибудь точные цифры.
Вроде как было бы правильно добавлять не более 56мл серной кислоты в расчёте на 1л раствора царской водки.
ВКЦ 
Дед Мазай что ли? 






Сообщений: 3,207
Темы: 258
Понравилось другим: 200 в 181 постах
Понравилось самому: 147
У нас с: Nov 2016
#3
31-03-2015, 13:51
Извини, не совсем понял твоего сообщения
Да с серной реакция идёт при комнатной температуре, а из гидросульфата серную выбить нужна уже совсем немалая температура.
Чистка всё же желательна или дистилляцией или хотя бы кристаллизацией (что вообще любой сможет сделать).
Присутствие серной кислоты в растворе в разумных пределах нам действительно не помешает, а вот дикое количество гидросульфата уже напрашивается на неприятности.
К тому же без дистилляции (с сопутствующим нагревом) будет не соляная кислота с небольшим количеством серной, а с очень большим количеством серной кислоты (+ессно соответствующий сульфат)
Источник: alhimika.net