Коррозией называется самопроизвольное разрушение металлов и сплавов в результате химического взаимодействия их с окружающей средой.
В зависимости от механизма протекания коррозийного процесса различают химическую и электрохимическую коррозию.
Химическая коррозия протекает при взаимодействии металлов с сухими газами или растворами неэлектролитов. Электрохимическая коррозия протекает в водных растворах электролитов и во влажной атмосфере.
При электрохимической коррозии происходит образование местных гальванических пар. Участки с более отрицательным потенциалом являются анодными, а с более положительным – катодными. На анодных участках происходит окисление металла Ме 0 – nē ® Ме n + , на катодных – восстановление окислителя. Если коррозия происходит в кислой среде, то на катоде восстанавливаются ионы водорода: 2Н + + 2ē ® Н2 (водородная деполяризация). Если коррозия происходит во влажном воздухе (атмосферная коррозия), в электролите, содержащем растворенный кислород, при неравномерной аэрации, то на катоде восстанавливаются молекулы кислорода: О2 + 2Н2О + 4ē ® 4ОН — или О2 + 4Н + + 4ē ® 2Н2О (кислородная деполяризация).
Атмосферная коррозия
Коррозия при неравномерной аэрации наблюдается, когда доступ растворенного кислорода к различным частям изделия неодинаков. При этом те части металла, доступ кислорода к которым минимален, являются анодными участками. Это объясняется тем, что на катодных участках, где доступ кислорода больше, вследствие восстановления кислорода
(О2 + 2Н2О + 4ē ® 4ОН — ) происходит подщелачивание и металлы (в частности железо) пассивируются. На неаэрируемых участках происходит окисление металла: Ме 0 – nē ® Ме n + .
Пример 1. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если пара металлов находится в кислой среде (в H2SO4). Составьте схему образующегося при этом гальванического элемента, напишите уравнения электродных процессов.
Решение. Сравнивая величины стандартных электродных потенциалов (табл. 6), видим, что хром является более активным металлом () и в образующейся гальванической паре будет анодом. Медь является катодом (), как менее активный металл. В кислой среде схема образующегося гальванического элемента будет следующая:
Электронные уравнения электродных процессов:
А: Cr 0 — 3ē ® Cr 3+
Хром окисляется. На катоде восстанавливаются ионы водорода (водородная деполяризация).
Пример 2. Как происходит коррозия во влажном воздухе пары олово-висмут? Составьте схему образующегося гальванического элемента, напишите электронные уравнения электродных процессов.
Решение. Во влажном воздухе происходит атмосферная коррозия. При этом поверхность металла, находящегося во влажном воздухе, покрывается пленкой воды, содержащей различные газы, и в первую очередь кислород. Стандартный электродный потенциал олова , а стандартный электродный потенциал висмута . Потенциал висмута более положительный, следовательно, при контакте этих металлов олово будет анодом, а висмут – катодом. Схема образующегося при атмосферной коррозии гальванического элемента будет следующая:
Коррозия металлов и меры по ее предупреждению. 8 класс.
Электронные уравнения электродных процессов:
А: Sn 0 — 2ē ® Sn 2+ 2
Уравнивая число электронов, участвующих в катодном и анодном процессах, можно записать суммарное уравнение:
2Sn +O2 + 2H2O ® 2Sn 2+ + 4OH —
Ионы Sn 2+ взаимодействуют с гидроксид-ионами:
Sn 2+ + 2ОH — ® Sn(ОН)2.
Образующийся гидроксид Sn(ОН)2 является продуктом коррозии.
281.Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении целостности покрытия? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
282.Цинк покрытый серебром. Какое это покрытие – анодное или катодное? Почему? Какой из металлов будет корродировать во влажном воздухе в случае разрушения покрытия? Составьте электронные уравнения анодного и катодного процессов?
Каков состав продуктов коррозии?
283.В раствор соляной кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Дайте этому объяснение, составьте электронные уравнения анодного и катодного процессов.
284.Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в сильнокислой среде.
285.Какое покрытие металла называется анодным и какое катодным? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью во влажном воздухе и в сильнокислой среде.
286.Железное изделие покрыли кадмием. Какое это покрытие анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной кислоте.
287.Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
288.Как происходит коррозия железного изделия, покрытого титаном, находящегося во влажном грунте, содержащем растворенный кислород? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
289.Две цинковые пластинки, частично покрытые одна никелем, другая – серебром, находятся во влажном воздухе. На какой из пластинок коррозия протекает интенсивнее? Почему? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
290.В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
291.Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
292.Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
293.Определите, какой металл является анодом, а какой катодом в паре алюминий – железо. Что происходит на пластинках при атмосферной коррозии и коррозии в кислой среде? Составьте электронные уравнения анодного и катодного процессов.
294.Как происходит атмосферная коррозии пар Cd-Sn и Sn-Cu при нарушении целостности покрытия? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
295.В раствор соляной кислоты опустили пластинку из кобальта и кобальтовую пластинку, частично покрытую хромом. В каком случае процесс коррозии кобальта происходит интенсивнее? Почему? Составьте электронные уравнения анодного и катодного процессов.
296.Как происходит коррозия никелированного и хромированного железа во влажном воздухе? Составьте электронные уравнения анодного и катодного процессов коррозии в обоих случаях.
297.Если на стальной предмет нанести каплю воды, то вследствие неравномерной аэрации коррозии подвергается средняя, а не внешняя часть смоченного металла. После высыхания капли в ее центре появляется пятно ржавчины. Чем это можно объяснить? Какой участок металла, находящийся под каплей воды, является анодным и какой катодным? Составьте электронные уравнения соответствующих процессов.
298.Если гвоздь вбить во влажное дерево, то вследствие неравномерной аэрации ржавчиной покрывается та его часть, которая находится внутри дерева. Чем это можно объяснить? Анодом или катодом является эта часть гвоздя? Составьте электронные уравнения соответствующих процессов.
299.Две цинковые пластинки частично покрытые одна никелем, другая серебром, находятся во влажном воздухе. На какой из пластинок коррозия протекает интенсивнее? Почему? Составьте электронные уравнения анодного и катодного процессов.
300.В чем заключается сходство и различие между анодным покрытием и протекторной защитой? Приведите пример протекторной защиты хрома в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
159. Как протекает атмосферная коррозия железа, покрытого слоем серебра, если покрытие нарушено. Составьте электронные уравнения катодного и анодного процессов. Каков состав продуктов коррозии? (Решение → 653)
159. Минеральные вещества крови и их значение в биологических процессах.






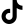


Библиотека Ирины Эланс, основана как общедоступная библиотека в интернете. Онлайн-библиотеке академических ресурсов от Ирины Эланс доверяют студенты со всей России.
Библиотека Ирины Эланс
Полное или частичное копирование материалов разрешается только с указанием активной ссылки на сайт:
Ирина Эланс открыла библиотеку в 2007 году.
Источник: student-files.ru
Коррозия металлов.

При решении данного раздела см. табл.3 в Приложении «Стандартные электродные потенциалы () некоторых металлов (ряд напряжений)»
Коррозия – это самопроизвольно протекающий процесс разрушения металлов в результате химического или электрохимического взаимодействия их с окружающей средой.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
1) Анодный – окисление металла: .
2) Катодный – восстановление ионов водорода: ,

или молекул кислорода, растворенного в воде: .
Ионы или молекулы, которые восстанавливаются на катоде, называются деполяризаторами. При атмосферной коррозии – коррозии во влажном воздухе при комнатной температуре – деполяризатором является кислород.
Пример 1. Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворе. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий — катодом.
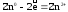
А:
а) в кислой среде
б) в нейтральной среде
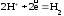
К:

К:
Так как ионы Zn 2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(ОН)2.
Контрольные задания.
- Две цинковые пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. Какая из этих пластинок быстрее подвергается коррозии? Почему? составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок.
- Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары Mg — Pb.
- Составьте электронные уравнения коррозии железа, покрытого цинком, и железа, покрытого свинцом в кислой среде и во влажном воздухе.
- Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии Al — Pb.
- Составьте электронные уравнения анодного и катодного процессов коррозии никеля, покрытого медью при нарушении покрытия во влажном воздухе и в соляной кислоте.
- Какие процессы возможны при контакте железа с раствором соляной кислоты. Какие методы защиты железа от коррозии можно рекомендовать в этом случае. Напишите уравнения процессов.
- В раствор соляной кислоты поместили две алюминиевых пластинки, одна из которых частично покрыта медью. В каком случае процесс коррозии алюминия происходит интенсивнее. Составьте электронные уравнения анодного и катодного процессов. Ответ мотивируйте.
- В раствор электролита, содержащего растворенный кислород, опустили две цинковых пластинки, одна из которых частично покрыта медью. В каком случае процесс коррозии цинка происходит интенсивнее. Составьте электронные уравнения анодного и катодного процессов.
- Объясните, почему в атмосферных условиях железо коррозирует, а золото нет. Объяснение подтвердите расчетами.
- Железное изделие покрыли свинцом. Какое это покрытие? Анодное или катодное? Почему? Составьте уравнения анодного и катодного процессов коррозии этого изделия при нарушении целостности покрытия во влажном воздухе и в растворе соляной кислоты. Какие продукты коррозии образуются в первом и втором случаях.
- Какое покрытие металла называется анодным, а какое катодным. Назовите металлы, которые можно использовать для анодного и катодного покрытия железа во влажном воздухе и в сильно кислой среде. Напишите уравнения процессов, протекающих при коррозии луженого железа.
- В чем сущность протекторной защиты металлов от коррозии. Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте уравнение анодного и катодного процессов.
- Медь не вытесняет водород из разбавленных кислот. Почему? Однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Объясните это явление, составьте уравнение анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
- Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении целостности покрытия. Составьте уравнение анодного и катодного процессов.
- Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары Mg — Ni.
- Составьте электронные уравнения коррозии железа, покрытого магнием, и железа, покрытого свинцом в кислой среде и во влажном воздухе.
- Составьте электронные уравнения катодного и анодного процессов с кислородной и водородной деполяризацией при коррозии пары Al – Ni
- Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина. Почему. Составьте электронные уравнения катодного и анодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа.
- Как протекает атмосферная коррозия железа, покрытого слоем серебра, если покрытие нарушено. Составьте электронные уравнения катодного и анодного процессов. Каков состав продуктов коррозии
- Составьте электронные уравнения процессов, происходящих при коррозии сплава Sn-Zn в кислой среде и во влажном воздухе.
Источник: studfile.net