Назовите вещества: 1) AgNo3
2) MgCo3
3) Cu(No2)2
4) BaSiO3
5) AlPO4
6) Fe2S3
7) ZnCl2
8) NiI2
9) Na2SiO3
10) Al2S3
11) KNO2
12) Ca3(Po4)2
13) LiBr
Нитрат серебра
Карбонат магния
Нитрит меди
Силикат бария
Фосфат алюминия
Сульфид железа (III)
Хлорид цинка
Иодид никеля
Силикат натрия
Сульфид алюминия
Нитрит калия
Фосфат кальция
Бромид лития
1) нитрат серебра
2) карбонат магния
3) нитрит меди
4) силикат бария
5) ортофосфат алюминия
6) сульфид железа(|||)
7) хлорид цинка
8) иодид.
9) силикат натрия
10) сульфид алюминия
11) нетрит калия
12) ортофосфат кальция
13) бромид лития
Источник: funnychemistry.ru
Как распознать нитрат серебра и нитрат цинка
СРОЧНО!
Реакция ЦИНКА и НИТРАТА СВИНЦА. Получение СВИНЦА. Опыты по химии.
Как распознать предложенные вещества:
нитрат цинка и хлорид железа 2. Составьте соответствующие уравнения реакций.
0 (0 оценок)

romajashkov 5 лет назад
Светило науки — 6 ответов — 0 раз оказано помощи
(Нитрат цинка) Zn(NO3)2+2NaOH = Zn(OH)2↓+2NaNO3.
Zn²⁺+2NO3⁻+2Na⁺+2OH⁻= Zn(OH)2↓+2Na⁺+2NO3⁻
Zn²⁺+2OH⁻=Zn(OH)2↓ белый осадок
(Хлорид железа) FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl
Fe²⁺+2Cl⁻+2Na⁺+2OH⁻ = Fe(OH)2↓ + 2Na⁺+2Cl⁻
Fe²⁺+2OH⁻ = Fe(OH)2↓ зеленоватый осадок
Источник: vashurok.com
Как пишется нитрат цинка

Рис. 1. Нитрат цинка. Внешний вид.
Химическая формула нитрата цинка
Химическая формула нитрата цинка Zn(NO3)2. Она показывает, что в составе молекулы этого вещества находится один атом цинка (Ar = 65 а.е.м.), два атома азота (Ar = 14 а.е.м.) и шесть атомов кислорода (Ar = 16 а.е.м.). По химической формуле можно вычислить молекулярную массу нитрата цинка: Mr(Zn(NO3)2) = 65 + 2×14 + 6×16 = 65 + 28 + 96 = 189.
Структурная (графическая) формула нитрата цинка
Структурная (графическая) формула нитрата цинка является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы:
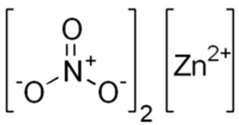
Ионная формула
Нитрат цинка является электролитом, т.е. в водном растворе диссоциирует на ионы согласно следующему уравнению:
Примеры решения задач
| Задание | При полном сгорании некоторого количества углеводорода образовалось 14,08 г оксида углерода (IV) и 3,6 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 39. |
| Решение | Составим схему реакции сгорания аминокислоты обозначив количество атомов углерода, водорода, кислорода и азота за «x», «у», «z» и «k» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. m(C) = [14,8 / 44]×12 = 4,04 г;
m(H) = 2×3,6 / 18 ×1= 0,4 г. Определим химическую формулу углеводорода: Значит его простейшая формула CH, а молярная масса 13 г/моль [M(CH) = Ar(C) + Ar(H) = 12 + 1 =13 / моль]. Значение молярной массы органического вещества можно определить при помощи его плотности по водороду: Msubstance = 2 × 39 = 78 г/моль. Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс: Msubstance / M(CH) = 78 / 13 = 6.
Значит индексы атомов углерода и водорода должны быть в 6 раз выше, т.е. формула вещества будет иметь вид C6H6.Это бензол.
| Задание | При полном сгорании на воздухе 7,4 г кислородсодержащего органического соединения образовалось 6,72 л (н.у.) углекислого газа и 5,4 мл воды. Выведите формулу этого соединения. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у»и «z» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м. Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr): M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль; M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль. m(C) = [6,72 / 22,4]×12 = 3,6 г; m(H) = [2×5,4 ×1 / 18 ×1 (г/мл)] = 0,6 г.
Определим химическую формулу соединения: x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O); x:y:z= 0,3 : 0,6 : 0,2 = 1,5: 3 : 1 = 3 : 6 : 2. Значит простейшая формула соединения C3H6O2 и молярная масса 64 г/моль Источник статьи: http://ru.solverbook.com/spravochnik/formuly-po-ximii/formula-nitrata-cinka/
Нитрат цинка

Нитрат цинка — неорганическое соединение, соль металла цинка и азотной кислоты с формулой Zn(NO3)2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.

Получение
- Кристаллогидраты получают реакцией оксида, гидроксида или карбоната цинка с азотной кислотой:
- Безводную соль получают реакцией металлического цинка с диоксидом азота в ацетонитриле:
Физические свойства
Нитрат цинка образует бесцветные кристаллы.
Хорошо растворяется в воде и этаноле.
Образует кристаллогидраты состава Zn(NO3)2•n H2O, где n = 1, 2, 4, 6 и 9.
С аммиаком образует аддукты с общей формулой Zn(NO3)2•n NH3.
Соли цинка
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород:
Сульфат цинка при сильном нагревании разлагается аналогично — на оксид цинка, сернистый газ и кислород:
Комплексные соли цинка
Для описания свойств комплексных солей цинка — гидроксоцинкатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоцинкат на две отдельные частицы — гидроксид цинка и гидроксид щелочного металла.
Например , тетрагидроксоцинкат натрия разбиваем на гидроксид цинка и гидроксид натрия:
Na2[Zn(OH)4] разбиваем на NaOH и Zn(OH)2
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы цинка реагируют с кислотными оксидами .
Например , гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид цинка не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Аналогично тетрагидроксоцинкат калия реагирует с углекислым газом:
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид цинка реагирует с сильными кислотами.
Например , с соляной кислотой:
Правда, под действием небольшого количества ( недостатка ) сильной кислоты осадок все-таки выпадет, для растворения гидроксида цинка кислоты не будет хватать:
Аналогично с недостатком азотной кислоты выпадает гидроксид цинка:
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-цинкат:
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Zn 2+ + H2O = ZnOH + + H +
II ступень: ZnOH + + H2O = Zn(OH )2 + H +
Более подробно про гидролиз можно прочитать в соответствующей статье.
Цинкаты
Соли, в которых цинк образует кислотный остаток (цинкаты) — образуются из оксида цинка при сплавлении с щелочами и основными оксидами:
Для понимания свойств цинкатов их также можно мысленно разбить на два отдельных вещества.
Например, цинкат натрия мы разделим мысленно на два вещества: оксид цинка и оксид натрия.
Na2ZnO2 разбиваем на Na2O и ZnO
Тогда нам станет очевидно, что цинкаты реагируют с кислотами с образованием солей цинка :
Под действием избытка воды цинкаты переходят в комплексные соли:
Сульфид цинка
Сульфид цинка — так называемый «белый сульфид». В воде сульфид цинка нерастворим, зато минеральные кислоты вытесняют из сульфида цинка сероводород (например, соляная кислота):
ZnS + 2HCl → ZnCl2 + H2S
Под действием азотной кислоты сульфид цинка окисляется до сульфата:
(в продуктах также можно записать нитрат цинка и серную кислоту).
Концентрированная серная кислота также окисляет сульфид цинка:
При окислении сульфида цинка сильными окислителями в щелочной среде образуется комплексная соль:
ZnS + 4NaOH + Br2 = Na2[Zn(OH)4] + S + 2NaBr
Источник: poisk2.ru