Насыщенным называют раствор, находящийся в равновесии с избытком растворяемого вещества. Концентрацию насыщенного раствора называют растворимостью и обозначают S. Растворимость зависит от температуры и состава раствора.
Растворимость соли в бинарной системе соль — вода соответствует ее концентрации в насыщенном растворе, т.е. . Согласно уравнению растворимости:
при растворении 1 моль соли образуется х моль катионов металла и у моль анионов кислотного остатка:
Уравнение закона действующих масс можно записать в следующем виде:
из которого следует уравнение расчета растворимости:
Если раствор содержит, помимо трудно растворимой соли, хорошо растворимую соль, имеющий в своем составе одноименные с составом осадка ионы, например: или , то при составлении уравнения закона действующих масс следует учитывать, что концентрация катиона или аниона может складываться из нескольких источников.
В присутствии одноименного аниона уравнение закона действующих масс
Как сделать сульфат серебра.
Например, уравнение закона действующих масс для системы :
В присутствии одноименного катиона
Например, уравнение закона действующих масс для системы :
В обоих случаях приходится решать степенное уравнение второго или более высокого порядка.
Растворимость осадка труднорастворимой соли слабой кислоты зависит от рН раствора из-за частичного или даже полного ее растворения в более сильной кислоте.
Для соли слабой одноосновной кислоты взаимодействие с сильной кислотой протекает по уравнению:
Растворимости соли соответствует уравнение
для которого произведение растворимости
Если за растворимость принять концентрацию катионов металла, то
Для слабой одноосновной кислоты вычисляют по уравнениям:
Для слабой двухосновной кислоты типа H2R вычисляют по уравнениям:
Примеры решения задач
Пример 7. Рассчитать растворимость Ag2SO4 в воде при 25°С; .
Решение. 1. Составить уравнение растворимости Ag2SO4:
из которого следует, что
2. Составить формулу произведения растворимости Ag2SO4:
3. Вычислить значение растворимости Ag2SO4
Пример 8. Вычислить растворимость сульфата серебра в растворе сульфата натрия концентрацией 31 г/л (плотность 1,025 г/см 3 ); .
Решение. 1. Рассчитать моляльную концентрацию раствора сульфата натрия. Для этого перейти к массовой концентрации по формуле
и вычислить моляльную концентрацию:
2. Составить уравнение диссоциации сульфата натрия:
из которого следует, что концентрация сульфат-иона
3. Составить уравнение растворимости сульфата серебра:
из которого следует, что
4. В растворе, содержащем сульфат натрия и сульфат серебра:
5. Составить формулу произведения растворимости Ag2SO4:
6. Сопоставить значения растворимости сульфата серебра в воде S 0 и концентрацию одноименного иона :
следовательно, величиной 4 S 3 в формуле произведения растворимости можно пренебречь. Тогда формула произведения растворимости:
Полученное значение растворимости сульфата серебра в присутствии одноименного иона меньше найденного для бинарной системы сульфат серебра – вода. В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными.
Пример 9. Вычислить растворимость сульфата серебра в растворе, содержащем массовую долю нитрата серебра 3 %; .
Решение. 1. Рассчитать моляльную концентрацию нитрата серебра в растворе по формуле
2. Составить уравнение диссоциации нитрата серебра:
из которого следует, что концентрация иона серебра
3. Составить уравнение растворимости сульфата серебра:
из которого следует, что
4. В растворе, содержащем нитрат серебра и сульфат серебра:
5. Составить формулу произведения растворимости Ag2SO4:
6. Сопоставить значения растворимости сульфата серебра в воде S 0 и концентрацию одноименного иона :
следовательно, величиной 4 S 3 в формуле произведения растворимости можно пренебречь. Тогда формула произведения растворимости:
7. Вычислить растворимость сульфата серебра, решив квадратное уравнение:
Полученное значение растворимости сульфата серебра в присутствии одноименного иона меньше найденного для бинарной системы сульфат серебра – вода. В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными.
Пример 10. Вычислить растворимость сульфата свинца в воде; .
Решение. 1. Составить уравнение растворимости сульфата свинца:
из которого следует, что
2. Составить формулу произведения растворимости:
3. Рассчитать растворимость сульфата свинца в воде:
Пример 11. Вычислить растворимость сульфата свинца в растворе сульфата натрия концентрацией 0,03 г/л; .
Решение. 1. Рассчитать моляльную концентрацию сульфата натрия. В данном случае можно воспользоваться формулой:
т.к. величина молярной концентрации не превышает 0,01 моль/л.
2. Составить уравнение диссоциации сульфата натрия:
из которого следует, что концентрация сульфат-иона
3. Составить уравнение растворимости сульфата свинца:
из которого следует, что
4. В растворе, содержащем сульфат натрия и сульфат свинца:
5. Составить формулу произведения растворимости PbSO4:
6. Сопоставить значения растворимости сульфата свинца в воде S 0 и концентрацию одноименного иона :
7. Вычислить растворимость сульфата серебра, решив квадратное уравнение:
Полученное значение растворимости сульфата серебра в присутствии одноименного иона меньше найденного для бинарной системы сульфат серебра – вода. В присутствии одноименного иона растворимость малорастворимого соединения должна уменьшаться, что согласуется с полученными расчетными данными.
Пример 12. Рассчитать растворимость сульфата свинца в растворе нитрата свинца концентрацией 0,062 моль/кг.
Решение. Составить уравнение диссоциации нитрата свинца:
из которого следует, что концентрация ионов свинца
3. Составить уравнение растворимости сульфата свинца:
из которого следует, что
4. В растворе, содержащем сульфат синца и нитрат свинца:
5. Составить формулу произведения растворимости PbSO4:
6. Сопоставить значения растворимости сульфата свинца в воде S 0 и концентрацию одноименного иона :
следовательно, величиной S 2 в формуле произведения растворимости нитрата свинца можно пренебречь:
7. Вычислить растворимость сульфата свинца в растворе нитрата свинца по формуле
Пример 13. Во сколько раз растворимость фторида бария в 0,01 М растворе соляной кислоты больше растворимости в чистой воде? , .
Решение. 1. Составить уравнение растворимости фторида бария:
из которого следует, что
2. Выразить концентрацию фторидных ионов с учетом кислотности раствора:
3. Составить уравнение произведения растворимости:
4. Вычислить растворимость соли в воде
5. Вычислить растворимость соли в присутствии соляной кислоты
Пример 14. Во сколько раз растворимость оксалата кальция в растворе с рН = 3,3 больше его растворимости в воде? ; , .
Решение. 1. Составить уравнение растворимости оксалата кальция:
2. Из уравнения растворимости следует, что
3. Вычислить концентрацию катионов водорода в растворе
4. Выразить концентрацию оксалат-ионов с учетом кислотности раствора
5. Составить уравнение произведения растворимости оксалата кальция
6. Вычислить растворимость оксалата кальция в воде
7. Вычислить растворимость оксалата кальция в растворе с рН = 3,3
8. Растворимость в кислом растворе в 3,3 раза больше, чем в воде.
Задачи для решения
5.3.1 Вычислить растворимость предложенного малорастворимого соединения в воде и в растворе соли, содержащей одноименный ион при 25°С
| № | Осадок | L | Параметры раствора соли, содержащей одноименный ион | ||
| соль | концентрация раствора | плотность раствора, г/см 3 | |||
| 61. | AgBr | 5,3·10 -13 | KBr | 0,1 мг/л | 1,0 |
| 62. | Ag2CrO4 | 1,1·10 -12 | AgNO3 | 0,15 г/л | 1,0 |
| 63. | AuBr | 5,0 10 -17 | KBr | 0,0012 мг/л | 1,0 |
| 64. | BaCrO4 | 1,2 10 -10 | BaCl2 | 3 мг/л | 1,0 |
| 65. | Ba2Fe(CN)6 | 3,0·10 -8 | K4Fe(CN)6 | массовая доля 1,0 % | 1,001 |
| 66. | CaSO4 | 2,5·10 -5 | Na2SO4 | массовая доля 0,1 % | 1,0 |
| 67. | CuCrO4 | 3,6·10 -6 | CuSO4 | массовая доля 0,1 % | 1,0 |
| 68. | Нg2CrO4 | 5,0·10 -9 | K2CrO4 | 0,15 г/л | 1,0 |
| 69. | MgF2 | 6,5·10 -9 | MgCl2 | 1,2 г/л | 1,0 |
| 70. | Mg(OH)2 | 6,0·10 -10 | NaOH | 0,32 г/л | 1,0 |
| 71. | Ni(OH)2 | 2,0·10 -15 | NiSO4 | 0,02 г/л | 1,0 |
| 72. | PbI2 | 1,1·10 -9 | KI | массовая доля 0,1 % | 1,0 |
| 73. | SrCrO4 | 3,6·10 -5 | K2CrO4 | массовая доля 0,2 % | 1,0 |
| 74. | SrF2 | 2,5·10 -9 | NaF | массовая доля 0,05 % | 1,0 |
| 75. | SrSO4 | 3,2·10 -7 | K2SO4 | массовая доля 0,02 % | 1,0 |
| 76. | Tl2CrO4 | 9,8·10 -13 | K2CrO4 | массовая доля 0,02 % | 1,0 |
| 77. | Ag2SO4 | 1,6·10 -5 | Na2SO4 | массовая доля 3,0 % | |
| 78. | BaSO4 | 1,1·10 -10 | BaCl2 | 3 мг/л | 1,0 |
| 79. | CaF2 | 4,0·10 -11 | NaF | 0,09 г/л | 1,0 |
| 80. | Cd2Fe(CN)6 | 4,2·10 -18 | Cd(NO3)2 | 3 мг/л | 1,0 |
5.3.2 Вычислить растворимость осадка в воде и в кислом растворе при 25°С
Источник: infopedia.su
Ksp для сульфата серебра (Ag_2SO_4) составляет 1,2 * 10-5. Как рассчитать растворимость сульфата серебра в каждом из следующих: а). вода б). 0,10 М AgNO_3 в). 0,43 М K_2SO_4?
Я покажу вам, как решать детали (А) а также (Б) и оставить часть (С) для вас, как практика.
Сульфат серебра, # «Ag» _2 «SO» _4 # , Считается нерастворимый в водном растворе, что подразумевает, что равновесие диссоциации между диссоциированные ионы и нерастворенное твердое вещество устанавливается при растворении соли в воде.
# «Ag» _ color (blue) (2) «SO» _ (4 (s)) rightleftharpoons color (blue) (2) «Ag» _ ((aq)) ^ (+) + «SO» _ (4 (водно)) ^ (2 -) #
Теперь, когда вы растворяете соль в чистая вода начальная концентрация растворенных ионов будет равна нулю. Вы можете использовать ICE стол найти равновесную концентрацию двух ионов
# «» «Ag» _ color (blue) (2) «SO» _ (4 (s)) «» rightleftharpoons «» color (blue) (2) «Ag» _ ((aq)) ^ (+) » «+» «» ТАК «_ (4 (aq)) ^ (2 -) #
#color (фиолетовый) («Я») цвет (белый) (aaaaaacolor (черный) (-) aaaaaaaaaaaaaacolor (черный) (0) aaaaaaaaaaacolor (черный) (0) #
#color (фиолетовый) («С») цвет (белый) (aaaaaacolor (черный) (-) aaaaaaaaaaacolor (черный) ((+ цветной (синий) (2) с)) aaaaaaacolor (черный) ((+ S)) #
#color (фиолетовый) («E») цвет (белый) (aaaaaacolor (черный) (-) aaaaaaaaaaaaacolor (черный) (цвет (синий) (2) s) aaaaaaaaaaacolor (черный) (s) #
По определению константа растворимости продукта, #K_ (SP) # , равно
В вашем случае это будет равно
#K_ (sp) = (цвет (синий) (2) с) ^ цвет (синий) (2) * с = 4 с ^ 3 #
Переставить, чтобы решить для # S # , молярная растворимость сульфата серебра в чистой воде
Вставьте свое значение, чтобы найти
Это означает, что в насыщенный В растворе сульфата серебра концентрация соли, которая будет растворяться с образованием ионов, равна
#color (зеленый) (| полоса (ul (цвет (белый) (a / a) цвет (черный) (s = «0.0144 моль L» ^ (- 1)) цвет (белый) (a / a) |))) #
#color (белый) (а / а) #
На этот раз вы заинтересованы в поиске молярной растворимости сульфата серебра в растворе, который # «0,10 М» # нитрат серебра, # «AgNO» _3 # .
В отличие от сульфата серебра, нитрат серебра растворимый в водном растворе, что означает, что он полностью диссоциирует с образованием катионов серебра и нитрат-анионов
Как показано #1:1# молярные отношения которые существуют между твердым и растворенными ионами, # «0,10 М» # раствор нитрата серебра будет иметь
Это означает, что ICE стол для диссоциации сульфата серебра будет выглядеть так
# «» «Ag» _ color (blue) (2) «SO» _ (4 (s)) «» rightleftharpoons «» color (blue) (2) «Ag» _ ((aq)) ^ (+) » «+» «» ТАК «_ (4 (aq)) ^ (2 -) #
#color (фиолетовый) («Я») цвет (белый) (aaaaaacolor (черный) (-) aaaaaaaaaaaacolor (черный) (0,10) aaaaaaaaaaacolor (черный) (0) #
#color (фиолетовый) («С») цвет (белый) (aaaaaacolor (черный) (-) aaaaaaaaaaacolor (черный) ((+ цветной (синий) (2) с)) aaaaaaacolor (черный) ((+ S)) #
# color (фиолетовый) («E») цвет (белый) (aaaaaacolor (черный) (-) aaaaaaaaaacolor (черный) (цвет (синий) (2) s + 0.10) aaaaaaaacolor (черный) (s) #
На этот раз константа продукта растворимости примет вид
#K_ (sp) = (цвет (синий) (2) s + 0,10) ^ цвет (синий) (2) * s #
Теперь, потому что значение #K_ (SP) # настолько мала по сравнению с начальной концентрацией катионов серебра, вы можете использовать следующее приближение
Это означает, что у вас есть
который получает вас
#s = K_ (sp) /0,010 = (1,2 * 10 ^ (- 5)) / 0,010 = 1,2 * 10 ^ (- 3) #
Следовательно растворимость в моларе сульфата серебра в растворе, который # «0,10 М» # нитрат серебра
#color (зеленый) (| полоса (ul (цвет (белый) (a / a) цвет (черный) (s = «0,0012 моль L» ^ (- 1)) цвет (белый) (a / a) |))) #
Как видите, молярная растворимость соли снизилась в результате присутствия катионов серебра #-># считать эффект общего иона Вот.
Вы можете подать в суд на тот же подход, чтобы найти ответ на часть (С), На этот раз общим ионом будет сульфат-анион, # «SO» _4 ^ (2 -) # доставлены к решению растворимый сульфат калия, # «K» _2 «SO» _4 # .
Источник: ru.howtodoiteasy.com
Чем растворить сульфат серебра
Актуальность аффинажа серебра растет с каждым годом за счет легкости процесса, по сравнению с очисткой золота (из радиодеталей, микросхем, процессоров) и металлов платиновой группы (платина, палладий и др.). Благодаря доступной цене этого драгметалла и тому, что он употребляется в производстве часто, а это ведет к выработке большого количество лома – спрос на добычу чистого серебра не падает.

Меры безопасности при аффинаже
Прежде чем начать процесс аффинажа серебра, на предприятиях и в домашних условиях, требуется соблюсти обязательные меры предосторожности и инструкции по безопасности:
- хорошая вентиляция помещения;
- применение резиновых перчаток, специальной одежды и защитных очков;
- работа с азотной кислотой подразумевает обязательное применение респиратора. Пары азота очень ядовиты;
- при смешивании воды и кислоты, ни в коем случае нельзя добавлять воду в концентрированную кислоту, только наоборот.

Необходимые материалы, инструменты и оборудование
Для аффинажа требуются следующие материалы:
Инструменты, применяющиеся при аффинаже:
- Стеклянная ёмкость.
- Стеклянная палочка.
- Медная шина или трубка.
- Флацанги, круглогубцы, кусачки и шило.
- Мешочки из ткани.
Оборудование для разных методов аффинажа серебра:
- Печь.
- Тигель в форме чашки.
- Трансформатор (блок питания).
- Горелка.
- Специальные ячейки из песчаника или пластика.
- Специальная посуда.
Способы и методы аффинажа серебра в домашних условиях

При реализации очистки серебра применяются разные методы:
- Химический аффинаж – с применением кислот.
- Электролитический – методом электролиза аффинажа технического серебра.
- Аффинаж из радиодеталей.
- Купелированный – применение специальной печи.
- Аффинаж серебра медью.
- Аффинаж из фотопленки.
Метод электролиза
Выделение серебра из посеребренных изделий с помощью электролиза можно проводить в домашних условиях. Понадобится электролит – жидкость, пропускающая ток. Для его приготовления понадобятся: аммиачная селитра и вода. Электролит готов, когда нитрат аммония полностью растворился в воде.
Устройством для перебойной подачи тока будет служить трансформатор (блок питания) до 5 Вольт, подключенный к сети. Для электролиза понадобятся электроды, например, графит (катод) и любая посеребренная деталь (анод). Они соединяются с минусовым и плюсовым контактами. Графит и изделие с серебром опустить в электролит под напряжением.
За счет силы тока в аммиачной среде серебро начинает отделяться и растворяться.
Легкость и доступность такого электролитического метода заключается в том, что серебро быстро выпадает в осадок, и его легко можно собрать через фильтр. С помощью соляной кислоты извлеченные крупинки чистого серебра переплавляются в небольшой слиток.
Химические (использование кислот) и карбонатные методики аффинажа
Процесс отделения серебра химическими методами при помощи серной и азотной кислоты, а также хлоридом, содой или перекисью водорода, довольно прост.
Подготовленный сплав помещают в кислоту, которая растворяет металл (при подогревании реакция происходит быстрее).
Для выделения хлорида серебра используется обычная соль. Полученный в реакции осадок примесей проходит фильтрацию и промывается водой. Потом в него добавляется серная или азотная кислота.
Процесс кристаллизации металла происходит с добавлением порошка цинка и последующем подогревании. Получившееся вещество опять промывается содой.
В этом методе в обязательно добавляется сульфат натрия. Процедура продолжается до полного выделения сульфата серебра. В результате серебро будет в осадке. С помощью фильтра легко достается из раствора.
С применением перекиси водорода серебро извлекают следующим способом:
Соль 5 грамм (катализатор), трехпроцентная перекись водорода – 100 мл, лимонная кислота – 30 гр. Залить изделия с серебром перекисью, туда же высыпать соль. Перемешать до полного растворения солей. Дождаться полного растворения металлов. Достать изделие и дать высохнуть. Горелкой быстро нагреть, что позволит выгореть остатку меди.
Серебро приобретет молочный цвет. Опустить в соляную кислоту. После того, как чистое серебро отделилось от примесей, с помощью фильтрации его легко извлечь и выплавить.

Купелирование
Сплавы низкопробного серебра аффинируются купелированием – это окисление посеребренных изделий со свинцом. Для этого метода используется печь с тиглем в виде чашки.
Этот метод основан на окислении свинца, расплавленного с серебром, который отделяется от металла вместе с примесями. Не отделяется только золото, платина и другие металлы платиновой группы, которые остаются в сплаве с серебром. Печь покрыта мергелью – губчатой глиной, которая впитывает окись свинца, испаряющийся из жидкого сплава под воздействием потока воздуха. После завершения окисления и перехода свинца в окись, поверхность сплава принимает радужную окраску, через которую при растрескивании прорывается яркий блеск серебра.
Метод аффинажа без кислот
Выделить серебро без применения азотной кислоты можно следующим образом. При помощи молотка с небольшой наковальней и нагревания посеребренные контакты доводятся до состояния тончайшей проволоки. Используются: печь, песок, емкость, термическая палочка, фильтр, реагенты (хлорид аммония, концентрированный раствор аммиака), проволока из меди. Последовательность действий: соли размешиваются, песочная баня с емкостью ставится на печку, в нее помещаются контакты, засыпанные реагентами.
Далее в течение десяти минут при нагревании происходит реакция с выделением белого газа (выделение хлорида серебра). По окончании полученные вещества остужаются и тщательно промываются. Сплав фильтруется, и необходимый осадок остается на фильтре, который в свою очередь заливается концентрированным аммиаком для получения чистого хлорида серебра. В полученный раствор погружается медная проволока. При реакции вымещается серебро, которое затем выплавляется.
Технология аффинажа серебра из фотопленки
Фотопленку замочить в хлорном растворе извести. Через 10 минут использованные и обесцвеченные (весь налет растворился в хлоре) куски вынимаются. Раствор молочного цвета отстаивается около трех часов. В целях ускорения процесса удаления эмульсии с экспонированной фотопленки, в раствор можно добавить сернокислый глинозем (0,18-0,4 кг на 1000 л раствора).
По истечению трех часов осадок фильтруют, сушат и обрабатывают для извлечения серебра.
Ключевые этапы аффинажа серебра в домашних условиях

Аффинаж серебра в домашних условиях пошагово в три этапа: выделение серебра в азотной кислоте, фильтрация металла и его выплавка, очистка электролизом (электролитическим способом).
#1. Получение металла из примесей. Процесс начинается с соединения воды и кислоты. Раствор окрашивается в светло-синий цвет. Весь процесс занимает до нескольких часов времени.
В результате получается нитрат серебра.
#2. Серебряный цемент. Получение драгметалла из нитрата серебра. Для этого понадобится медь. Светло-синий цвет раствора говорит о том, что в нем уже присутствует медь. Можно использовать любые содержащие медь изделия.
Медь как катализатор собирает на своей поверхности частицы серебра. В процессе медь под действием серебра полностью растворяется, превращая раствор в нитрат серебра. В результате образовывается осадок из серебряного цемента. Раствор необходимо отфильтровать. Для этого нужны воронка и фильтр.
Несколько раз осадок промывается водой. После добавляется немного обычной соли. Через некоторое время в емкости появится хлорид серебра.
Выплавка в тигле позволит слепить серебряные фрагменты.
#3. Далее в третьем этапе кусок серебра подвергается дальнейшей очистке электролизом.
Полученные фрагменты чистого серебра снова несколько раз промываются и сплавляются в самородок.
Ошибки при аффинаже серебра
- Избыточное количество азотной кислоты приведёт к скверной реакции, выделению оксида азота («рыжий хвост») в частности.
- Вертикальное расположение электродов друг над другом при аффинаже серебра электролизом значительно ослабевает воздействие электролита, и серебро очень медленно отделяется.
- При электролизе избыточный ток может привести к окиси серебра, в результате чего драгметалл почернеет.
- Фатальной ошибкой является несоблюдение правил безопасности при аффинаже серебра любым способом. Вдыхание ядовитых химических паров, ожоги и другое не обрадуют серебродобытчика.
Полезное видео по аффинажу серебра
Пошаговая инструкция, как в домашних условиях можно извлечь серебро из сплавов, представлена в видео.
Сульфат серебра
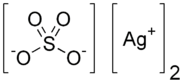
P260; P280; P305 + P351 + P338; P313
Источник: ollimpia.ru