1) Различить: суперфосфат, нитрат аммония, сульфат аммония.
а) Действия: К содержимому пробирок добавляем воду. Наблюдения: В одной из пробирок вещество растворилось не полностью. Выводы: Это суперфосфат, так как он слабо растворим. б) Действия: К этому р-ру добавляем раствор нитрата серебра (I). Наблюдения: Выделяется желтый осадок. Уравнения реакции: 
Выводы: В данной пробирке находится суперфосфат, т.к. данная реакция является качественной на фосфат -ионы. в) Действия: К оставшимся р-рам добавляем р-р хлорида бария. Наблюдения: В одной из пробирок выпадает белый осадок. Уравнения реакции: 

Выводы: В данной пробирке находится сульфат аммония, т.к. данная реакция является качественной на сульфат-ион. г) Действия: К веществу в оставшейся пробирке добавляем концентрированную серную кислоту и добавляем медь. Нагреваем. Наблюдения: Выделяется газ бурого цвета; раствор приобретает голубую окраску; медь растворяется. Уравнения реакции:
Нитрат серебра с тиосульфатом натрия

Выводы: В данной пробирке находится нитрат аммония, т.к. данная реакция является качественной на нитрат-ион.
2) Различить: хлорид аммония, нитрат натрия, хлорид калия.
а) Действия: К веществам добавляем раствор щелочи, нагреваем. Наблюдения: Из одной пробирки ощущается запах аммиака. 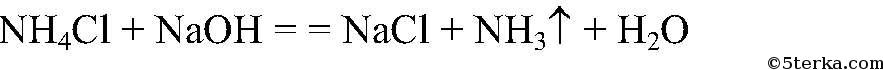
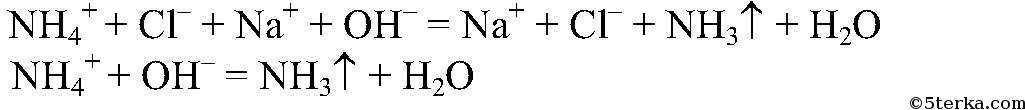
Выводы: В данной пробирке находится хлорид аммония, т.к. эта реакция является качественной на ион аммония. б) Действия: К двум оставшимся веществам добавляем раствор нитрата серебра (I). Наблюдения: В одной из пробирок белый осадок. Уравнения реакции: 

Выводы: Эта реакция является качественной на

поэтому в данной пробирке содержится хлорид калия. в) Действия: К оставшемуся веществу добавляем концентрированную серную кислоту и добавляем кусочек меди. Нагреваем. Наблюдения: Выделяется газ бурого цвета

раствор становится голубого цвета; медь растворяется. Уравнения реакции:

Выводы: В данной пробирке нитрат натрия, т.к. данная реакция является качественной на нитрат-ион.
Решение экспериментальных задач
1) Получите аммиак и проделайте с ним характерные химические реакции
(см. практическую работу №3).
2) Получить двумя способами нитрат меди (II).
а) Действия: Берем оксид меди (II), добавляем 
Качественные реакции бромид натрия+нитрат серебра
нагреваем. Наблюдения: Оксид меди (II) растворяется; раствор приобретает голубую окраску. Уравнения реакции: 
б) Действия: Берем медь, добавляем азотную кислоту и нагреваем. Наблюдения: Медь растворяется; выделяется газ бурого цвета; раствор становится голубого цвета. Уравнения реакции: 
4) Различить кристаллические вещества: Na2SO4, NH4Cl, NaNO3
а) Действия: К исследуемым веществам добавляем раствор щелочи. Наблюдения: Из одной пробирки ощущается запах аммиака. Уравнения реакции: 
Выводы: В данной пробирке содержится хлорид аммония, т.к. проведенная реакция является качественной на ион аммония. б) Действия: К оставшимся в-вам добавляем р-р хлорида бария. Наблюдения: В одной из пробирок выпадает белый осадок. Уравнения реакции: 
Выводы: В данной пробирке находится сульфат натрия, т.к. эта реакция является качественной на сульфат-ион. в) Действия: К оставшемуся веществу добавляем концентриро-ванную серную кислоту и кусочек меди. Нагреваем. Наблюдения: Выделяется газ бурого цвета; раствор становится голубого цвет ; медь растворяется. Уравнения реакции:

Выводы: Реакция является качественной на нитрат-ион, поэтому в данной пробирке находится нитрат натрия.
5) Различить растворы ортофосфорной и серной кислот
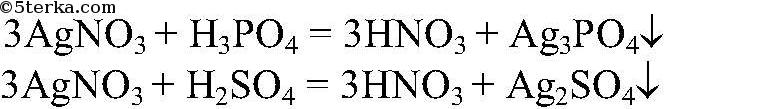
Действия: К обоим растворам добавляем нитрат серебра (I). Наблюдения: В одной пробирке наблюдается помутнение раствор , в другой образуется желтый осадок. Уравнения реакции:
Выводы: Та пробирка, в которой образовался желтый осадок, содержит ортофосфорную кислоту, другая — серную.
6) Различить ортофосфаты натрия и кальция
Действия: Добавляем в обе пробирки воду. Наблюдения: В одной соль растворяется, в другой — нет. Выводы: Растворившаяся в результате реакции соль — ортофосфат натрия, не растворившаяся — ортофосфат кальция.
Источник:

Решебник по химии за 9 класс (Г.Е.Рудзитис, Ф.Г.Фельдман, 1999 год),
задача №0
к главе «Лабораторные и практические работы».
Источник: 5terka.com
Как различить нитрат натрия и серебра

В ключевое отличие между хлоридом натрия и нитратом натрия заключается в том, что хлорид натрия представляет собой комбинацию катиона натрия и хлорид-аниона, тогда как нитрат натрия представляет собой комбинацию катиона натрия и нитрат-аниона.
И хлорид натрия, и нитрат натрия являются ионными соединениями. У них есть катион и анион, объединенные ионной связью. У них разные химические и физические свойства, потому что они содержат разные анионы в сочетании с похожими катионами (катионами натрия).
1. Обзор и основные отличия
2. Что такое хлорид натрия
3. Что такое нитрат натрия
4. Параллельное сравнение — хлорид натрия и нитрат натрия в табличной форме
5. Резюме
Что такое хлорид натрия?
Хлорид натрия — это неорганическое соединение, состоящее из катиона натрия и аниона хлорида. Химическая формула этого соединения — NaCl. Обычно это «соль», поскольку соль, которую мы потребляем в качестве пищевой добавки, в основном содержит хлорид натрия вместе с некоторыми следовыми соединениями, такими как хлорид магния.
Хлорид натрия — это ионное соединение. В нем 1: 1 ионы натрия и ионы хлора. Хлорид натрия — это соединение, которое отвечает за характерный вкус морской воды. Формульный вес хлорида натрия составляет 58,44 г / моль. Хлорид натрия в чистом виде имеет белый цвет. Он выглядит как прозрачные или полупрозрачные кубические кристаллы.
Температура плавления хлорида натрия 801 о C, а температура кипения 1465 о C. Хорошо растворим в воде. В кристаллической структуре хлорида натрия каждый ион окружен шестью ионами противоположного заряда. Эти ионы расположены в правильной структуре октаэдра.

Хлорид натрия гигроскопичен. Это означает, что он может поглощать водяной пар из воздуха при контакте с атмосферой.Кроме того, это соединение необходимо для поддержания электролитного баланса в нашем организме. Его также используют для консервирования некоторых продуктов.
Что такое нитрат натрия?
Нитрат натрия — это неорганическое соединение, содержащее катион натрия и нитрат-анион. Имеет химическую формулу NaNO.3. Он выглядит как белое бесцветное кристаллическое твердое вещество. Это нитратная соль щелочного металла, которую в минералогии называют чилийской селитрой. Это соединение хорошо растворяется в воде.
При растворении образует катионы натрия и нитрат-анионы. Следовательно, он полезен как легко доступный источник нитратов в различных процессах синтеза, производстве удобрений и т. Д.

Молярная масса нитрата натрия 84,9 г / моль. Имеет сладкий запах. Помимо добычи на месторождениях, мы также можем синтезировать нитрат натрия в лаборатории. Там мы можем нейтрализовать азотную кислоту карбонатом натрия или бикарбонатом натрия. Эту нейтрализацию также можно проводить с помощью гидроксида натрия.
Кристаллическую структуру полученного нитрата натрия можно определить как тригональную кристаллическую структуру, но иногда она дает ромбоэдрическую кристаллическую структуру.
В чем разница между хлоридом натрия и нитратом натрия?
Ключевое различие между хлоридом натрия и нитратом натрия заключается в том, что хлорид натрия представляет собой комбинацию катиона натрия и хлорид-аниона, тогда как нитрат натрия представляет собой комбинацию катиона натрия и нитрат-аниона. Химическая формула хлорида натрия — NaCl, а химическая формула нитрата натрия — NaNO.3.
Следующая инфографика резюмирует разницу между хлоридом натрия и нитратом натрия.

Резюме — хлорид натрия против нитрата натрия
Хлорид натрия и нитрат натрия — ионные соединения. Ключевое различие между хлоридом натрия и нитратом натрия заключается в том, что хлорид натрия представляет собой комбинацию катиона натрия и хлорид-аниона, тогда как нитрат натрия представляет собой комбинацию катиона натрия и нитрат-аниона.
Источник: ru.strephonsays.com
Как различить нитрат натрия и серебра
Привет Лёва Середнячок

Как можно отличить растворы
а) нитрита натрия и нитрата натрия
б) иодида калия и хлорида калия
1 (1 оценка)
ttzzgydcnud2 5 лет назад
Светило науки — 21 ответ — 0 раз оказано помощи
а)Нитриты-соли азотистой кислоты (HNO2).
То есть в этих солях и их растворах есть ион NO2-
Например NaNO2, Ca(NO2)2
Нитраты-соли азотной кислоты (HNO3). Здесь уже ион NO3-
Например NaNO3
б)Здесь вообще просто. Есть элемент иод (I), а есть хлор (Cl) оба неметаллы. Калий (К) — металл. Связь ионная и это соли. Иодид калия — KI. Хлорид калия — KCl
Источник: vashurok.com