2.2 Цинк реагирует с минеральными кислотами (например, соляной, фосфорной и разбавленной серной). В результате образуются соль и водород.
Свойства цинка и его взаимодействие с другими веществами
Обратите внимание, что вся информация на сайте Prowellness носит исключительно информационный характер и не является личной рекомендацией, инструкцией или медицинским заключением. Не используйте эти материалы для диагностики, лечения или выполнения медицинских процедур. Перед применением любой методики или использованием любого продукта проконсультируйтесь с врачом. Данный сайт не является профессиональным медицинским порталом и не заменяет профессиональную медицинскую консультацию. Владелец данного сайта не несет ответственности перед любой стороной, понесшей косвенные или побочные убытки в результате неправильного использования материалов данного ресурса.
Цинк относится к группе металлов и вступает в реакцию с различными химическими элементами. Как он реагирует?
Растворение ЦИНКА в концентрированной АЗОТНОЙ КИСЛОТЕ. Chemical experiment with nitric acid. Опыты
Цинк классифицируется как металл и обладает всеми его свойствами. Ему присущи блеск, твердость, пластичность, тепло- и электропроводность. Однако при определенных условиях цинк может проявлять неметаллические свойства.
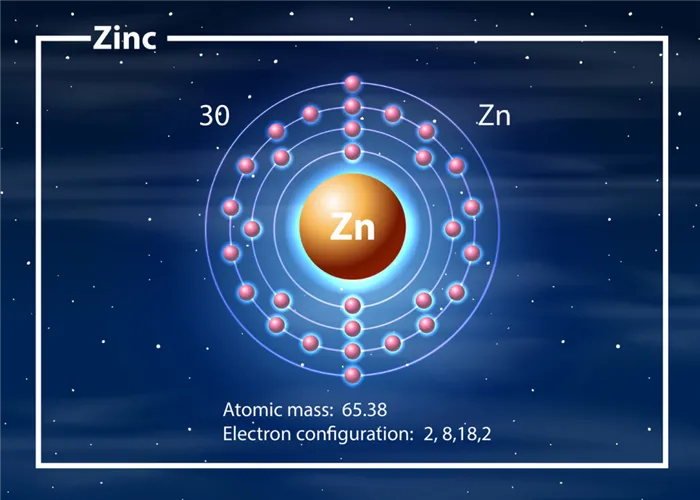
Характеристики цинка

Цинк имеет приятный серебристо-голубой цвет. При нормальных температурных условиях он гибкий, а иногда хрупкий. Металлы используются для упаковки в листы. Через некоторое время на листьях образуется тонкий слой оксида, и цинк перестает взаимодействовать с воздухом. Со временем она начинает слегка мутнеть и теряет свой блеск.
В таблице Менделеева номер химического элемента равен 30. Он относится к группе переходных металлов. Он называется Zn.
Где содержится цинк?
В 18 веке Уильяму Чемпиону удалось получить чистый цинк. До этого он использовался в сочетании с медью, и конечный продукт был известен как латунь.
В земной коре содержится большое количество цинка. Для промышленных целей цинк добывают из источников тепла.
Роль цинка в жизни растений и животных очень важна. Он является важным биологическим элементом.
Взаимодействие цинка с водой
Когда вода нагревается до высоких температур, при взаимодействии с водой образуется оксид цинка.
Цинковые концентраты обжигаются в печах. Сульфид цинка преобразуется в оксид цинка. В процессе выделяется сернистый газ SO2, который используется для производства серной кислоты.
Физические и химические свойства цинка
Температура плавления цинка составляет 420°C. В нормальных условиях это хрупкий металл. Нагрев до 100-150°C повышает пластичность и вязкость цинка, и металл можно использовать для производства кабелей и листового проката. Температура кипения цинка составляет 906°C. Металл является отличным проводником.
Нитрат серебра + щелочь:
Начиная с 200°C, цинк легко превращается в серый порошок и теряет свою пластичность. Металл обладает отличной теплопроводностью и теплоемкостью. Приведенные выше физические параметры позволяют использовать цинк в сочетании с другими элементами. Латунь — самый известный сплав цинка.

Фотография месторождения духовых инструментов.
При нормальных условиях поверхность цинка быстро покрывается оксидами в виде серо-белых тусклых бляшек. Они образуются потому, что кислород воздуха окисляет чистое вещество. Цинк как простое вещество реагирует с медью, лошадью, кислородом, фосфором, щелочами, кислотами, аммиаком (его солями) и аммиаком. Цинк не реагирует с азотом, водородом, бором, углеродом или кремнием.
Химически чистый цинк не реагирует с кислотными и щелочными растворами. Цинк сохраняет воду и реагирует со щелочами, образуя комплексные соединения, называемые солями гидроксина. Нажмите здесь, чтобы ознакомиться с экспериментом, который можно провести дома для изучения свойств цинка.
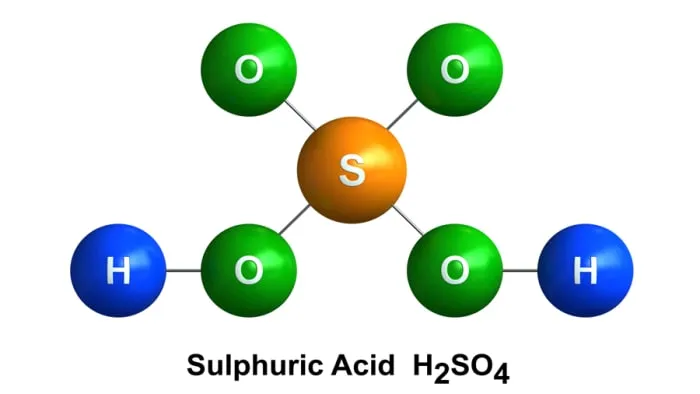
Реакция серной кислоты с цинком и получение водорода
Взаимодействие разреженной серной кислоты с цинком является основным экспериментальным методом получения водорода. Для этого используется чистый гранулированный цинк или цинковые техники в виде осколков и стружки.
При использовании очень чистого цинка и серной кислоты водород выделяется медленно, особенно в начале реакции. Поэтому после разбавления в охлаждающий раствор можно добавить немного раствора сульфата меди. Металлическая медь, осажденная на поверхности цинка, ускоряет реакцию. Лучшим способом разбавления кислоты для получения водорода является разбавление плотной серной кислоты в воде с плотностью 1,19 в соотношении 1:1.
Реакция концентрированной серной кислоты с цинком
Средой окисления в густой серной кислоте является сульфат-ион, который является самой сильной средой окисления, а не водородный полюс. Сильная гидратация и, следовательно, низкая подвижность — это не то, что вступает в реакцию окисления для разбавления серной кислоты.
То, как серная кислота реагирует с цинком в концентрации, зависит от температуры и концентрации. Уравнение реакции выглядит следующим образом.
4Zn +5H₂SO₄ = 4ZnSO₄ +H₂S +4H₂O
Концентрированная серная кислота является мощной окислительной средой благодаря своим условиям окисления (S⁺⁶). Он взаимодействует с металлами с низкой потенцией, т.е. до и после водорода, и, в отличие от разреженных кислот, не выделяет водород в этих реакциях. В результате реакций сахарной серной кислоты с металлами всегда образуются три продукта: соль, вода и продукты восстановления серы. Концентрированная серная кислота является очень мощной окислительной средой и может даже окислять некоторые безотходные продукты (углерод, серу и фосфор).
Растворимые соли цинка и сильных кислот гидролизуются катионами. Гидролиз происходит постепенно и обратимо. Другими словами, это происходит только постепенно.
Реакция между цинком и водой происходит с образованием оксида цинка и водорода
Zn + Co2 → ZnO + CO (T = 800-950°C).
Реакция между цинком и оксидом углерода (IV) происходит путем образования цинка и оксида углерода (II).
В результате реакции цинка с оксидом азота (IV) образуется оксид азота (II) и нитрат цинка.
Цинк и оксид серы реагируют с дитионитом цинка. Реакция протекает в водном растворе этанола.
Нитрат и цинк реагируют, образуя серебро и цинк.
Азот свинца и цинка реагируют с образованием нитрата свинца и цинка.
3. реакция взаимодействия сульфата цинка и меди:.
Цинк и азотная кислота реагируют с образованием нитрата цинка, оксидов азота (IV) и воды. Для реакции используется теплый густой раствор азотной кислоты.
Реакция между цинком и ортофосфорной кислотой протекает с образованием гидрофосфата цинка и водорода. В первой реакции используется горячий концентрированный раствор ортофосфорной кислоты.
Аналогичные реакции происходят и с другими минеральными кислотами.
Цинк — это хрупкий металл голубоватого цвета, который быстро тускнеет на воздухе и активно реагирует с кислотами и щелочами. Основное применение цинка — в гальванических процессах для покрытия железных предметов для защиты их от коррозии, а также в качестве компонента различных сплавов (например, меди в латуни).
Способы получения
Оксид цинка может быть получен различными методами:
1. путем окисления цинка кислородом:
2. Гидроксид цинка разлагается при нагревании:
3. Оксид цинка можно получить путем разложения нитрата цинка:
Химические свойства
Оксид цинка является типичным амфотерным оксидом. Он реагирует с кислотными и основными оксидами, кислотами и щелочами.
1. Когда оксид цинка реагирует с основными оксидами, образуются соли цинка.
Например, оксид цинка реагирует с оксидом натрия:
Оксид цинка взаимодействует с растворимыми основаниями (щелочами). Оксид цинка образует соли цинка (соли цинка) в расплаве и комплексные соли в растворе. В то же время оксид цинка проявляет кислотные свойства.
Например, оксид цинка реагирует с гидроксидом натрия в расплаве с образованием оксида цинка натрия и воды:
Оксид цинка растворяется в избытке щелочного раствора с образованием тетрагидрокси-цинката:
3 Оксид цинка не реагирует с водой.
Оксид цинка реагирует с кислотными оксидами. Образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например, оксид цинка реагирует с оксидом серы (VI) с образованием сульфата цинка:
5. Оксид цинка реагирует с растворимыми кислотами с образованием солей.
Например, оксид цинка реагирует с соляной кислотой:
6. Оксид цинка обладает слабыми окислительными свойствами.
Например, оксид цинка при нагревании реагирует с углеродом и окисью углерода:
ZnO + C(コカコーラ). → Zn + CO
ZnO + CO → Zn + CO2
7. Оксид цинка представляет собой твердое, нелетучее вещество. Следовательно, он вытесняет более летучие оксиды (обычно углекислый газ) из солей во время плавления.
Например, из карбоната бария:
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить, пропуская диоксид углерода, диоксид серы или сероводород через раствор тетрагидроксициннамата натрия:
Чтобы понять, как протекает эта реакция, можно воспользоваться простым приемом: мысленно проанализировать исходное вещество Na2Zn(OH).4 на составные части NaOH и Zn(OH)2。 Затем мы определяем, как углекислый газ реагирует с каждым из этих веществ, и записываем продукты их взаимодействия. Поскольку Zn(OH)2 не вступает в реакцию с CO2, запишите в правой части Zn(OH)2 変更なし。
2. Гидроксид цинка может быть получен действием щелочи на избыток соли цинка.
Например, хлорид цинка реагирует с дефицитом гидроксида калия с образованием гидроксида цинка и хлорида калия:
Химические свойства
1. Гидроксид цинка реагирует с растворимыми кислотами.
Например, гидроксид цинка реагирует с азотной кислотой с образованием нитрата цинка:
2. Гидроксид цинка реагирует с кислотными оксидами.
Например, гидроксид цинка реагирует с оксидом серы (VI) с образованием сульфата цинка:
3. гидроксид цинка реагирует с растворимыми основаниями (щелочами). Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами), образуя в расплаве комплексные соли цинка. В то же время гидроксид цинка проявляет кислотные свойства.
Например, гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинкового калия и воды.
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксона цинка.
4. гидроксид цинка разлагается при нагревании.
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород.
Сульфат цинка разлагается на оксид цинка, диоксид серы и кислород.
Комплексные соли цинка
Для описания свойств комплексных солей цинка (гидроксицинат цинка) полезно использовать следующий метод Психическое разложение тетрагидроксицината на две отдельные частицы (гидроксид и гидроксид цинка).
Например, тетрагидроксицинат натрия разделяют на гидроксид цинка и гидроксид натрия.
Свойства комплекса в целом могут быть определены как свойства этих отдельных соединений.
Таким образом, гидроксикомплексы цинка реагируют с кислотными оксидами.
Например, гидроксикомплекс разлагается под действием избытка углекислого газа. В этом случае NaOH реагирует с CO2 реагирует с NaOH с образованием кислых солей (в избытке CO2), в то время как амфотерный гидроксид цинка не реагирует с диоксидом углерода и просто выпадает в осадок: гидроксид цинка не является продуктом реакции.
Аналогичным образом тетрагидроксициннамат калия реагирует с углекислым газом.
Однако амфотерный гидроксид цинка реагирует с сильными кислотами, поэтому воздействие избытка сильной кислоты не приведет к выпадению осадка.
В случае с соляной кислотой, напр.
Однако под действием небольшого (недостаточного) количества сильной кислоты осадок все равно выпадает, и кислоты не хватает для растворения гидроксида цинка.
Аналогично, в отсутствие азотной кислоты выпадает в осадок гидроксид цинка.
Когда вода испаряется из объединенного раствора и полученный материал нагревается, остаются обычные соли цинка.
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются катионами. Гидролиз происходит постепенно и обратимо. Другими словами, это происходит только постепенно.
Стадия I: Zn 2+ + H2O = ZnOH + + + H +
Стадия II: ZnOH + H2O = Zn(OH)2 + H +
Более подробную информацию о гидролизе см. в соответствующей статье.
Цинкаты
Соли цинка (соли цинка) образуются из оксида цинка, когда он соединяется со щелочными и основными оксидами с образованием кислотных остатков.
Чтобы понять свойства солей цинка, их можно также мысленно проанализировать с помощью двух отдельных веществ.
Например, цинк-натрий можно мысленно разделить на два вещества — оксид цинка и оксид натрия.
Na2ZnO2 анализируется с помощью Na2O и ZnO
Тогда становится ясно, что соли цинка реагируют с кислотами, образуя соли цинка.
Под воздействием избытка воды соли цинка преобразуются в комплексные соли.
Сульфид цинка
Сульфид цинка — это так называемый «белый сульфид». Сульфид цинка нерастворим в воде, но минеральные кислоты вытесняют сероводород из сульфида цинка (например, HCl).
Источник: uhistory.ru
Цинк. Теория и подборка заданий №32 ЕГЭ
материал для подготовки к егэ (гиа) по химии (11 класс)
В подборке лана краткая основная теория по цинку и его соединениям, а так же задания №32 с ответами.
Скачать:
Предварительный просмотр:
Цинк. Соединения цинка.
- Цинк — простое вещество .Цинк – довольно активный металл, но на воздухе он устойчив, так как покрывается тонким слоем оксида, предохраняющим его от дальнейшего окисления. При нагревании цинк реагирует с простыми веществами (исключением является азот):
2Zn + О 2 2ZnОZn + Сl 2 ZnCl 2 3Zn + 2Р Zn 3 Р 2
- а также с оксидами неметаллови аммиаком:
3Zn + SO 2 2ZnO + ZnS Zn + CO 2 ZnO + CO 3Zn + 2NH 3 Zn 3 N 2 + 3H 2
- При нагревании цинк окисляется под действием водяных паров:
Zn +H 2 O (пар) ZnO + H 2
- Цинк реагирует с растворами кислот серной и соляной кислот, вытесняя из них водород:
Zn + 2HCl = ZnCl 2 + H 2 Zn + H 2 SO 4 = ZnSO 4 + H 2
- Как активный металл цинк реагирует с кислотами-окислителями:
Zn +2H 2 SO 4(конц.) = ZnSO 4 + SO 2 + 2H 2 O
4Zn +5H 2 SO 4(конц.) = 4ZnSO 4 + H 2 S + 4H 2 O
Zn + 4HNO 3(конц.) → Zn(NO 4 ) 2 + 2NO 2 + 2H 2 O
4Zn + 10HNO 3(оч. разб.) = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
- При сплавлении цинка с щелочами образуется цинкат:
Zn + 2NаОН (крист.) Nа 2 ZnО 2 +Н 2
- Цинк хорошо растворяется в растворах щелочей:
Zn + 2KOH + 2H 2 O = K 2 [Zn(OH) 4 ] + H 2
- В отличие от алюминия, цинк растворяется и в водном растворе аммиака .
Zn + 4NH 3 + 2H 2 O = [Zn(NH 3 ) 4 ](OH) 2 + H 2
- Цинк восстанавливает многие металлы из растворов их солей:
CuSO 4 + Zn = Zn SO 4 + Cu Pb(NO 3 ) 2 + Zn = Zn(NO 3 ) 2 + Pb
- Соединения цинка (соединения цинка ядовиты).
- Оксид цинка обладает амфотерными свойствами.
ZnO + 2HCl = ZnCl 2 + H 2 O
ZnO + 2NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ZnO + 2NaOH Na 2 ZnO 2 + H 2 O
ZnO +Na 2 O Na 2 ZnO 2 ZnO + SiO 2 ZnSiO 3
ZnO + BaCO 3 BaZnO 2 + СО 2
Цинк восстанавливают из оксидов действием сильных восстановителей:
ZnO +С (кокс) Zn + СОZnO + СО Zn + СО 2
- Гидроксид цинка обладает амфотерными свойствами.
Zn(OН) 2 + 2HCl = ZnCl 2 + 2H 2 O
Zn(OН) 2 + 2NaOH Na 2 ZnO 2 + 2H 2 OZn(OН) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
2Zn(OН) 2 + СО 2 = (ZnOH) 2 СО 3 + H 2 O
Zn(OН) 2 + 4(NH 3 · H 2 O) = [Zn(NH 3 ) 4 ](OH) 2
Гидроксид цинка термически неустойчив:
Zn(OН) 2 ZnO + H 2 O
СaZnO 2 + 4HCl (избыток) = CaCl 2 + ZnCl 2 + 2H 2 O
Na 2 ZnO 2 + 2H 2 O = Zn(OH) 2 + 2NaHCO 3
Na 2 [Zn(OH) 4 ] + 2CO 2 = Zn(OH) 2 + 2NaHCO 3
Zn(NO 3 ) 2 + 4NaOH = Na 2 [Zn(OH) 4 ] + 2NaNO 3
2ZnSO 4 2ZnO+ 2SO 2 + O 2
2Zn(NO 3 ) 2 2ZnO + 4NO 2 + O 2
Zn(NO 3 ) 2 + Mg = Zn + Mg(NO 3 ) 2
ZnS+ 4H 2 SO 4(конц.) = ZnSO 4 + 4SO 2 + 4H 2 O
ZnS+ 8HNO 3(конц.) = ZnSO 4 + 8NO 2 + 4H 2 O
ZnS+ 4NaOH + Br 2 = Na 2 [Zn(OH) 4 ] + S + 2NaBr
1. Оксид цинка растворили в растворе хлороводородной кислоты и раствор нейтрализовали, добавляя едкий натр. Выделившееся студенистое вещество белого цвета отделили и обработали избытком раствора щелочи, при этом осадок полностью растворился. нейтрализация полученного раствора кислотой, например, азотной, приводит к повторному образованию студенистого осадка. Напишите уравнения описанных реакций.
2. Цинк растворили в очень разбавленной азотной кислоте и в полученный раствор добавили избыток щелочи, получив прозрачный раствор.Напишите уравнения описанных реакций.
3. Соль, полученную при взаимодействии оксида цинка с серной кислотой, прокалили при температуре 800°С. Твердый продукт реакции обработали концентрированным раствором щелочи, и через полученный раствор пропустили углекислый газ.Напишите уравнения описанных реакций.
4. Нитрат цинка прокалили, продукт реакции при нагревании обработали раствором едкого натра. Через образовавшийся раствор пропустили углекислый газ до прекращения выделения осадка, после чего обработали избытком концентрированного нашатырного спирта, при этом осадок растворился.Напишите уравнения описанных реакций.
5. Цинк растворили в очень разбавленной азотной кислоте, полученный раствор осторожно выпарили и остаток прокалили. Продукты реакции смешали с коксом и нагрели.Напишите уравнения описанных реакций.
6. Несколько гранул цинка растворили при нагревании в растворе едкого натра. В полученный раствор небольшими порциями добавляли азотную кислоту до образования осадка. Осадок отделили, растворили в разбавленной азотной кислоте, раствор осторожно выпарили и остаток прокалили.Напишите уравнения описанных реакций.
7. В концентрированную серную кислоту добавили металлический цинк. образовавшуюся соль выделили, растворили в воде и в раствор добавили нитрат бария. После отделения осадка в раствор внесли магниевую стружку, раствор профильтровали, фильтрат выпарили и прокалили. Напишите уравнения описанных реакций.
8. Сульфид цинка подвергли обжигу. Полученное твердое вещество полностью прореагировало с раствором гидроксида калия. Через полученный раствор пропустили углекислый газ до выпадения осадка. Осадок растворили в соляной кислоте. Напишите уравнения описанных реакций.
9. Некоторое количество сульфида цинка разделили на две части. Одну из них обработали соляной кислотой, а другую подвергли обжигу на воздухе. При взаимодействии выделившихся газов образовалось простое вещество. Это вещество нагрели с концентрированной азотной кислотой, причем выделился бурый газ. Напишите уравнения описанных реакций.
10. Цинк растворили в растворе гидроксида калия. Выделившийся газ прореагировал с литием, а к полученному раствору по каплям добавили соляную кислоту до прекращения выпадения осадка. Его отфильтровали и прокалили. Напишите уравнения описанных реакций.
1) ZnO + 2HCl = ZnCl 2 + H 2 OZnCl 2 + 2NaOH= Zn(OH) 2 ↓ + 2NaCl
Zn(OH) 2 + 2NaOH = Na 2 [Zn(OH) 4 ]
Na 2 [Zn(OH) 4 ] + 2HNO 3(недостаток) = Zn(OH) 2 ↓ + 2NaNO 3 + 2H 2 O
2) 4Zn + 10HNO 3 = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
HNO 3 +NaOH = NaNO 3 + H 2 O
NH 4 NO 3 +NaOH = NaNO 3 + NH 3 ↑ + H 2 O
Zn(NO 3 ) 2 + 4NaOH = Na 2 [Zn(OH) 4 ] + 2NaNO 3
3) ZnO + H 2 SO 4 = ZnSO 4 + H 2 O2ZnSO 4 2ZnO + 2SO 2 + O 2
ZnO+ 2NaOH+ H 2 O= Na 2 [Zn(OH) 4 ]
Na 2 [Zn(OH) 4 ] + 2CO 2 = Zn(OH) 2 ↓ + 2NaHCO 3
4) 2Zn(NO 3 ) 2 2ZnO + 4NO 2 + O 2 ZnO + 2NaOH + H 2 O= Na 2 [Zn(OH) 4 ]
Na 2 [Zn(OH) 4 ] + 2CO 2 = Zn(OH) 2 ↓ + 2NaHCO 3
Zn(OH) 2 + 4(NH 3 · H 2 O)= [Zn(NH 3 ) 4 ](OH) 2 + 4H 2 O
5) 4Zn + 10HNO 3 = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
2Zn(NO 3 ) 2 2ZnO + 4NO 2 + O 2
NH 4 NO 3 N 2 O + 2H 2 O
6) Zn +2NaOH + 2H 2 O= Na 2 [Zn(OH) 4 ]+ H 2 ↑
Na 2 [Zn(OH) 4 ] + 2HNO 3 = Zn(OH) 2 ↓ + 2NaNO 3 + 2H 2 O
Zn(OH) 2 + 2HNO 3 = Zn(NO 3 ) 2 + 2H 2 O
2Zn(NO 3 ) 2 2ZnO + 4NO 2 + O 2
7) 4Zn + 5H 2 SO 4 = 4ZnSO 4 + H 2 S↑ + 4H 2 O
ZnSO 4 + Ba(NO 3 ) 2 = Zn(NO 3 ) 2 + BaSO 4
Zn(NO 3 ) 2 + Mg = Zn + Mg(NO 3 ) 2
2Mg(NO 3 ) 2 2MgO+ 4NO 2 + O 2 ↑
8) 2ZnS + 3O 2 = 2ZnO + 2SO 2 ↑
ZnO + 2NaOH + H 2 O = Na 2 [Zn(OH) 4 ]
Na 2 [Zn(OH) 4 ] + CO 2 = Zn(OH) 2 + Na 2 CO 3 + H 2 O
Zn(OH) 2 + 2HCl = ZnCl 2 + 2H 2 O
9) ZnS + 2HCl = ZnCl 2 + H 2 S↑
2ZnS + 3O 2 = 2ZnO + 2SO 2 ↑
2H 2 S +SO 2 = 3S + 2H 2 O
S + 6HNO 3 = H 2 SO 4 + 6NO 2 + 2H 2 O
10) Zn + 2KOH + 2H 2 O = K 2 [Zn(OH) 4 ] + H 2
K 2 [Zn(OH) 4 ] + 2HCl = 2KCl + Zn(OH) 2 ↓
Zn(OH) 2 ZnO + H 2 O
По теме: методические разработки, презентации и конспекты
Подборка заданий для подготовки к ЕГЭ по биологии. Задания с рисунками.
В КИМах по биологии достаточное количество заданий с рисунками. Работа с ними часто вызывает затруднения у выпускников. Надеюсь, подборка материала (с сайта «Решу ЕГЭ» и открытого банка заданий .

Хром. 11 класс. Теория и подборка задания №32 ЕГЭ
Данной основной теоретический материал по хрому и его соединениям, а так же задание №32 с ответами.

Медь. Теория и подборка заданий №32 ЕГЭ
Дана теория по теме «Медь и ее соединения», а так же подборка заданий №32 с ответами.

Алюминий. Теория и подборка заданий №32 ЕГЭ
Кратко представлена основная теория по теме «Алюминий и его соединения», а так же подборка заданий №32 с ответами.

Металлы IIА группы. Теория и подборка заданий №32
Кратко дана основная теория по теме «Металлы IIА группы и их соединения», а так же подборка заданий №32 с ответами.

Азот. Теория и подборка заданий №32 ЕГЭ
Кратко дана основная теория по теме «Азот и его соединения», а так же задания №32 с ответами.

Галогены. Теория и подборка заданий №32 ЕГЭ.
Кратко основная теория по теме «Галогены и их соединения», а также задания №32 с ответами.
Источник: nsportal.ru

ZnO + 2HNO3Zn(NO3)2 + H2O

Zn(NO3)2 + K4[Fe(CN)6]K2Zn3[Fe(CN)6]2 ↓ + 2KNO3
Исходное вещество – оксид цинка, при приготовлении эталонного раствора навеску предварительно растворяют в азотной кислоте, получая нитрат цинка. Реактив – ферроцианид калия. Среда – разведенная хлороводородная кислота. В эталоне наблюдается хорошо заметная муть; в исследуемом растворе – белый осадок или муть, не растворимые в разведенных минеральных кислотах.
В связи с ухудшением экологической обстановки испытанию на соли тяжелых металлов уделяется особое внимание. Особенно важно оно для ЛРС. Определение основано на реакции ионов тяжелых металлов с сульфидом натрия. Известно, что при этом образуется черный осадок или бурое окрашивание.
Открываемые примеси — соли свинца, олова, сурьмы, кадмия, никеля, таллия и др.
Исходное вещество — ацетат свинца Pb(CH3COO)2·3H2O. Основной реактив – раствор сульфида натрия. Среда – уксуснокислая.

Pb(CH3COO)2 + Na2S PbS↓ + 2CH3COOH
В эталоне – заметное буроватое окрашивание, в исследуемом растворе – черный осадок или бурое окрашивание.
Источником этой примеси может быть аппаратура, исходное сырье, растворители, используемые при производстве ЛП.
В ГФ Х1 описано 2 метода определения этой примеси.
Метод 1. Реакция Зангера-Блека применяется, если в статье нет специальных указаний.
Метод основан на восстановлении соединений мышьяка водородом в момент выделения (металлическим цинком в среде разведенной хлористоводородной кислоты или серной) до мышьяковистого водорода (арсина). Арсин проходя через бумажку, обработанную с дихлоридом ртути (II) с образует соединения окрашенные в зависимости от концентрации арсина в оранжевый или жёлтый цвет, а после обработки этой бумажки раствором калия йодида — в буровато-коричневый. Применение калия йодида позволяет повысить чувствительность реакции.
Исходное вещество – мышьяка (III) оксид As2О3, навеску предварительно растворяют в 0,1 М растворе натрия гидроксида и нейтрализуют 0,05 М раствором серной кислоты. Основной реактив – дихлорид ртути, дополнительный реактив – калия йодид.
Навеску ЛВ предварительно обрабатывают: неорганические – хлористоводородной кислотой разведенной или неорганические — пергидролем.

As2O3 + 6Zn + 12HCl 2AsH3 ↑ + 6ZnCl2 + 3H2O

AsH3 + HgCl2 AsH2(HgCl) + HCl

AsH3 + 2HgCl2 AsH(HgCl)2 + 2HCl

AsH3 + 3HgCl2 As(HgCl)3 +3HCl

AsH3 + As(HgCl)3 As2Hg3 ↓+ 3HCl
Метод 1 не применяется в случае присутствия наряду с мышьяком селена, теллура и в соединениях содержащих сурьму, висмут, ртуть, серебро, сульфиды и сульфиты. В этом случае в статье ГФ дается указание об использовании метода 2.
- Метод 2. Реакция Буго-Тиле.
Метод основан на восстановлении соединений мышьяка с фосфорноватистой кислотой в присутствии хлористоводородной кислоты при нагревании до металлического мышьяка. В зависимости от концентрации в исследуемом растворе – бурый осадок или бурое окрашивание. В эталоне – бурое окрашивание. Фосфорноватистая кислота получается при взаимодействии основного реактива – гипофосфита натрия и хлористоводородной кислоты разведенной: NaH2PO2 + HCl  H3PO2 + NaCl As2O3 + 3H3PO2
H3PO2 + NaCl As2O3 + 3H3PO2 2As↓ + H3PO3 As2O5 + 5H3PO2
2As↓ + H3PO3 As2O5 + 5H3PO2 2As↓+ 5H3PO3 Перечисленные испытания на примеси являются общими для большинства препаратов и дают лишь косвенную оценку степени очистки вещества. Таким образом, можно сделать вывод, что существуют 2 группы примесей, отношение к которым определяется степенью их опасности для здоровья человека. Это влияющие на фармакологический эффект (их не должно быть в препарате) и не влияющие, свидетельствующие о степени очистки. Отношение к этим примесям разное. Для обнаружения используются эталонный и безэталонный методы. Эталонный – это использование эталонов и определенных реакций (высокочувствительных, специфичных, воспроизводимых). Используя этот метод, необходимо соблюдать определенные правила работы с эталонами. В безэталонном методе – используется только реакция. Этот метод позволяет сделать вывод, присутствует или нет примесь в пределах чувствительности данной реакции.
2As↓+ 5H3PO3 Перечисленные испытания на примеси являются общими для большинства препаратов и дают лишь косвенную оценку степени очистки вещества. Таким образом, можно сделать вывод, что существуют 2 группы примесей, отношение к которым определяется степенью их опасности для здоровья человека. Это влияющие на фармакологический эффект (их не должно быть в препарате) и не влияющие, свидетельствующие о степени очистки. Отношение к этим примесям разное. Для обнаружения используются эталонный и безэталонный методы. Эталонный – это использование эталонов и определенных реакций (высокочувствительных, специфичных, воспроизводимых). Используя этот метод, необходимо соблюдать определенные правила работы с эталонами. В безэталонном методе – используется только реакция. Этот метод позволяет сделать вывод, присутствует или нет примесь в пределах чувствительности данной реакции.
Источник: studfile.net