Для открытия альдегидов часто пользуются реакцией восстановления аммиачного раствора окиси серебра, причем серебро может выделяться на стенках стеклянного сосуда в виде зеркального слоя. Для этой же цели пользуются реакцией восстановления фелинговой жидкости; при этом из синего раствора осаждается при нагревании красный осадок закиси меди.
Кетоны окисляются значительно труднее альдегидов — только при действии сильных окислителей (например, KMnO4). При этом обыкновенно разрывается связь между карбонильной группой и одним из алкилов и получаются кислоты с меньшим числом атомов углерода в молекуле.
Реакция окисления кетонов может быть применена для определения их строения. Так как связь между углеродными атомами может разорваться с каждой стороны карбонильной группы (правила окисления кетонов А. Н. Попова), то в наиболее общем случае могут получиться четыре кислоты. Например, этилбутилкетон
может дать следующие четыре кислоты:
Фактически при окислении кетонов получаются не только ожидаемые согласно приведенной схеме кислоты, но и кислоты с меньшим числом атомов углерода. Это часто затрудняет установление строения исходного кетона.
Тест-полоски «Ацетонтест»
2. Реакция Канниццаро В водных растворах альдегидов иногда удается наблюдать протекающую под влиянием щелочных агентов реакцию, очень характерную для ароматических альдегидов. Эта реакция, открытая Канниццаро, состоит в образовании из двух молекул альдегида молекулы спирта и молекулы соответствующей кислоты, например:
Однако в большинстве случаев этот процесс у алифатических альдегидов подавляется процессами конденсации, протекающими вплоть до образования смолистых веществ, а реакция Канниццаро лишь побочно сопровождает другие реакции, например альдольную конденсацию.
3. Реакция Тищенко Особая реакция, также являющаяся реакцией окисления одной молекулы альдегида в кислоту за счет восстановления другой в спирт, происходит при действии на альдегиды алкоголятов алюминия. При этом из двух молекул альдегида образуется одна молекула сложного эфира:
4. Реакция Меервейна—Понндорфа Безводные алкоголяты алюминия являются также катализаторами в сравнительно недавно открытой реакции Меервейна—Понндорфа. Она заключается в том, что в смеси высшего кетона с низшим вторичным спиртом, например с изопропиловым, в присутствии безводного алкоголята алюминия устанавливается равновесие:
Если исходный кетон и оба вторичных спирта значительно менее летучи, чем ацетон, то, нагревая такую смесь, можно отогнать последний и тем самым сместить равновесие вправо. Применяя избыток изопропилового спирта, можно этим путем нацело восстановить весь исходный кетон.
Наоборот, действуя избытком ацетона на вторичный спирт в присутствии безводного изопропилата алюминия и отгоняя смесь образующегося изопропилового спирта с ацетоном, можно полностью превратить исходный спирт в кетон (Оппенауэр). Механизм этих реакций заключается в промежуточном образовании комплексов карбонильных соединений с алкоголятом алюминия:
Тест на ацетон в моче. Можно ли использовать старые тест полоски на ацетон?
5. Образование перекисей При окислении кетонов, способных к енолизации, получаются α-гидроперекиси:
При действии на альдегиды и кетоны перекиси водорода получаются гидроперекиси оксиалкилов
Иногда эти вещества самопроизвольно дегидратируются, образуя крайне взрывчатые димерные и тримерные циклические перекиси алкилиденов, например:
В присутствии минеральных кислот перекись водорода реагирует с альдегидами и кетонами несколько иначе, приводя к дигидроперекисям алкилов, например:
Органические гидроперекиси в присутствии минеральных кислот также реагируют с альдегидами и кетонами. При этом образуются диалкилпероксиалканы, например:
Источник: xumuk.ru
Отчет по проделанной работе
Вывод: Эта реакция является качественной реакцией на альдегиды.
Вывод: Эта реакция также является качественной реакцией на альдегиды.
Вывод: Эта реакция является качественной на ацетон.
Вывод: Эта реакция очень чувствительная и используется для открытия ацетона.
Лабораторная работа №7
Тема: «Карбоновые кислоты»
Исследование свойств карбоновых кислот и их производных
Отчет по проделанной работе
| Описание опыта | Наблюдения |
| Опыт 1. Кислотные свойства карбоновых кислот 2.1.В пробирки помещают по 1 капле раствора уксусной кислоты. В первую пробирку добавляют 1 каплю метилоранжа, во вторую – 1 каплю фенолфталеина. 2.2.В пробирку помещают 2 капли раствора уксусной кислоты и добавляют немного магния. К отверстию пробирки подносят горящую спичку. Химизм процесса: |
| 2СН3 – СООН + Мg ® | 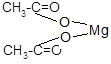 |
+ Н2 |
| уксуснокислый магний |
Вывод: Выделение водорода и изменение окраски индикатора метилоранжа подтверждают кислотные свойства уксусной кислоты.
Вывод: бензойная кислота с основаниями образует соли, разлагающиеся при действии минеральных кислот.
Вывод: бром присоединяется к олеиновой кислоте по месту разрыва двойной связи, т.к. олеиновая кислота ненасыщенная.
Вывод: Взаимодействие карбоновых кислот со спиртами (реакция этерификации) — важнейший способ получения сложных эфиров.
Вывод: в результате гидролиза мыла образуются жирные кислоты и гидроксид натрия. Розовое окрашивание говорит о появлении в растворе гидроксид-ионов. Реакция водных растворов мыла всегда щелочная.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник: studopedia.ru
Формула ацетона
![]()
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – это прозрачная подвижная жидкость с характерным резким запахом, достаточно летучая. С водой, низшими спиртами и эфирами смешивается неограниченно. Температура плавления и кипения равны соответственно и , плотность при комнатной температуре 0,7899 г/см .
Химические свойства ацетона
Ацетон, являясь кетоном, взаимодействует с атомарным водородом в момент его выделения с образованием пинакона, с синильной кислотой с образованием -оксинитрила, с гидросульфитом натрия с образованием гидросульфитного производного ацетона, с гидроксиламином с образованием ацетоноксима, с гидразином с образованием гидразона и азима, со спиртами с образованием полуацеталя и ацеталя, с бромом и йодом с замещением атома водорода на атом галогена, с самим собой в реакциях конденсации в щелочной среде с образованием -кетоноспирта и далее непредельного кетона. Приведём некоторые реакции:
- Взаимодействие с гидросульфитом натрия:
![[ (CH_3)_2CO + NaHSO_3 rightarrow (CH_3)_2C(OH)SO_3Na ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-2ba892844a9ea64d9d75b90bb23c3f79_l3.png)
- Альдольная конденсация:
![[ 2(CH_3)_2CO rightarrow (CH_3)_2C(OH)CH_2C(O)CH_3 ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-5e2187c38fc6e11a3a733caa8467a771_l3.png)
- Взаимодействие с синильной кислотой:
![[ (CH_3)_2CO + HCN rightarrow (CH_3)_2C(OH)CN ]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-b2414e0c52c80907432124cc9ba957b1_l3.png)
Получение
Ацетон получают окислением изопропанола кислородом при с катализатором (медь, серебро, платина, никель):
![]()
Также ацетон получают окислением пропена:
![]()
Качественная реакция
Качественной реакцией на ацетон является интенсивно-красное окрашивание при взаимодействии нитропруссидом натрия в щелочной среде:
![]()
Применение
Ацетон имеет широкое применение как прекурсор для синтеза многих важных веществ (уксусный ангидрид, кетен, окись мезитила, метилизобутилкетон, метилметакрилат, дифенилпропан и так далее). Также применяется как растворитель, для мытья и быстрой сушки лабораторной посуды.
Примеры решения задач
| Задание | Смешали г ацетона и г воды. Рассчитайте состав пара над раствором при . Давление насыщенных паров при этой температуре над чистыми жидкостями равно мм.рт.ст., мм.рт.ст. |
| Решение | Определим число моль и мольные доли компонентов раствора: |
![]()
моль
![]()
моль
![]()
![]()
Вычислим давление пара каждого компонента над раствором и общее давление:
![]()
мм.рт.ст.
![]()
мм.рт.ст.
![]()
мм.рт.ст.
Рассчитаем мольные доли компонентов паре:
![]()
![]()
| Задание | Рассчитайте активность и коэффициент активности ацетона в водном растворе, если мольная доля ацетона равна |
| Решение | Рассчитаем активность ацетона: |
![]()
Определим коэффициент активности:
![]()
![]() отклонение от закона Рауля положительное
отклонение от закона Рауля положительное
Источник: ru.solverbook.com