В таблице содержатся русские и латинские названия химических элементов, символы химических элементов и произношение символов. Для правильного произношения названий и символов в русских названиях и произношениях проставлены ударения.
| Азо́т | Nitrogenium | N | эн |
| Акти́ний | Actinium | Ac | акти́ний |
| Алюми́ний | Aluminium | Al | алюми́ний |
| Амери́ций | Americium | Am | амери́ций |
| Арго́н | Argon | Ar | арго́н |
| Аста́т | Astatum | At | аста́т |
| Ба́рий | Barium | Ba | ба́рий |
| Бери́ллий | Beryllium | Be | бери́ллий |
| Бе́рклий | Berkelium | Bk | бе́рклий |
| Бор | Borum | B | бор |
| Бо́рий | Bohrium | Bh | бо́рий |
| Бром | Bromium | Br | бром |
| Вана́дий | Vanadium | V | вана́дий |
| Ви́смут | Bismuthum | Bi | ви́смут |
| Водоро́д | Hydrogenium | H | аш |
| Вольфра́м | Wolframium | W | вольфра́м |
| Гадоли́ний | Gadolinium | Gd | гадоли́ний |
| Га́ллий | Gallium | Ga | га́ллий |
| Га́фний | Hafnium | Hf | га́фний |
| Ге́лий | Helium | He | ге́лий |
| Герма́ний | Germanium | Ge | герма́ний |
| Го́льмий | Holmium | Ho | го́льмий |
| Дармшта́дтий | Darmstadtium | Ds | дармшта́дтий |
| Диспро́зий | Dysprosium | Dy | диспро́зий |
| Ду́бний | Dubnium | Db | ду́бний |
| Евро́пий | Europium | Eu | евро́пий |
| Желе́зо | Ferrum | Fe | фе́ррум |
| Зо́лото | Aurum | Au | а́урум |
| И ́ ндий | Indium | In | и́ндий |
| Йод | Iodium | I | йод |
| Ири́дий | Iridium | Ir | ири́дий |
| Итте́рбий | Ytterbium | Yb | итте́рбий |
| И ́ ттрий | Yttrium | Y | и́ттрий |
| Ка́дмий | Cadmium | Cd | ка́дмий |
| Ка́лий | Kalium | K | ка́лий |
| Калифо́рний | Californium | Cf | калифо́рний |
| Ка́льций | Calcium | Ca | ка́льций |
| Кислоро́д | Oxygenium | O | о |
| Ко́бальт | Cobaltum | Co | ко́бальт |
| Коперни́ций | Copernicium | Cn | коперни́ций |
| Кре́мний | Silicium | Si | сили́циум |
| Крипто́н | Krypton | Kr | крипто́н |
| Ксено́н | Xenon | Xe | ксено́н |
| Кю́рий | Curium | Cm | кю́рий |
| Ланта́н | Lanthanum | La | ланта́н |
| Ливермо́рий | Livermorium | Lv | ливермо́рий |
| Ли́тий | Lithium | Li | ли́тий |
| Лоуре́нсий | Lawrencium | Lr | лоуре́нсий |
| Люте́ций | Lutetium | Lu | люте́ций |
| Ма́гний | Magnesium | Mg | ма́гний |
| Ма́рганец | Manganum | Mn | ма́рганец |
| Медь | Cuprum | Cu | ку́прум |
| Мейтне́рий | Meitnerium | Mt | мейтне́рий |
| Менделе́вий | Mendelevium | Md | менделе́вий |
| Молибде́н | Molybdaenum | Mo | молибде́н |
| Моско́вий | Moscovium | Mc | моско́вий |
| Мышья́к | Arsenicum | As | арсе́никум |
| На́трий | Natrium | Na | на́трий |
| Неоди́м | Neodymium | Nd | неоди́м |
| Нео́н | Neon | Ne | нео́н |
| Непту́ний | Neptunium | Np | непту́ний |
| Ни́кель | Niccolum | Ni | ни́кель |
| Нио́бий | Niobium | Nb | нио́бий |
| Нихо́ний | Nihonium | Nh | нихо́ний |
| Нобе́лий | Nobelium | No | нобе́лий |
| Оганесо́н | Oganesson | Og | оганесо́н |
| О ́ лово | Stannum | Sn | ста́ннум |
| О ́ смий | Osmium | Os | о́смий |
| Палла́дий | Palladium | Pd | палла́дий |
| Пла́тина | Platinum | Pt | пла́тина |
| Плуто́ний | Plutonium | Pu | плуто́ний |
| Поло́ний | Polonium | Po | поло́ний |
| Празеоди́м | Praseodymium | Pr | празеоди́м |
| Проме́тий | Promethium | Pm | проме́тий |
| Протакти́ний | Protactinium | Pa | протакти́ний |
| Ра́дий | Radium | Ra | ра́дий |
| Радо́н | Radon | Rn | радо́н |
| Резерфо́рдий | Rutherfordium | Rf | резерфо́рдий |
| Ре́ний | Rhenium | Re | ре́ний |
| Рентге́ний | Roentgenium | Rg | рентге́ний |
| Ро́дий | Rhodium | Rh | ро́дий |
| Ртуть | Hydrargyrum | Hg | гидра́ргирум |
| Руби́дий | Rubidium | Rb | руби́дий |
| Руте́ний | Ruthenium | Ru | руте́ний |
| Сама́рий | Samarium | Sm | сама́рий |
| Свине́ц | Plumbum | Pb | плю́мбум |
| Селе́н | Selenium | Se | селе́н |
| Се́ра | Sulfur | S | эс |
| Серебро́ | Argentum | Ag | арге́нтум |
| Сибо́ргий | Seaborgium | Sg | сибо́ргий |
| Ска́ндий | Scandium | Sc | ска́ндий |
| Стро́нций | Strontium | Sr | стро́нций |
| Сурьма́ | Stibium | Sb | сти́биум |
| Та́ллий | Thallium | Tl | та́ллий |
| Танта́л | Tantalum | Ta | танта́л |
| Теллу́р | Tellurium | Te | теллу́р |
| Теннесси́н | Tennessium | Ts | теннесси́н |
| Те́рбий | Terbium | Tb | те́рбий |
| Техне́ций | Technetium | Tc | техне́ций |
| Тита́н | Titanium | Ti | тита́н |
| То́рий | Thorium | Th | то́рий |
| Ту́лий | Thulium | Tm | ту́лий |
| Углеро́д | Carboneum | C | цэ |
| Ура́н | Uranium | U | ура́н |
| Фе́рмий | Fermium | Fm | фе́рмий |
| Флеро́вий | Flerovium | Fl | флеро́вий |
| Фо́сфор | Phosphorus | P | пэ |
| Фра́нций | Francium | Fr | фра́нций |
| Фтор | Fluorum | F | фтор |
| Ха́ссий | Hassium | Hs | га́ссий |
| Хлор | Chlorum | Cl | хлор |
| Хром | Chromium | Cr | хром |
| Це́зий | Caesium | Cs | це́зий |
| Це́рий | Cerium | Ce | це́рий |
| Цинк | Zincum | Zn | цинк |
| Цирко́ний | Zirconium | Zr | цирко́ний |
| Эйнште́йний | Einsteinium | Es | эйнште́йний |
| Э ́ рбий | Erbium | Er | э́рбий |
Источник: izamorfix.ru
Железо: химические свойства, качественные реакции и строение атома #железо #химшкола #химия
Формула железа
Плотность равна 7,87 г/см 3 . Температура плавления 1539 o C, кипения 3200 o C. Железо имеет несколько модификаций. До 769 o C устойчиво α-железо с объемно центрированной кубической решеткой и ферромагнитными свойствами. При 769 o C осуществляется переход в β-железо (кристаллическая структура та же, парамагнетик). При 910 o C образуется γ-железо с гранецентрированной кристаллической решеткой.
Парамагнитные свойства. При 1400 o C и до температуры плавления – δ- железо с объемно центрированной кубической решеткой.

Рис. 1. Железо. Внешний вид.
Химическая формула железа
Химическое обозначение железа – Fe от латинского слова «ferrum». Этот химический элемент расположен в четвертом периоде в VIIIВ группе Периодической таблицы. Относится к элементамd-семейства. Металл. Относительная атомная масса железа равна 55,847 а.е.м.
Электронная формула железа
Атом железа состоит из положительно заряженного ядра (+26), внутри которого есть 26 протонов и 30 нейтронов (массовое число равно 56), а вокруг, по шести орбитам движутся 26 электронов.
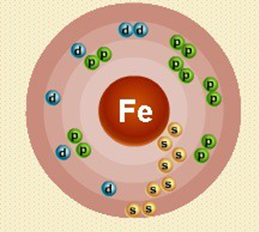
Рис. 1. Строение атома железа.
Электронная формула атома железа в основном состоянии имеет следующий вид:
Примеры решения задач
| Задание | Определите молекулярную формулу вещества, состоящего из кислорода, азота, фосфора и водорода, если известно, что оно содержит по массе 48,48% кислорода, число атомов азота в нем в два раза больше числа атомов фосфора, а количество атомов водорода в соединении в 2,25 раза больше количества атомов кислорода. Молярная масса вещества меньше 200 г/моль. |
| Решение | Обозначим число атомов кислорода в молекуле через «х», число атомов азота через «у», число атомов фосфора за «z» и число атомов водорода за «k». |
Найдем соответствующие относительные атомные массы элементов азота, фосфора, водорода и кислорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(N) = 14; Ar(P) = 31; Ar(H) = 14; Ar(O) = 16.
Пусть масса неорганического вещества равна 100 г, тогда масса кислорода составляет m(О) = 48,48 г. Найдем количество вещества кислорода:
n(О) = 48,48 / 16 = 3,03 моль.
Согласно условию задачи n(Н) = n(О) ×2,25, т.е.
n(Н) = 3,03 × 2,25 = 6,82 моль.
Тогда масса водорода будет равна:
m(Н) = 6,82 ×1 = 6,82 г.
Найдем суммарную массу элементов азота и фосфора, входящих в состав соединения:
m (N + P) = msubstance — m(О) — m(Н);
m (N + P)= 100 – 48,5 – 6,82 = 44,68 г.
Запишем уравнения для нахождения массы каждого из элементов в отдельности:
Составим систему уравнений и решим ее:
14× n(N) + 31×n(P) = 44,68;
28 n(Р) + 31n (P) = 44,68;
n(N) = 2× 0,75= 1,514 моль.
x:y:z:k = n(О) : n(N) : n(Р) : m(Н);
x:y:z:k= 3,03 : 1,514 : 0,757 : 6,82;
x:y:z:k= 4 : 2 : 1 : 9.
Значит простейшая формула соединения будет иметь вид O4N2PH9.
Молекулярная формула вещества может содержать удвоенное, утроенное и т.д. число атомов. Чтобы убедиться в том, что молекулярная формула вещества совпадает с простейшей, подсчитаем молярную массу:
Очевидно, что молярная масса для удвоенной формулы будет больше 200, что противоречит условию задачи, следовательно, молекулярная формула вещества O4N2PH9.Перегруппировав атомы легко догадаться, что это вещество является гидрофосфатом аммония (NH4)2HPO4.
| Задание | Найдите молекулярную формулу вещества, если плотность его паров по водороду равна 67,5, а состав выражается следующими массовыми долями элементов: 23,7% серы, 23,7% кислорода, 52,6% хлора. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (сера), «у» (хлор) и «z» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(S)/Ar(S) : ω(Cl)/Ar(Cl) : ω(O)/Ar(O);
x:y:z= 23,7/32 : 52,6/35,5 : 23,7/16;
x:y:z= 0,74 : 1,48:1,48 = 1 : 2: 2.
Значит простейшая формула соединения серы, хлора и кислорода будет иметь вид SCl2O2 и молярную массу 135г/моль[M(SCl2O2) = Ar(S) + 2×Ar(Cl) + 2×Ar(O) = 32 + 2×35,5 + 2×16 = 32 + 71 + 32 = 135г/моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по водороду:
Msubstance = 2 × 67,5 = 135 г/моль.
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит формула соединения серы, хлора и кислорода имеет вид SCl2O2.
Источник: ru.solverbook.com
Железо, свойства атома, химические и физические свойства

Железо, свойства атома, химические и физические свойства.
Поделиться в:




55,845(2) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Железо — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Расположен в 8-й группе (по старой классификации — побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Физические свойства железа
Атом и молекула железа. Формула железа. Строение атома железа:
Железо (лат. Ferrum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Fe и атомным номером 26. Расположен в 8-й группе (по старой классификации – побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Железо – металл. Относится к группе переходных металлов. Относится к чёрным металлам .
Железо обозначается символом Fe.
Молекула железа одноатомна.
Химическая формула железа Fe.
Электронная конфигурация атома железа 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 . Потенциал ионизации (первый электрон) атома железа равен 762,47 кДж/моль (7,9024681(12) эВ).
Строение атома железа. Атом железа состоит из положительно заряженного ядра (+26), вокруг которого по четырем оболочкам движутся 26 электронов. При этом 24 электрона находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку железо расположено в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью.
Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома железа на 3d-орбитали находится два спаренных и четыре неспаренных электрона.
На внешнем энергетическом уровне атома железа – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома железа состоит из 26 протонов и 30 нейтронов.
Радиус атома железа (вычисленный) составляет 156 пм.
Атомная масса атома железа составляет 55,845(2) а. е. м.
Железо – один из самых распространённых в земной коре металлов – занимает четвертое место. Содержание в земной коре железа составляет 6,3 % (по массе). По этому показателю железо уступает только кислороду, кремнию и алюминию.
Источник: xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai