В этом исследовании синтезированы нанокомпозиты серебра и меди при совместном химическом восстановлении ионов серебра и меди в присутствии стабилизаторов различной природы. Для стабилизации наночастиц в растворе использованы додецилсульфат натрия (ДСН), поливинилпирролидон (ПВП) и бромид гексадецилпиридиния (БГП).
Полученные нанокомпозиты Ag/Cu характеризовались использованием порошковой рентгеновской дифракции и эмиссионного сканирующего электронного микроскопа с системой энергодисперсионного рентгеновского микроанализатора. Методом рентгенофазового анализа установлено, что продукты, синтезированные в присутствии ДСН и ПВП, состоят из трех фаз, которые представляют собой нанокомпозит серебра, меди.
В составе продуктов присутствует также оксид (II) меди. В продукте, полученном в присутствии БГП, не наблюдается окисление наночастиц меди, поэтому в образце обнаружены линии характерные только для серебра и меди. Расчеты дифрактограмм показывают, что значение параметра кристаллической решетки частиц соответствует массивным металлам.
Это указывает на то, что при восстановлении ионов в присутствии стабилизаторов формируются нанокомпозиты серебра и меди. На основе электронного микроскопического анализа установлено, что наночастицы, полученные в присутствии ДСН и ПВП, имеют размеры от 30 до 140 нм, а в присутствии БГП их размеры составляют в среднем 40–70 нм. Результаты рентгеновского микроанализа показывают, что состав нанокомпозитов серебра и меди, синтезированных в присутствии стабилизаторов, хорошо коррелируется с составом и соотношением исходной смеси компонентов, образующих нанокомпозита. Проведенное исследование показывает, что присутствие БГП способствует получению стабильных наночастиц с меньшим размером и более узким распределением по размерам, чем использование стабилизаторов ДСН и ПВП.

нанокомпозиты
рентгенофазовый анализ
стабилизация
додецилсульфат натрия
бромид гексадецилпиридиния
поливинилпирролиден
энергодисперсионный анализ
размер частиц
1. Kozhitov L.V., Kozlov V.V., Kostikova A.V., Popkova A.V. Novel Metal Carbon Nanocomposites and Carbon Nanocrystalline Material with Promising Properties for the Development of Electronics. Russian Microelectronics. 2013. Vol. 42. no.
8. Р. 498–507.
2. Михайлов В.И. Получение и физико-химические свойства материалов на основе нанодисперсных оксидов алюминия и железа: автореф. дис. . канд. хим. наук. Сыктывкар, 2016. 21 с.
3. Ибраева Ж., Кудайбергенов С., Бектуров Е. Стабилизация наночастиц металлов гидрофильными полимерами. LAMBERT Academic Publishsing 2013. 367 с.
4. Calagua A., Alarcon H., Paraguay F., Rodriguez J. Synthesis and characterization of bimetallic gold-silver core-shell nanoparticles: a green approach. Advances in nanoparticles. 2015. vol. 4. P. 116–121. DOI: 10.4236/anp.2015.44013.
5. Каргин Ф., Горелик В.С. Нанокомпозиты на основе опаловых матриц, заполненных металлическими наночастицами // Неорганические материалы. 2015. № 8. С. 914–922.
6. Воробьев Д.М. Получение и диагностика наноматериалов на основе металлооксидов, химически осажденных из паровой фазы // Молодой ученый. 2013. № 3. С. 40–44.
7. Жаснакунов Ж.К., Сатывалдиев А.С. Способ получения нанокомпозита серебра и меди // Патент КР № 2100 Патентообладатели Ж.К. Жаснакунов и А.С. Сатывалдиев. 2018.
Бюл. № 10.
8. Srikar S.K., Giri D.D., Pal D.B., Mishra P.K., Upadhyay S.N. Green Synthesis of Silver Nanoparticles: A Review. Green and Sustainable Chemistry. 2016. Vol.
6. no. 1. Р. 34–56.
9. Баатыркулова К.А., Орозматова Г.Т., Сатывалдиев А.С., Жаснакунов Ж.К. Получение устойчивой суспензии наноразмерной меди // Известия вузов. 2013. № 3. С. 95–97.
10. Свиридов В.В., Воробьева Т.Н., Гаевская Т.В. Степанова Л.И. Химическое осаждение металлов из водных растворов. Минск, 1978. 392 с.
11. Орозматова Г.Т. Влияние природы поверхностно-активного вещества (ПАВ) на фазовый состав продуктов восстановления ионов меди // Наука, новые технологии и инновации Кыргызстана. 2015. № 4. С. 116–118.
12. Горелик С.С., Скаков Ю.А., Расторгуев Л.Н. Рентгенографический и электронно-оптический анализ. М.: МИСИС, 1994. 328 с.
13. Жаснакунов Ж.К., Рысалиева А.Т., Эмил Омурзак у. Дисперсность и морфология продуктов совместного восстановления ионов серебра и меди // Известия вузов. 2014. № 5. С. 96–98.
14. Соболева О.А., Хаменов Г.А., Долматов В.Ю., Сергеев В.Г. Влияние хлоридов алкилпиридиния на агрегативную устойчивость водных дисперсий наноалмазов детаноционного синтеза // Коллоидный журнал. 2017. Т. 79. № 1. С. 83–89.
15. Казакевич П.В. Образование наночастиц при лазерной абляции металлов в жидкости: автореф. дис. . физ.-мат. наук. Москва, 2008. 21 с.
16. Debnath D., Kim C., Kim S.H., Geckeler K.E. Solid-statesynthesis of silver nanoparticles at room temperature: Poly(vinylpyrrolidone) as a tool. Macromol. Rapid. Commun.
2010. V. 31. no. 6. Р. 549–553.
17. Жаснакунов Ж.К., Сатывалдиев А.С., Абдулазизов Т.А. Синтез стабилизированных наночастиц системы Ag-Ni методом химического восстановления // Проблемы современной науки и образования. 2016. Т. 50. № 8. С. 31–34.
18. Синдо Д., Оикава Т. Аналитическая просвечивающая электронная микроскопия. М.: Техносфера, 2006. 256 с.
Нанокомпозиты являются важными материалами для научных исследований и разнообразных технических применений из-за свойств, зависящих от размера и больших площадей поверхности их наночастиц. Особый интерес вызывают нанокомпозиты, обладающие новыми свойствами, которых нет ни у одного из компонентов в отдельности, поэтому они имеют широкое применение в различных отраслях науки и техники [1, 2]. Когда чистые наночастицы используются одни, они имеют некоторые проблемы, например агломерацию между наночастицами. Для преодоления этих проблем применение различных полимерных соединений, в которых наночастицы поддерживаются внутри пространств полимера или на ее внешних поверхностях, является одним из наиболее эффективных решений данной проблемы [3].
Существует множество способов получения нанокомпозитов различных металлов, таких как химическое восстановление в мягких матрицах или в твердых матрицах [4, 5], химическое осаждение из паровой фазы [6], электроискровое диспергирование токопроводящих материалов [7].
В настоящее время среди перспективных материалов следует выделить наноструктурированные композиты, стабилизированные полимерными веществами в составе водных растворов, которые препятствуют процессу агрегации наночастиц.
Поэтому целью исследования является получение нанокомпозита серебра и меди химическим восстановлением в присутствии стабилизаторов различной природы.
Большая Энциклопедия Нефти и Газа
Подтверждением того, что именно палладий в степени окисления, равной нулю, обладает повышенной каталитической активностью, может служить, вероятно, тот факт, что очень разбавленные коллоидные растворы металлического палладия катализируют реакцию восстановления ионов серебра железом ( П) намного сильнее, чем хлоридпые комплексные соединения Pd ( II) [ 18J; а соединения Ir ( III), ( IV), для которых не характерно восстановление до металлического состояния в процессе гомогенно-каталитической редокс-реакции, не катализируют эту реакцию вовсе, тогда как коллоидный раствор металлического иридия проявляет в данной реакции каталитические свойства. [31]
Чтобы избежать одновременного восстановления ионов водо рода, надо повысить потенциал электрода до величины, превышающей EI ( см. рис. 327), но в то же время он не должен быть слишком высоким, иначе восстановление ионов серебра будет проходить медленно и неполно. [33]
Например в ходе количественного эмиссионного спектрального определения с конечной фотографической регистрацией спектра осуществляются следующие основные процессы и операции: а) испарение и перенос пробы из канала угольного электрода в плазму разряда; б) возбуждение атомов элементов в-плазме и излучение характеристических спектральных линий элементов; в) отбор определенной доли светового потока из общего потока, излучаемого плазмой, с помощью дозирующей щели спектрографа; г) пространственное разложение полихроматического излучения на соответствующие характеристические частоты ( развертка спектра) с помощью призмы или дифракционной решетки; д) фотохимическое взаимодействие светочувствительного материала с квантами электромагнитного излучения ( образование скрытого изображения спектра на фотопластинке или фотопленке); е) химические реакции восстановления ионов серебра до металла и растворения галогенидов серебра в комплексующих агентах ( проявление и фиксирование); ж) поглощение света спектральными линиями на фотографической пластинке при измерении плотности почернения спектральных линий определяемого элемента и фона с помощью микрофотометра; а) сравнение полученных значений интенсивностей спектральных линий с интенсивностью соответствующих линий эталонов или стандартов и интерполяция искомого содержания элемента в пробе по градиуровочному графику. [34]
Например в ходе количественного эмиссионного спектрального определения с конечной фотографической регистрацией спектра осуществляются следующие основные процессы и операции: а) испарение и перенос пробы из канала угольного электрода в плазму разряда; б) возбуждение атомов элементов в плазме и излучение характеристических спектральных линий элементов; в) отбор определенной доли светового потока из общего потока, излучаемого плазмой, с помощью дозирующей -; щели спектрографа; г) пространственное разложение полихроматического излучения на соответствующие характеристические частоты ( развертка спектра) с помощью призмы или дифракционной решетки; д) фотохимическое взаимодействие светочувствительного материала с квантами электромагнитного излучения ( образование скрытого изображения спектра на фотопластинке или фотопленке); е) химические реакции восстановления ионов серебра до металла и растворения галогенидов серебра в комплексующих агентах ( проявление и фиксирование); ж) поглощение света спектральными линиями на фотографической пластинке при измерении плотности почернения спектральных линий определяемого элемента и фона с помощью микрофотометра; з) сравнение полученных значений интенсивностей спектральных линий с интенсивностью соответствующих линий эталонов или стандартов и интерполяция искомого содержания элемента в пробе по градиуровочному графику. [35]
Так, например, в ходе количественного эмиссионного спектрального определения с конечной фотографической регистрацией спектра последовательно осуществляются следующие основные процессы и операции: ) испарение и перенос пробы из канала угольного электрода в плазму разряда; б) возбуждение атомов элементов в плазме и высвечивание характеристичных спектров элементов; в) отбор определенной доли светового потока из общего потока, излучаемого плазмой, с помощью дозирующей щели спектрографа; г) пространственное разложение полихроматического излучения на соответствующие характеристические частоты ( развертка спектра) с помощью призмы или дифракционной решетки; д) фотохимическое взаимодействие светочувствительного материала с квантами электромагнитного излучения ( образование скрытого изображения спектра на фотопластинке или фотопленке); е) химические реакции — восстановления ионов серебра до металла и растворения галогенидов серебра в комплексующих агентах ( проявление и фиксировадие); ж) — поглощение квантов света фотографическим спектром образца, измерение величин плотности почернения спектральных линий и фона с помощью микрофотометра; з) сравнение полученных величин интенсив-ностей спектральных линий с интенсивностью соответствующих линий эталонов или стандартов и интерполяции искомого содержания элемента в пробе по калибровочному графику. [36]
Так, например, в ходе количественного эмиссионного спектрального определения с конечной фотографической регистрацией спектра последовательно осуществляются следующие основные процессы и операции: а) испарение и перенос пробы из канала угольного электрода в плазму разряда; б) возбуждение атомов элементов в плазме и высвечивание характеристичных спектров элементов; в) отбор определенной доли светового потока из общего потока, излучаемого плазмой, с помощью дозирующей щели спектрографа; г) пространственное разложение полихроматического излучения на соответствующие характеристические частоты ( развертка спектра) с помощью призмы или дифракционной решетки; д) фотохимическое взаимодействие светочувствительного материала с квантами электромагнитного излучения ( образование скрытого изображения спектра на фотопластинке или фотопленке); е) химические реакции восстановления ионов серебра до металла и растворения галогенидов серебра в комплексующих агентах ( проявление и фиксирование); ж) поглощение квантов света фотографическим спектром образца, измерение величин плотности почернения спектральных линий и фона с помощью микрофотометра; з) сравнение полученных величин интенсив-ностей спектральных линий с интенсивностью соответствующих линий эталонов или стандартов и интерполяции искомого содержания элемента в пробе по калибровочному графику. [37]
Если диффузионный ток какого-либо иона используется для определения как данного иона, так и других ионов, то это также отмечено в таблице. Например, восстановление иона серебра используется как для определения самого серебра ( по катодному методу), так и для титрования хлорид — или иодйд-ионов. Это значит, что диффузионный ток восстановления ионов серебра используется для его определения при помощи растворов хлорида или иодида калия. [38]
Если диффузионный ток какого-либо иона используется для определения как данного иона, так и других ионов, то это также отмечено в таблице. Например, восстановление иона серебра используется как для определения самого серебра ( по катодному методу), так и для титрования хлорид — или иодид-ионов. Это значит, что диффузионный ток восстановления ионов серебра используется для его определения при помощи растворов хлорида или иодида калия. [39]
Процесс основан на реакции восстановления ионов серебра до металла, которая происходит при смешивании двух растворов — цианидного, нитратного, аммиакатного или смешанного комплекса серебра и восстановителя — пирогаллола, формальдегида или сегнетовой соли. Растворы эти стойки против разложения лишь при раздельном хранении, а при смешивании их компоненты быстро вступают в реакцию, осаждая на стекле зеркальный слой мелкозернистого серебра толщиною менее 1 мкм.
Практически одноразовое использование раствора, содержащего драгоценный металл, неблагоприятно характеризует такой процесс с экономической стороны. Усовершенствование химического серебрения идет по пути повышения стабильности растворов введением в них специальных добавок. Некоторое применение получил процесс контактно-химического серебрения, когда в результате подключения к обрабатываемому металлу более электроотрицательного, например алюминия или магния, на химический процесс накладывается внутренний электролиз. Такой способ приемлем для серебрения внутренней поверхности труб, мелких деталей сложной конфигурации. Толщина получаемых покрытий может достигать 5 — 15 мкм. [40]
Кажется более вероятным, что электроны поступают с примесных уровней, обусловленных присутствием воды. Недавно мы показали, что восстановление ионов серебра в водном растворе может быть фотокатализировано в присутствии чистых TiCb или Si02 светом, который не абсорбируется эти ми-окислами, находящимися в сухом состоянии. [41]
Рассмотрим более подробно явление концентрационной поляризации на капельном ртутном катоде при разряде ионов металла, например кадмия. В отличие от рассмотренного случая восстановления ионов серебра на серебряном электроде, где природа металла в процессе электролиза не меняется, при разряде ионов кадмия на ртутном катоде происходит образование амальгамы кадмия. [42]
Антиоксиданты в жирах Седлачек определяет восстановлением иона серебра . В прямом методе анализа образовавшееся металлическое серебро отфильтровывают, растворяют и титруют; в косвенном методе анализа непрореагировавший ион серебру титруют в фильтрате. В обоих случаях определение серебра выполняют по никельцианидному методу ( см. стр. Альдегиды, гидроксиламин, гидразин и некоторые его производные Будешински определяет [ 61 ( 83) ] окислением кипящим раствором HgY. Освобождается эквивалентное восстановленной ртути количество ЭДТА, которое титруют раствором нитрата свинца с метилтимоловым синим. [43]
Азотная кислота на реакцию не расходуется и добавляется для создания определенной кислотности среды в начале реакции. В качестве промежуточных быстро протекающих процессов происходит восстановление ионов серебра ионами марганца ( II) и обратное окисление серебра персульфатом аммония. Какой ион является катализатором в данном процессе. [44]
В качестве промежуточных быстро протекающих процессов происходило восстановление иона серебра марганцем ( II) и обратное окисление серебра пероксодисульфатом аммония. Какой ион являлся катализатором в данном процессе. [45]
Источник: www.ngpedia.ru
Восстановление тетрагидроборатами щелочных металлов
Применение тетрагидридобората натрия (NaBH4) при получении наночастиц серебра имеет большее распространение, чем использование для этих же целей цитрат-аниона. Это объясняется более высокой восстановительной способностью боргидрида и простотой применения. Как и в цитратном методе, тетрагидридоборат натрия служит одновременно восстановителем и стабилизатором образующихся наночастиц.
Исследование механизма роста наночастиц показало, что в случае применения боргидрида, главную роль играет агрегация образовавшихся кластеров. До этого считалось, основное число коллоидных частиц создается в течение короткого времени нуклеации, а дальнейший рост происходит за счет восстановления ионов серебра на поверхности частиц (как в цитратном методе). Проведенные исследования показали, что концентрация ионов серебра в растворе не меняется во все время роста наночастиц. Это доказывает, что рост частиц не может происходить за счет восстановления серебра на поверхности кластеров. Увеличение размера частиц происходит за счет агрегации кластеров при разложении боргидрида, когда стабилизирующее действие тетрагидридобората натрия уменьшается.
При добавлении к нитрату серебра в присутствии желатина тетрагидробората натрия происходит формирование наночастиц серебра по следующей схеме:
Форма и размер полученных данным методом наночастиц серебра зависят от температурного режима синтеза. При охлаждении получаются монодисперсные частицы размером 10 нм, при повышении температуры размер и степень монодисперсности частиц увеличивается, а также могут формироваться стержнееобразные частицы, имеющие два пика поглощения в спектрах.
Восстановление гидразином
Восстановление ионов меди гидразином можно описать следующим уравнением:
из которых следует, что процесс осуществляется в щелочной среде. В зависимости от условий синтеза могут образовываться наночастицы Cu, Cu2O или их смесь.
С помощью гидразина так же можно получить коллоиды серебра:
Восстановление цитрат-ионом.
Отличительной особенностью этого метода является то, что цитрат-анион одновременно выступает в роли стабилизатора и восстановителя, поэтому концентрация этого иона играет критическую роль: её изменение одновременно влияет на скорость восстановления и на процессы роста частиц.
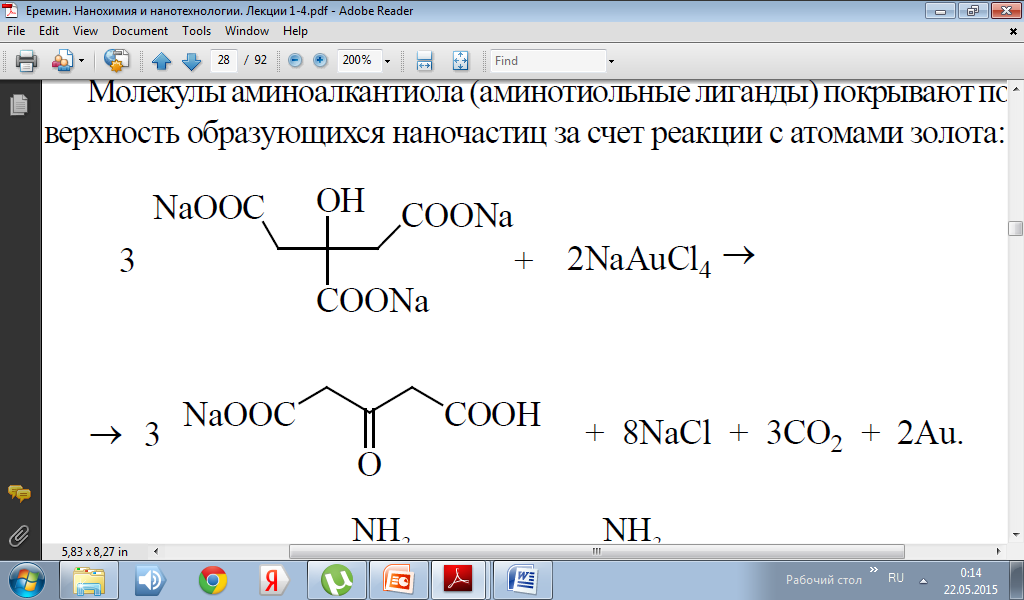
Цитратный метод получения наночастиц золота, разработанный Туркевичем, применим и к получению наночастиц серебра.
Но, так как серебро более активный металл, чем золото, то синтез наночастиц серебра происходит более сложно из-за способности серебра к быстрому окислению и агрегации. Для усиления устойчивости коллоидных растворов серебра наночастицы необходимо стабилизировать.В цитратном методе получения наночастиц серебра и восстановителем и стабилизатором служит цитрат-анион, получаемый при растворении в воде трехзамещенной натриевой соли лимонной кислоты. При нагревании раствора и окислении цитрат-аниона образуется анионы ацетондикарбоновой и итаконовой кислот.
Эти кислоты адсорбируются на поверхности частиц и контролируют их рост.

Восстановление ионов серебра цитратом натрия идет согласно уравнению:
При этом Na3C6H5O7 выступает не только как восстановитель, но и как стабилизатор синтезируемых частиц.
Источник: studfile.net