2). Al, Cr, Fe пассивируются (покрываются защитной пленкой) концентрированной холодной азотной кислотой, поэтому реагируют только при нагревании:
HNO3 (разбавленная)
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag (Аu Pt)
соль + N2 + H2O Соль + NO + H2O не реагируют
HNO3 (очень разбавленная)
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag (Аu Pt)
соль + NH4NO3 + H2O не реагируют
Химические свойства азотной кислоты (взаимодействие с неметаллами)
Азотная кислота восстанавливается до NO2; неметаллы окисляются до соответствующих кислот:
Разбавленная кислота окисляет только фосфор и йод:
Азотная кислота окисляет сложные вещества; при этом может происходить окисление одного из элементов: FeO + 4HNO3(конц) ®Fe(NO3)3 + NO2 + 2H2О
В реакциях между сложными веществами и азотной кислотой, как правило, выделяется NO2, а с разбавленной – NO.
Хлорид и фторид-ионы не окисляются азотной кислотой; бромид и йодид-анионы окисляются до свободных галогенов, азотная кислота восстанавливается до NO (разбавленная) и до NO2 – концентрированная.
эксперимент с серебром.осаждение и отмывка нитрата серебра концентрированной азотной кислотой.
Процессы, происходящие в «царской водке».
HNO3 (конц) + 3HCl (конц) ↔NOCl + 2Cl 0 + 2H2O (комн. темп)
NOCl – оранжево–желтый газ, желтовато–красная жидкость, термически неустойчивое вещество, разлагается при комнатной температуре:
2NOCl ↔2NO + Cl2 Сильно корродирует металлы: 3NOCl + Fe → FeCl3 + 3NO (при комн. темп.)
2 вариант лекции
Азотная кислота (HNO3)
взаимодействие с металлами
1. Разлагается на свету и при нагревании 4HNO3 2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук — «ксантопротеиновая реакция»)
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 → соль азотной кислоты + вода + газ (азот, оксиды азота, аммиак, который в избытке кислоты образует нитрат аммония).
в) HNO3 – окислитель.
Продукты восстановления HNO3 зависят от 2-х факторов: силы восстановителя и концентрации кислоты. Чем сильнее восстановитель и чем более разбавлена кислота, тем более низкую степень окисления имеет азот (N) в продуктах восстановления HNO3:
| восстановитель концентрация HNO3 | щелочные и щелочноземельные металлы, магний, цинк | тяжелые металлы |
| концентрированная кислота (более 67%) | N2 +1 O | N +4 O2 |
| разбавленная кислота (менее 67, более 10%) | N2 | N +2 O |
| Очень разбавленная кислота (менее 10%); реагирует только с металлами, стоящими до водорода в ряду активности. | N –3 H4NO3 | N –3 H4NO3 |
HNO3 не взаимодействует с Au, Pt, Ir, Os.
HNO3(конц.) взаимодействует с Al, Cr, Fe ТОЛЬКО при t°
***С одним и тем же восстановителем, например цинком, кислота, если она концентрированная, будет обязательно реагировать по схеме (1) с выделением NО2; если НNО3 разбавленная, то она может взаимодействовать с Zn по любой схеме (2)-(5), в зависимости от степени разбавления.
Получение концентрированной азотной кислоты
Взаимодействие концентрированной азотной кислоты с металлами:
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag Au Pt
* соль + N2O + Н2О ** соль + NO2 + H2O
1). Al, Cr, Fe пассивируются концентрированной кислотой (покрываясь защитной пленкой из хемосорбированного кислорода), однако при нагревании реакции с этими металлами протекают:
2). * Щелочные и щелочноземельные металлы реагируют с концентрированной кислотой со взрывом, при этом продукты восстановления кислоты могут быть самыми разнообразными (вплоть до NO2). [для ЕГЭ пишем N2O или азот]
3). ** Металлы из середины ряда активности, а также некоторые металлы, стоящие после Н2, при взаимодействии с концентрированной кислотой в качестве продукта восстановления азота образовывают NO2.
4). Благородные металлы (Au, Pt, Os, Ir и др.) не растворяются в азотной кислоте.
Взаимодействие разбавленной азотной кислоты с металлами:
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb H Cu Hg Ag Au Pt
* соль + N2 + Н2О ** соль + NO + H2O
Источник: megalektsii.ru
Серебро плюс азотная кислота разбавленная уравнение реакции
Составьте химическое уравнение по схеме Ag + HNO3 (разб) = ? Охарактеризуйте химический элемент серебро: укажите электронную конфигурацию, приведите основные физические и химические свойства. Каким образом это вещество получают в лаборатории? А в промышленности?
В результате действия разбавленной азотной кислоты на металлическое серебро (Ag + HNO3 (разб) = ?) происходит образование средней соли нитрата серебра, воды и выделение газообразного оксида азота (II). Молекулярное уравнение реакции имеет вид:
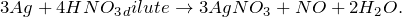
Запишем ионные уравнения, учитывая, что вода, оксиды и простые вещества на ионы не распадаются, т.е. не диссоциируют.
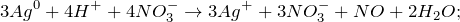
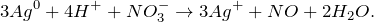
Первое уравнение называют полным ионным, а второе – сокращенным ионным.
Серебро – сорок седьмой элемент Периодической таблицы. Обозначение – Ag от латинского «argentum». Расположен в пятом периоде, IB группе. Относится к металлам. Заряд ядра равен 47. Электронная конфигурация выглядит следующим образом:
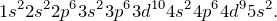
Ag + HNO3 = ? уравнение реакции
Огромная просьба! Надо составить химическое уравнение по схеме Ag + HNO3 = ? Расставьте стехиометрические коэффициенты. Укажите тип взаимодействия. Запишите молекулярное и ионное уравнения реакции. Охарактеризуйте химический элемент серебро: запишите его электронную конфигурацию, укажите основные физические и химические свойства, а также способы получения.
В результате взаимодействия серебра и концентрированной азотной кислоты (Ag + HNO3 = ?) происходит образование средней соли – нитрата серебра (I), воды и выделение диоксида азота (замещение). Молекулярное уравнение реакции имеет вид:
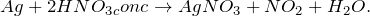
Запишем ионное уравнение, учитывая, что простые вещества, газообразные соединения и вода на ионы не распадаются, т.е. не диссоциируют.
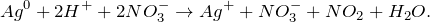
Серебро – сорок седьмой элемент Периодической таблицы. Обозначение – Ag от латинского «argentum». Расположен в пятом периоде, IB группе. Относится к металлам. Заряд ядра равен 47. Электронная конфигурация выглядит следующим образом:
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.

В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.

При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
Азотная кислота способна окислить все неметаллы, при этом, если кислота концентрированная, азот обычно восстанавливается до NO2, если разбавленная — до NO.

В любой концентрации азотная кислота проявляет свойства окислителя, при этом азот восстанавливается до степени окисления от +5 до -3. На какой именно степени окисления остановится азот, зависит от активности металла и концентрации азотной кислоты.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.

Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.

Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Соли азотной кислоты — нитраты NO3 —
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.

Нитрат аммония получают реакция аммиака с азотной кислотой.
Обратите внимание на следующую закономерность: концентрированная азотная кислота, как правило, окисляет железо и хром до +3. Разбавленная кислота — до +2.
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).

Нитраты разлагаются в зависимости от активности металла, входящего в их состав.


Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Серебро плюс азотная кислота разбавленная уравнение реакции
Для выполнения задания используйте следующий перечень веществ: серебро, азотная кислота, гидрокарбонат натрия, сульфат натрия, силикат цинка. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно-восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: серебро, азотная кислота, гидрокарбонат натрия, сульфат натрия, силикат цинка. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Запишем уравнение реакции между разбавленной азотной кислотой и серебром:
Составим электронный баланс:
Серебро в степени окисления 0 является восстановителем. Азот в степени окисления +5 (азотная кислота) — окислителем.
— выбраны вещества, и записано уравнение окислительно-восстановительной реакции;
Взаимодействие серебра с кислотами

В этой статьи мы рассмотрим вопросы химического взаимодействия серебра с различными кислотами. Содержание статьи является информативным, мы не рекомендуем производить химические реакции в домашних условиях, это может быть опасным.
Как взаимодействуют кислоты с серебром?
Серебро – химически малоактивно, поэтому его относят к семейству благородных металлов. В воздухе серебро (как химическое вещество) практически не окисляется, с водой не взаимодействует, является инертным металлом. Серебро в обычных условиях слабо взаимодействует с различными кислотами. Объясняется это тем фактом, что в электрохимическом ряду оно стоит после водорода. Серебро не вступает в химическую реакцию с соляной и разбавленной серной кислотой.
Серебро окисляется в реакции с горячей концентрированной серной кислотой и соляной кислотой в присутствии свободного кислорода. Серебро может вступать в химическую реакцию с кислотами, которые проявляют свойства окислителей, то есть содержать кислород.

Свойства серебра слабого взаимодействия с кислотами активно используется при производстве:
- серебряной посуды,
- серебряных ложек и вилок,
- серебряных ювелирных изделий,
- серебряных монет, наград и значков.
Серебро устойчиво к действию многих холодных и горячих кислот, щелочах и растворах солей, а также в ряде органических соединений. Холодная соляная кислота медленно действует на серебро благодаря образованию нерастворимой пленки из хлорида серебра.
В этой статье мы рассмотрим следующие химические реакции:
- реакция серебра и соляной кислоты;
- реакция серебра и серной кислоты;
- реакция серебра и азотной кислоты.
Взаимодействие серебра с соляной кислотой
Серебро не растворяется в соляной кислоте из-за появления тонкого слоя хлорида серебра. При условии добавления к раствору свободного кислорода в виде перекиси водорода реакция приведет к окислению серебра в хлорид серебра.
Взаимодействие серебра с серной кислотой
Серебро реагирует с концентрированными растворами серной кислоты с образованием соли.
Разбавленная серная кислота при комнатной температуре не взаимодействует с серебром, концентрированная кислота — взаимодействует.
Взаимодействие серебра с азотной кислотой
Серебро реагирует с концентрированными растворами азотной кислот с образованием соли.
Химическая реакция — — > Ag +2HNO3 = AgNO3 + NO2 + H2O.
Химическая реакция — — > 3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O.
Азотная кислота растворяет серебро при различных температурах и концентрациях, а царская водка образует на его поверхности нерастворимую пленку из хлорида серебра.
Другие химические реакции серебра и кислот
Уксусная кислота не действует на серебро при низкой и высокой температурах, но при добавлении в нее небольшого количества соляной кислоты начинается растворение серебра.
Серебро не вступает во взаимодействие с фосфорной кислотой любой концентрации.
Авторские ювелирные брелоки по выгодной цене
- Вы здесь:
- Главная

- Задачи

- Химия-Глинка

- Энергетика химических реакций | Задачи 293 — 297
Источник: ollimpia.ru
Химические свойства концентрированной азотной кислоты (НNO3)
Задача 999.
С какими из перечисленных веществ взаимодействует концентрированная НNO 3 : а) NаОН; 6) СuО; в) Аg; г) КСI?
При этом азотная кислота проявляет: 1) кислотные свойства; 2) окислительные свойства.
Решение:
а) Между концентрированной азотной кислотой и гидроксидом натрия произойдёт реакция нейтрализации:
Здесь азотная кислота проявляет свойства кислоты.
б) Между концентрированной азотной кислотой и оксидом меди (II) произойдёт реакция:
Здесь азотная кислота проявляет свойства кислоты.
в) Между концентрированной азотной кислотой и серебром произойдёт окислительно-восстановительная реакция:
Здесь азотная кислота проявляет окислительные свойства.
г) При слиянии растворов концентрированной кислоты и хлорида калия реакция не произой2дёт, потому что, находящиеся в растворе ионы К + и Cl − (KCl ↔ K + + Cl − ), а также ионы Н + и NO3 − (HNO3 ↔ H + + NO 3 − ) не будут связываться друг с другом с образованием осадка, газа или слабого электролита.
Ответ: а1); б1); в2).
Изомолярные растворы солей
Задача 1000.
Каково соотношение рН изомолярных растворов NаНSО3 (рH1) и Na2SO3 (рH2): а) рH1 > рH2; б) рH1 = рН2;
в) рН1 < рН2?
Решение:
KD1(H2SO3) = 1,58 . 10 -2 ; KD2(H2SO3) = 6,31 . 10 -8
NаНSОз – кислая соль слабой кислоты и сильного основания гидролизуется по аниону:
Na2SO3 – соль слабой кислоты и сильного основания гидролизуется по аниону:
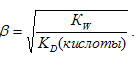
Так как Na2SO3 практически гидролизуется по первой ступени, то то константа гидролиза этой соли будет определяться второй константой диссоциации H2SO3, а соли NаНSО3 – первой константой диссоциации H2SO3. Поэтому константа гидролиза соли Na2SO3 будет больше, чем константа гидролиза соли NаНSО3. Следовательно, степень гидролиза соли NаНSО3 будет меньше, чем степень гидролиза соли Na2SO3 и, соответственно, концентрация ионов OH − в растворе соли NаНSО3 будет значительно меньше, чем в растворе соли Na2SO3, значит рН1 < pH2.
Ответ: в).
Источник: buzani.ru