Спирты не обладают ярко выраженными кислотными или основными свойствами. Как сами спирты, так и их водные растворы не проводят электрический ток в заметной степени. Так как алкильная группа является донором электронов, то электронная плотность на атоме кислорода повышена и диссоциация связи О—Н проходит еще в меньшей степени, чем в молекуле воды:

Благодаря доступности и способности вступать в многочисленные химические реакции спирты играют громадную роль в различных, в том числе в промышленных, синтезах.
Атом водорода гидроксила обладает определенной подвижностью и способен к легкому замещению.
А) Замещение атома водорода в гидроксиле металлом.
Вещества, получающиеся в результате такого замещения называются алкоголятами:

Алкоголяты, образуемые метиловым спиртом, называют метилатами, образуемые этиловым спиртом — этилатами и т. д.
Запомните хитрый совет, как почистить серебро в домашних условиях
Алкоголяты — твердые вещества, легко растворимые в спирте. Алкоголяты натрия — нестойкие соединения, быстро темнеют (осмоляются) на воздухе, особенно при нагревании. Наиболее устойчив метилат натрия. В присутствии следов влаги алкоголяты натрия разлагаются, и вновь образуется спирт:

Реакция образования алкоголята иллюстрирует сходство спиртов с водой. Низшие спирты (СН3ОН, С2Н5ОН) реагируют с натрием бурно, средние — слабо, а высшие реагируют лишь при нагревании. Алкоголяты образуются при действии на спирты и других активных металлов, например магния, алюминия. В реакции образования алкоголята спирт проявляет свойства слабой кислоты.
Б) Замещение атома водорода в гидроксиле ацильной группой с образованием сложных эфиров.
При взаимодействии спиртов с органическими кислотами (лучше в присутствии следов сильных кислот) получаются сложные эфиры:

Реакция образования сложных эфиров называется реакцией этерификации. Реакция этерификации обратима: вода в присутствии кислот или щелочей разлагает сложные эфиры с образованием исходных веществ — кислоты и спирта. Такое гидролитическое разложение сложных эфиров называется реакцией гидролиза. Реакция этерификации, а также образующиеся в результате ее эфиры имеют очень важное промышленное значение.
Гидроксильная группа спирта в некоторых реакциях обладает известной подвижностью и может замещаться или отщепляться.
А) Замещение гидроксила на галоген с образованием гадогенопроизводных углеводородов.
Обычно реакция осуществляется при действии на спирты галогенидов фосфора или серы, а также галогеноводородов:
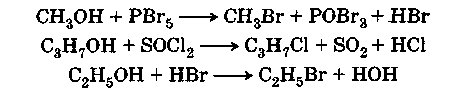
Реакция взаимодействия спирта с галогенопроизводными кислотами обратима. Чтобы добиться большего выхода, т. е. сдвинуть равновесие вправо, необходимо удалять из реакционной смеси воду. Поэтому реакцию ведут в присутствии водоотнимающих веществ, например концентрированной серной кислоты, или же в безводный спирт пропускают газообразный галогеноводород. Чтобы уменьшить количество присутствующей воды, удобнее брать не галогеноводородную кислоту, а ее соль и выделять из нее сухой галогеноводород действием концентрированной серной кислоты.
Б) Образование олефинов путем отщепления воды
При нагревании спирта с большим количеством крепкой серной кислоты или хлоридом цинка, а так же при пропускании паров спирта при 350—500 °С через трубку с оксидом алюминия происходит реакция дегидратации (отнятие воды) и образуются этиленовые углеводороды. Так, например, из этилового спирта получается этилен:

Образование молекулы воды происходит за счет гидроксила и атома водорода у соседнего атома углерода (реакция β-элиминирования).
Легче всего дегидратируются третичные, потом вторичные и затем уже первичные спирты. В спиртах сложного строения преимущественно отщепляется третичный (3-водородный атом, гораздо в меньшей степени — вторичный, и практически не отщепляется первичный (правило Зайцева):
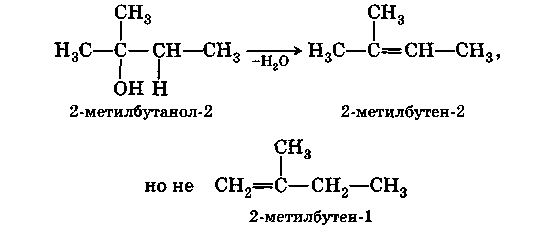
В) Межмолекулярная дегидратация.
При нагревании избытка спирта с серной кислотой или при пропускании паров спирта через порошкообразный безводный сульфат алюминия при 200°С наряду с этиленовыми углеводородами получаются и простые эфиры:
Г) Замена гидроксида на аминогруппу. В жестких условиях (300 °С, оксид алюминия) гидроксильная группа спиртов может быть заменена на аминогруппу с образованием первичных аминов:

Реакция осложняется образованием вторичных (R2NН) и третичных (R3N) аминов в результате взаимодействия спирта с уже образовавшимися аминами.
А) Отщепление водорода (дегидрогенизация, дегидрирование).
При пропускании паров спирта при 200—300°С над мелко раздробленной медью или серебром первичные спирты превращаются в альдегиды, а вторичные — в кетоны. Реакция идет с выделением водорода:

Б) Окисление спиртов.
Окисление обычно проводят сильными окислителями, например К2Сг207 + Н2SО4 или КМп04 + + Н2SО4. При окислении спиртов действие окислителя направляется на тот углеродный атом, который уже связан с гидроксильной группой. Следовательно, в зависимости от того, какой спирт окисляется — первичный, вторичный или третичный, получаются различные продукты окисления.
При окислении вторичных спиртов образуются кетоны:

Окисление первичных спиртов происходит аналогично, но так как в первичных спиртах у углеродного атома, связанного с гидроксилом, на один атом водорода больше, чем во вторичных, то продуктами окисления в этом случае являются альдегиды:
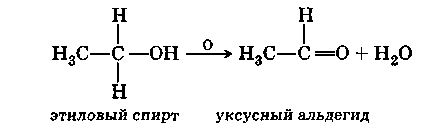
Эту реакцию трудно осуществить с высоким выходом из-за легкой окисляемости образовавшегося альдегида до соответствующей карбоновой кислоты.
Источник: studfile.net
Этиловый спирт серебро реакция
Вторая жизнь украшений — чистка серебра в домашних условиях
Любители серебряных украшений, конечно же, сталкиваются с такой проблемой, как потемнение серебра. Сегодня мы расскажем, как чистить серебро в домашних условиях. Это касается не только украшений, но и посуды, монет и других изделий.

Традиционные методы чистки
Чистка серебра в домашних условиях проводится с использованием каких-либо веществ (чаще всего химических), от соприкосновения с которыми серебро светлеет. У каждой семьи наверняка есть свои рецепты чистки серебра, но все они традиционные и предполагают использование следующих компонентов:
Оригинальные способы чистки
Кроме традиционных способов, чистка серебра в домашних условиях проводится с использованием весьма оригинальных веществ. Например, некоторые используют фольгу, кока-колу, соль и даже губную помаду. Другие пользуются серной кислотой или трут изделие подогретым уксусом. Сегодня мы остановимся на традиционных методах чистки серебра, так как они дают стопроцентный результат и, что самое главное, безопасны для вашего здоровья.
Как почистить серебро в домашних условиях нашатырным спиртом
Этот способ наиболее популярен, потому что не занимает много времени и не требует особых усилий. Для этого нам понадобится 10% нашатырный спирт. Заливаем им наше серебро и оставляем на четверть часа. Затем промываем водой, и серебро как новое!

Чистка серебра в домашних условиях содой
На пол-литра воды добавляем пару столовых ложек пищевой соды. Кипятим на плите. В кипящую воду с содой кидаем наше серебро и «варим» 10-15 минут. Достаем, промываем, и все.
Перекись водорода для чистки серебра
Этот способ хороший, но только в том случае, если вы уверены, что ваши изделия состоят из чистого серебра без каких-либо примесей. Капнете перекись на серебро и потрите. Результат появится сразу же, и серебро снова заблестит.
Чистка зубным порошком
Для начала вымойте ваше серебряное изделие в мыльной воде, затем нанесите на тряпочку зубную пасту или порошок и почистите. Потом вымойте теплой водой.
Как почистить серебро в домашних условиях лимонной кислотой
Разбавьте лимонную кислоту водой 1:3. Положите серебро в этот раствор на полчаса. Затем выньте свое побелевшее изделие.
Этиловый спирт при чистке серебра
Этот метод чаще всего используют для чистки серебряных изделий с золотым напылением. Смочите тряпочку в этиловом спирте (можно взять также скип@$&р или денатурат) и тщательно потрите изделие.

Выбор метода чистки серебра и меры по предотвращению его потемнения
Чистка серебра в домашних условиях тем или иным методом зависит от того, какое у вас изделие. Если металл низкой пробы с примесями, то такие изделия лучше чистить специальными средствами, например, раствором Трилона (10%). Или лучше обратитесь в ювелирную мастерскую, где специалисты сделают эту работу за вас.
Правильная эксплуатация и хранение серебряных изделий предупредит их потемнение. Снимайте украшения, когда занимаетесь домашними делами, так как от соприкосновения с некоторыми химическими элементами (в частности, с серой) серебро темнеет. Если пока не собираетесь носить украшения, то храните их в футлярах и подальше от аптечки. Влажность в помещении не должна быть высокой. Соблюдайте эти несложные правила, и ваши серебряные изделия всегда будут сиять!
Этиловый спирт серебро реакция


Органическая химия
Качественные реакции в органической химии
Качественные реакции на алканы
Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
Качественные реакции на алкены
а) Обесцвечивание перманганата калия (реакция Вагнера).
При этом этилен окисляется в двухатомный спирт этиленгликоль .
б) Обесцвечивание бромной воды:
Качественные реакции на алкины
а) Обесцвечивание перманганата калия (реакция Вагнера).
б) Обесцвечивание бромной воды:
в) Взаимодействие с с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса)
Получившийся ацетиленид серебра (I) выпадает в осадок.
Алкины, у которых тройная связь в середине (R-C≡C-R) в эту реакцию не вступают.
Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогащается электронной плотностью и протон становится подвижным.
Качественные реакции на альдегиды
а) Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала)
Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
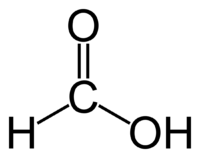
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
б) Взаимодействие с гидроксидом меди (II) (реакция медного зеркала)
Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CH 3 -CHO + 2Cu(OH) 2 —> CH 3 -COOH + Cu 2 O↓ + 2H 2 O (реакция идет при нагревании)
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
в) Взаимодействие с раствором фуксинсернистой кислоты.
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных спиртов реакции различны.
а) Окисление спирта оксидом меди.
Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
б) Взаимодействие с натрием.
Качественные реакции на многоатомные спирты
а) Взаимодействие с гидроксидом меди (II).
В отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания.
К примеру, при приливании глицерина образуется глицерат меди (II) ( хелатный комплекс темно-синего цвета):
Распространённые глупости, в которые верят самогонщики. Металлы в самогоноварении
Существует много заблуждений относительно того, какой металл допустимо использовать в самогонном аппарате, а какой категорически применять не стоит. Сейчас мы будем разбираться с самыми популярными из них.
В самогоноварении можно использовать только пищевую нержавейку. По этому поводу можно услышать много чего – и то, что у «неправильной» нержавейки состав не такой, как надо, и что пищевая нержавейка не должна магнититься, и так далее и тому подобное. Начнём с того, что в ГОСТах вообще не существует такого понятия как «пищевая нержавейка».
Антикоррозийный эффект нержавеющей стали достигается за счёт добавления в сплав хрома. Его может быть от 12 до 27%. Чем больше хрома, тем выше устойчивость к коррозии. Также для улучшения антикоррозийных свойств металла дополнительно используют другие вещества. За счёт этих примесей на поверхности стали образуется плёнка из нерастворимых окислов, не дающая металлу взаимодействовать с окружающей средой.
Таким образом, никакой особой «пищевой» нержавейки попросту не существует – марки нержавеющей стали отличаются процентным составом компонентов, степенью устойчивости к коррозии и являются безопасными для человека.
Медь связывает соединения серы и улучшает вкус продукта. Первое отчасти верно. Медь при высоких температурах реагирует с растворимыми и летучими соединениями серы, образуя нерастворимые и нелетучие. Если у вас в браге присутствует сера, медь её свяжет и при этом потемнеет. Но эта реакция происходит только на поверхности чистого металла.
А уже через несколько минут медь покрывается слоем окислов и перестаёт работать. Обычная медная трубка никакого «связывающего» эффекта не даст. Нужны вставки с большой площадью контакта. Отчасти в этом смысле оправдано применение мочалок и колец, которые помещают в царгу.
Но и они тоже быстро покрываются окислами и работают разве что на укрепление продукта, но никак не на его очистку. Удалить же налёт с таких поверхностей крайне проблематично, так что подобные изделия можно рассматривать как одноразовые.
Что касается второго вопроса, то тут всё ещё более неоднозначно. Лично я не заметил никакой разницы во вкусе напитков, полученных на меди и нержавейке. Однако известно, что контакт с медью ускоряет старение спиртов и, как следствие, дистиллят созревает быстрее. Если для связывания серы важен контакт пара с медью, то здесь с металлом должен контактировать спирт.
То есть значение имеет материал холодильника, а не бака и паропроводящей магистрали. Но главная беда в том, что соединения меди, влияющие на старение спиртов, являются вредными для организма. Так что тут палка о двух концах. А, в целом, полезность меди в самогоноварении слишком преувеличена.
Латунь и алюминий использовать недопустимо. Главная претензия к латуни – в ней содержится цинк. А он ядовит. От 150 миллиграмм опасен для здоровья, а доза в 6 грамм смертельна. Однако на самом деле латунь гораздо безопасней меди.
Цинк выступает в качестве легирующего компонента, как хром в нержавейке, и препятствует окислительным процессам. Поэтому, в отличие от меди, латунь практически ничего не выделяет в процессе контакта с брагой, спиртом и спиртовыми парами. А для того, чтобы цинк и другие примеси начали активно вымываться, нужна температура значительно выше 100 градусов. Таким образом, латунь подходит не только для различных соединительных фитингов и трубок, но и для изготовления холодильника. Чистить его проще, чем медный, антикоррозийные свойства этого материала выше, а сам он значительно прочнее.
Алюминий, по мнению многих самогонщиков, взаимодействует с кислотами, содержащимися в браге, и выделяет вредные вещества. На самом деле алюминий очень ограниченно взаимодействует с кислотами и уж тем более никаких страшных ядов не выделяет. Куда опасней для него щёлочь. Поэтому категорически не стоит сыпать в брагу соду или мел, если вы собираетесь перегонять её в алюминиевом бидоне. В этом случае есть риск, что бак очень скоро потечёт.
Холодильников из алюминия лично я не видел, но они существуют и используются. Коррозии такие изделия подвержены ничуть не больше медных, зато не выделяют вредных окислов. Непопулярность этого материала обусловлена исключительно тем, что паять его сложно.
Таким образом, все вышеперечисленные металлы могут быть использованы в самогонном аппарате.
- Свежие записи
- Где находится датчик температуры охлаждающей жидкости на ЯМЗ 534?
- Эффект Холла и измерение величин датчиками Холла
- Датчик холла на ВАЗ 2109 инжектор: устройство и функции
- Датчик глубины в телефонах Samsung: что это такое и для чего нужен?
- Последствия неисправности датчика распредвала и как ее обнаружить
Источник: ollimpia.ru