Решетку алмазного типа имеют важнейшие элементарные полупроводники, принадлежащие к IV группе периодической системы элементов: германий, кремний, а также серое олово.

Все связи в структуре алмаза направлены по и составляют друг с другом 109 28’. Каждый атом окружен четырьмя такими же атомами, располагающимися по вершинам тетраэдра (рис.7).
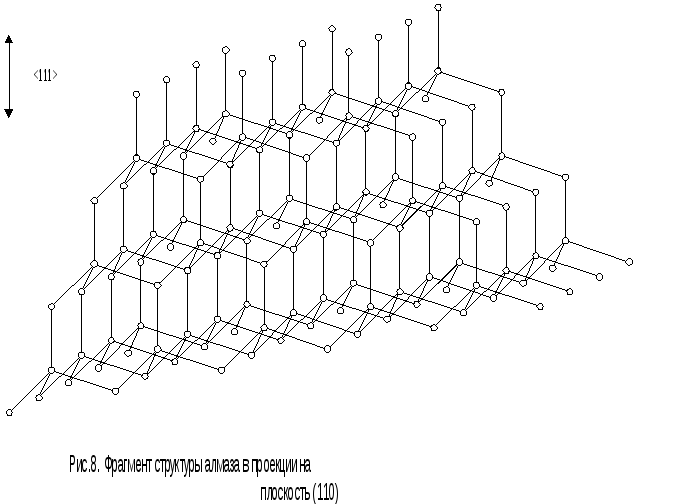
В результате пространственная решетка формируется в форме, фрагмент которой приведен на рис.8. В ней можно выделить кубическую элементарную ячейку,
представленную на рис.9. Такая ячейка не является примитивной. Внутри ее находятся четыре атома, связанные с атомами, расположенными на углах куба, а также в середине его граней. На одну элементарную ячейку приходится 8 атомов: в вершинах куба 81/8, на гранях 61/2 и внутри ячейки четыре. Координаты базиса [[000]], [[0,1/2,1/2]], [[1/2,0,1/2]], [[1/2,1/2,0]], [[1/4,1/4,1/4]], [[1/4,3/4,3/4]], [[3/4,1/4,3/4]], [[3/4,3/4,1/4]].
Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 класс
На рис.8 ясно видно, что структура, являясь однородной, должна быть анизотропной, т.е. ее свойства в различных направлениях неодинаковы. Так, в структуре четко видны шестисторонние «каналы» в направлениях , проходящие насквозь. По этим каналам особо легко идет диффузия примесей в кристалле.
Другие проявления анизотропных свойств полупроводников типа алмаза обсуждаются ниже. Их основные характеристики приведены в табл. 1.
Характеристики элементарных полупроводников
со структурой типа алмаза
Параметр решетки, Å
Температура плавления, С
Ширина запрещенной зоны, эВ
4. Связь свойств кристаллов кремния со структурой его кристаллической решетки
В кристаллографии существует закон, по которому важнейшие по развитию и частоте встречаемости грани кристалла совпадают с плоскостями, наиболее густо покрытыми атомами. Эти же грани проще всего выявляются анизотропными травителями. Этим же объясняется неодинаковая твердость кристалла на разных гранях и по разным направлениям. Количество атомов, приходящихся на единицу поверхности плоской сетки, называются ее плотностью. Важнейшие грани кристалла совпадают с плотнейшими плоскими сетками.
Кроме плотности сеток иногда учитывают также интенсивность сил связи между атомами в различных направлениях, приходящихся на единицу площади сетки. Как правило, выводы об анизотропных свойствах кристалла, получающиеся при обоих подходах, непротиворечивы.
Проанализируем с этой точки зрения структуру кристалла кремния, соответствующую структуре алмаза. На рис.10 представлена элементарная ячейка в виде куба, выделенная в КР кремния. По существу она не отличается от кубической ячейки, изображенной на рис.9, но в ней опущены обозначения сязей между атомами и она более удобна для анализа плоских сеток в структуре КР. Для наглядности тетраэдр, образованный внутренними атомами ячейки, обозначен пунктиром.
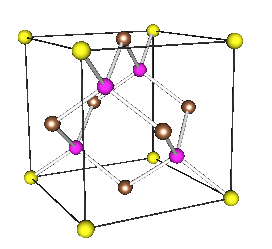
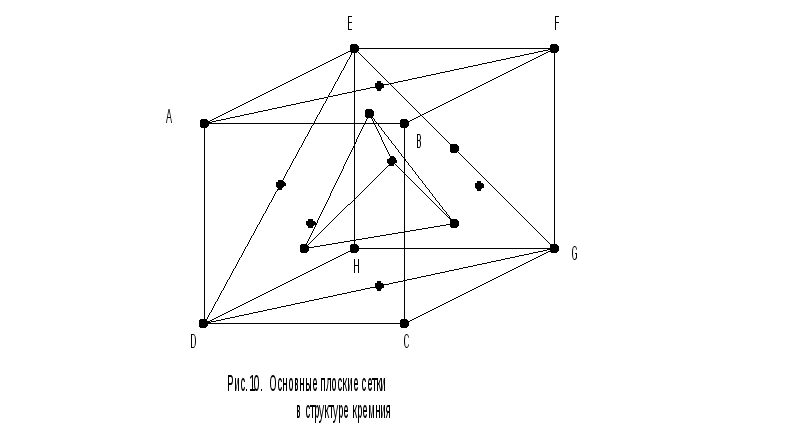
Рис.9. Модель кристаллической решетки алмазоподобного типа
Одна из граней куба совпадает с плоской сеткой ABCD, соответствующей плоскости (100); она изображена на рис.11.
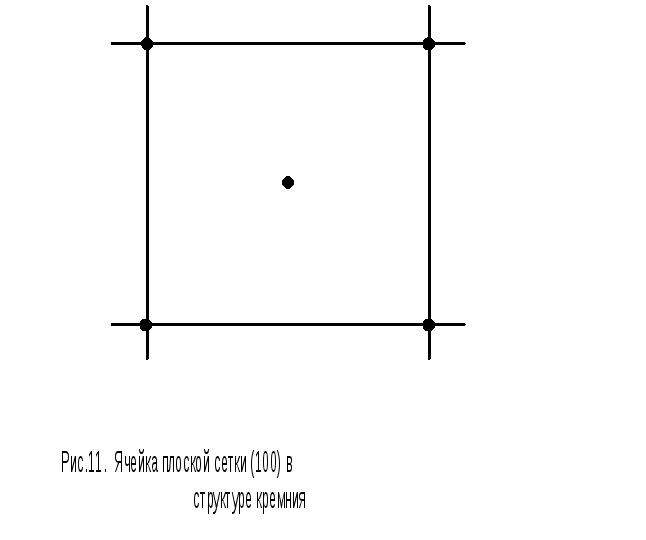
Можно подсчитать, сколько атомов приходится на единицу поверхности такой сетки. Если сторона квадрата (постоянная решетки) равна а, то его площадь равна а 2 . Один атом, находящийся в середине квадрата, плоскостью принадлежит ему. Четыре атома, расположенные по вершинам квадрата, принадлежат ему частично.
Каждый из них входит также в состав трех квадратов, примыкающих к рассматриваемому в плоской сетке. Таким образом, на долю каждого из четырех смежных квадратов в плоскости (100) приходится четвертая часть атома, расположенного в общей вершине. Поскольку вершин четыре, то на площадь рассматриваемого квадрата приходится четыре четвертых атомов, расположенных на вершинах, т.е. всего один атом. С учетом атома, расположенного в центре квадрата, получаем два атома на рассматриваемой грани куба, и плотность плоской сетки, отвечающей грани (100), равна 2/а 2 .
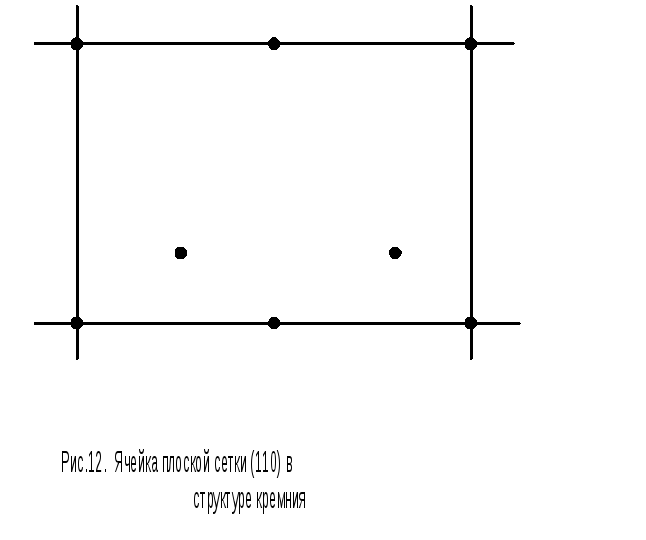
Плоская сетка, соответствующая грани (110), на рис.10, совпадает с прямоугольником AFGD. Отдельно ячейка такой сетки изображена на рис.12. Площадь прямоугольника, соответствующего этой сетке, равна а 2 2. На эту площадь целиком приходится два атома, находящиеся внутри прямоугольника, четыре четверти атомов, лежащих на верхней и нижней сторонах прямоугольника. Таким образом, на площадь а 2 2 приходится всего 2+41/4+21/2=4 атома и плотность плоской сетки (110) равна 4/ а 2 2.
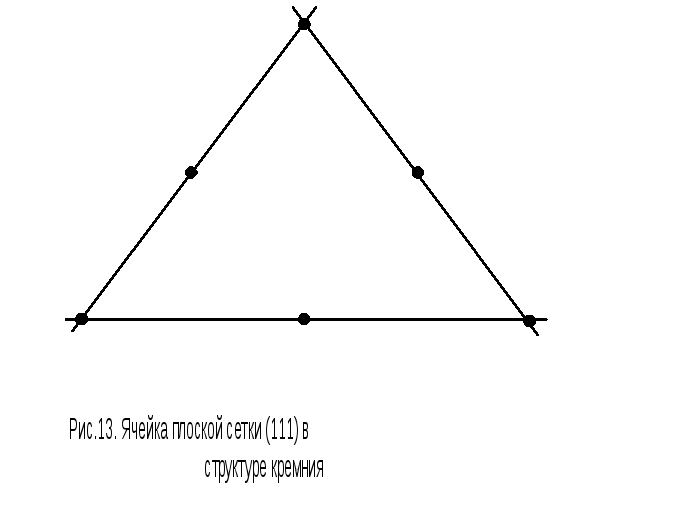
Плоская сетка (111) на рис.10 соответствует треугольнику EGD, который выделен на рис.13. Его площадь равна а 2 3/2. На эту площадь приходится всего два атома: три половинки атомов, находящихся на серединах сторон, и три шестых атомов, расположенных по вершинам. Плоскость (111) целиком покрыта этими треугольниками. Таким образом, на площадь a 2 3/2 приходится два атома: 31/2+31/6=2, следовательно, плотность плоской сетки (111) равна 2/( а 2 3/2) = 4/( а 2 3).
Если принять плотность плоской сетки (100) за единицу, рассмотренные плотности сеток (110), (111) и (100) будут сотноситься приблизительно следующим образом:
Это самые плотные сетки в кремнии, все остальные имеют меньшие плотности.

Но помимо плотности сеток необходимо учитывать их взаимное расположение и энергию связи между атомами. На рис.14 изображены расстояния между соседними взаимопараллельными плоскими сетками (111), (110), (100).
Сетки ориентированы перпендикулярно относительно чертежа и их проекции показаны прямыми линиями. Из рисунка видно, что пространственное расположение сеток не одинаково. Сетки (110) и (100) расположены равномерно, но отличаются межплоскостными расстояниями. Так, для сеток (110) межплоскостные расстояния составляют а2/2, а для сеток (100) они равны а/4. Для сеток (111) картина сложнее.
Здесь наблюдается чередование больших и малых межплоскостных расстояний, т.е. сетки образуют тесно сближенные пары, причем расстояния между этими парами значительно больше, чем между сетками в паре. Расстояние между сближенными сетками в паре составляет а2/12, а расстояние между парами сеток равно а3/4, т.е. втрое больше. Две сближенные сетки тесно связаны между собой и так близки друг к другу, что практически их можно рассматривать как одну утолщенную плоскую сетку. Естественно, при этом плотность такой эквивалентной сетки удвоится и станет равной 8 а 2 3.
Соотношение плотностей сеток при этом изменится:
Если исходить не из плотностей сеток, а из числа наиболее интенсивных сил связи, приходящихся на плоскость сетки, то приведенное соотношение также имеет место. Таким образом, плоскость (111) в кристалле кремния следует считать «наиболее прочной».
Такой вывод хорошо согласуется с физическими данными.
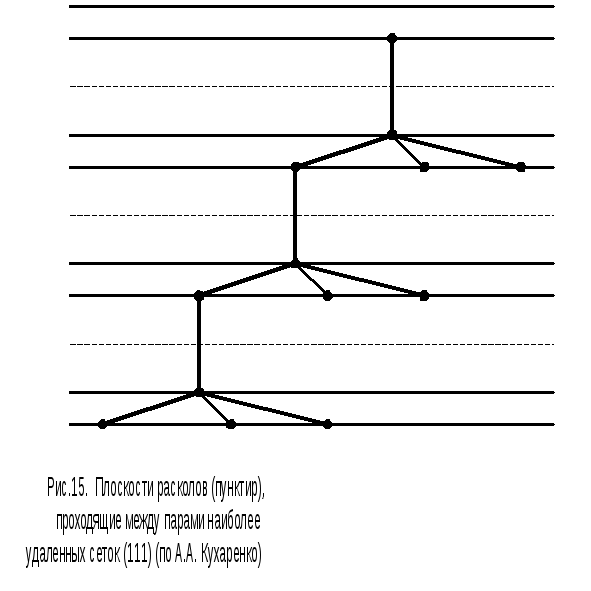
Так, монокристалл кремния наиболее легко раскалывается по плоскостям, параллельным (111). Причину этого наглядно иллюстрирует рис.15, где показано расположение атомов в сетках (111) (сами сетки перпендикулярны плоскости чертежа и соответствуют прямым линиям). На рисунке видны сближенные пары сеток и чередующиеся большие и малые межплоскостные расстояния. Видно также, что для разделения далеко отстоящих друг от друга сеток достаточно разорвать одну валентную связь между атомами, в то время как внутри «толстой» сетки атомы объединены тремя валентными связями и разделить две близко расположенные сетки значительно труднее.
Также можно объяснить и неодинаковую твердость кристалла на различных гранях и по различным направлениям (применительно к алмазам, имеющим ту же структуру, что и кремний, преобладающая твердость на плоскости (111) была известна ювелирам уже давно).
Сильно отличаются скорости травления кремниевых структур в анизотропных травителях. Здесь также, поскольку плотность сетки плоскости (111) наибольшая, она упорнее всего поддается травлению и скорость травления в направлении нормальном к (111) минимальна.
Источник: studfile.net
Формула алмаза

Молярная масса равна г/моль.
Физические свойства – это одно из самых твёрдых веществ с плотностью 3,47—3,55 г/см , обычно бесцветный, но может иметь различные цвета, прозрачный, хрупкий, блестящий.
Плохо проводит электрический ток. Не плавится, сублимируется при , устойчив при нагревании в отсутствие кислорода.
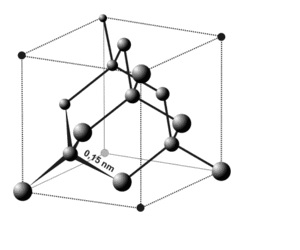
Кристаллическая решетка алмаза гранецентрированная кубическая (а = 0,357 нм, z = 4). Атомы углерода в алмазе имеют -гибридизацию. Каждый атом С в структуре алмаза находится в центре тетраэдра, вершинами которого служат четыре соседних атома.
На рисунке ниже показана элементарная ячейка алмаза:
Химические свойства алмаза
- Так как алмаз очень твёрдое вещество, то он является достаточно инертным, поэтому его основная реакция – это горение в кислороде при высокой температуре:
Получение алмаза
Алмаз является природным ископаемым, хотя его можно получить и искусственно. В промышленности алмазы получают из графита при высоких температуре и давлении.
Применение
Алмаз используется для создания ювелирных украшений, для изготовления ножей, свёрл, резцов, применяется как абразив, используется в микроэлектронике.
Примеры решения задач
| Задание | Рассчитайте константу равновесия превращения алмаза в графит при . |
| Решение | Запишем уравнение реакции: |
![]()
Рассчитаем изменение энтальпии и энтропии реакции:
![]()
кДж/моль = Дж/моль
![]()
Дж/моль
Рассчитаем изменение энергии Гиббса реакции:
![]()
Дж/моль
Рассчитаем константу равновесия:
![]()
| Задание | Рассчитайте изменение теплоемкости при превращении алмаза в графит при . |
| Решение | Запишем уравнение реакции: |
![]()
Рассчитаем изменение теплоемкости:
![]()
Дж/моль
Источник: ru.solverbook.com
Кристаллическая решетка и свойства алмаза
Алмаз — минерал, который является не чем иным, как модификацией углерода. Чистый алмаз имеет формулу, состоящую всего из одного элемента. Камень обладает уникальными свойствами в природе, поэтому кристаллическая решетка алмаза заинтересовала ученых, и структура вещества продолжает изучаться.
Идеальный алмаз можно представить как гигантскую молекулу углерода. Состав минерала ученые изучили только в конце XVIII века. С того момента начались попытки искусственного синтеза алмаза в лабораториях, но они были бессмысленными, поскольку отстроить кристаллическую решетку с нуля не получалось.

А еще техника не была на таком уровне, чтоб создать условия для образования алмаза. Только в пятидесятых годах ХХ века ученые смогли синтезировать алмаз самостоятельно. Этим занимались такие страны, как СССР, США и ЮАР.
Строение вещества
Вся загвоздка и сложность производства заключалась в уникальной структуре алмаза. Между атомами в химии может сформироваться четыре типа связи:
- ковалентная;
- ионная;
- металлическая;
- водородная.
Самая прочная из них — ковалентная связь. Она также имеет свои подвиды: сигма-связи и пи-связи. Второй подвид менее прочный. В алмазе есть несколько миллионов атомов углерода, которые соединены между собой с помощью ковалентных связей.
Пространственное расположение атомов и их соединения называются кристаллической решеткой. Именно ее строение и обусловливает такую характеристику, как твердость вещества. Элементарная ячейка структуры алмаза выглядит как куб. То есть алмаз кристаллизуется в кубической сингонии, если пользоваться научной терминологией.
На вершинах этого куба находится по атому углерода. По одному атому располагается в каждой грани, а еще четыре — внутри куба. Центральные атомы в гранях являются общими для двух ячеек, а те, что находятся в вершинах куба, — общие для восьми ячеек. Между собой атомы соединены ковалентными сигма-связями.
Такая структура и упаковка считается наиболее плотной. Каждый атом углерода располагается в центре тетраэдра и связан по всем сторонам. Поскольку валентность углерода равняется четырем, то все связи оказываются перекрытыми, и взаимодействие с веществом со стороны невозможно.
Расстояние между атомами одинаковое, свободных электронов нет, поэтому минерал является хорошим диэлектриком. Твердость алмаза достигается именно благодаря такому строению. Эти характеристики, в свою очередь, и стали причиной широкого использования камней. Они применяются не только в ювелирном деле, но и в качестве абразива, а также покрытия для инструментов.
Но не все в природе идеально. Даже в алмазах часто встречаются примеси. Такая структура позволяет минералу выглядеть абсолютно прозрачным, без включений. Но добываемые камни не всегда обладают ювелирными свойствами из-за большого количества дефектов и примесей.
Кристалл алмаза может содержать такие вещества:
- алюминий;
- кальций;
- магний;
- гранит.
Иногда в составе встречается вода, углекислота или другие газы. Примеси в кристалле располагаются неравномерно и несколько нарушают кристаллическую структуру. Если дефекты располагаются на периферии, что происходит чаще, тогда с ними можно бороться с помощью огранки.
Аллотропные модификации
Не только алмаз имеет подобный тип строения кристаллической решетки. Другие элементы из четвертой группы также имеют похожую структуру. Но все дело в атомной массе. Атомы углерода располагаются на близком расстоянии друг от друга, что делает связи прочнее. А вот с увеличением атомной массы элементы располагаются дальше и прочность соединений между ними падает.
А также у углерода есть в природе аллотропные модификации, куда, кроме алмаза, входят и другие вещества:
- графит;
- лонсдейлит;
- сажа, уголь;
- фуллерены;
- углеродные нанотрубки.
Ученых интересовала возможность превращения графита в алмаз. Сделать это можно только под действиями очень высокого давления и температуры.
Все дело в том, что графит отличается по пространственному расположению атомов и связям между ними. Если у алмаза все связи ковалентные-сигма, то пространственные связи графита — пи-соединения. А также в решетке графита остается несколько свободных электронов у атомов, которые перемещаясь, создают эффект электропроводности. Такая форма решетки называется гексагональной. Поэтому графит по шкале твердости имеет показатель единицу.
Лонсдейлиты еще не изучены окончательно, поскольку их добывают либо искусственно, либо из метеоритов, упавших на землю.
А вот фуллерены имеют кристаллическую решетку, напоминающую мяч, сложенный из восьмиугольников. По углам фигур расположены не атомы, а молекулы углерода. Эти вещества также продолжают исследовать.
Химический состав алмаза записывается формулой или элементом С.
Кроме показателя твердости — 10 из 10 по шкале Мооса — алмаз обладает такими характеристиками:
- Плотность — 3,5 г/см3.
- Камень довольно хрупкий. Несмотря на твердость, алмаз можно разрушить резким ударом.
- Спайность. Плотность у вещества неравномерная. Камень раскалывается по параллельным граням кристалла. Спайность должна учитываться при огранке камня, поскольку расчет ювелира и последующий удар определяет плоскость скола и отсекает ненужные примеси.
- Камень должен быть прозрачным. Тогда после огранки он будет играть на свету. Самые дорогие экземпляры называют алмазами чистой воды. Но все равно встречается до 5 % примесей в структуре, что искажает кристаллическую решетку, а иногда и портит вид камня.
- Если воздействовать на камень рентгеновскими лучами, то прочность ковалентных связей нарушится. В результате решетка станет рыхлой и твердость вещества также снизится. Но после этой процедуры появится интересное свойство: камень будет излучать свет в синей и зеленой части спектра.
В природе добытый минерал имеет форму кристалла с разным количеством граней. Иногда добывают не полные камни, а только сколы от больших алмазов. Определить скол это или полноценный минерал можно, изучив строение кристаллической решётки. Грани минералов часто покрыты наростами и углублениями.
Цвет алмаза также отличается разнообразием. Встречаются желтые, красноватые или даже черные оттенки алмазов. Конечно, кристаллическая решетка у камней изменена. Но свойства от этого страдают не сильно. Такие минералы называют фантазийными.
Их окраска может быть неравномерной и зависеть от примесей в структуре.
Идеальное строение существует только у искусственных алмазов. Производство этих камней требует затравки в виде натурального кристалла, а также большого количества денежных вложений и аппаратуры. Но именно изучение кристаллической решетки и повлияло на развитие этой отрасли.
Источник: dedpodaril.com