На выполнение работы отводится 20 минут. Работа состоит из 3 частей и включает 8 заданий.
Часть А включает 5 заданий базового уровня. К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания- 1 балл.
Часть В состоит из 2 заданий повышенного уровня, в которых необходимо указать ответ и дописать пропущенные слова. За выполнение задания — по 2 балла.
Часть С содержит 1 наиболее сложное объемное задание, которое требует полного решения задачи. За выполнение задания вы можете получить 6 балла.
Баллы, полученные за выполненные задания, суммируются. Максимально вы можете набрать 15 баллов. Желаю успеха!
Скачать:
| |
43.5 КБ |
Источник: nsportal.ru
159. Что такое нуклеозиды. Структурные формулы.
Хлор. Состав. Строение

Хлор
I . История открытия хлора
II. Хлор – химический элемент:
1. Положение хлора в ПСХЭ.Строение атома
2. Нахождение в природе
III. Хлор – простое вещество:
1. Состав. Строение
2. Получение:
а) в промышленности
б) в лаборатории
3. Химические свойства
4. Применение
IV. Тест
2.
История открытия хлора
В 1774 году шведский химик Карл Вильгельм
Шееле (1742 – 1786) провел опыт, который
позволил ему открыть элемент хлор.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Полученный газ шведский химик назвал
«дефлогистированной муриевой кислотой».
В 1812 году французский химик Жозеф
Луи Гей-Люссак (1778 – 1850) дал газу,
полученному Шееле, его современное
название «хлор», в переводе с греческого
«желто-зеленый».
3.
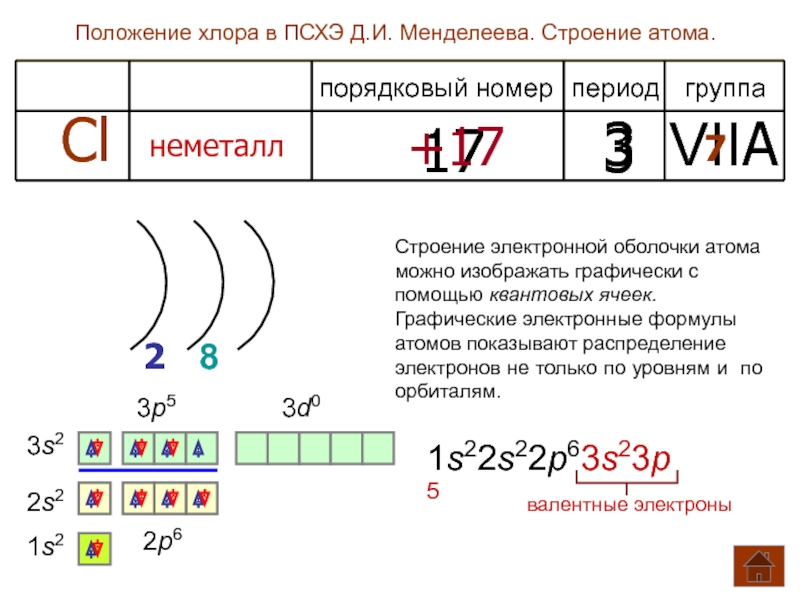
Положение хлора в ПСХЭ Д.И. Менделеева. Строение атома.
порядковый номер период группа
Cl
неметалл
2 8
3p5
3s2
7
3 VIIA
Строение электронной оболочки атома
можно изображать графически с
помощью квантовых ячеек.
Графические электронные формулы
атомов показывают распределение
электронов не только по уровням и по
орбиталям.
1s22s22p63s23p5
2s2
1s2
3d0
+17
17
валентные электроны
2p6
4.
Нахождение в природе
По распространенности в природе хлор занимает 11-е место.
Хлор образует следующие важнейшие минералы:
1. Галит (хлорид натрия NaCl).
Важнейший пищевой продукт,
консервирующее средство.
Широко используется в химической промышленности для
Химия| Химические формулы и их применение
получения хлора, соляной
кислоты, гидроксида натрия.
2. Сильвин (хлорид калия KCl);
3. Сильвинит (хлорид калия-натрия KCl · NaCl);
4. Бишофит (хлорид магния MgCl2·6H2O);
5. Карналлит KCl ·MgCl2 · 6H2O);
6. Каинит (KCl · MgSO4 · 3H2O)/
Соединения хлора содержаться в гидросфере: соленых морях и озерах
(Эльтон, Баскунчак).
Соединения хлора обязательно присутствуют в живых организмах, прежде
всего в их жидких средах: крови, желудочном соке, лимфе и др.
5.
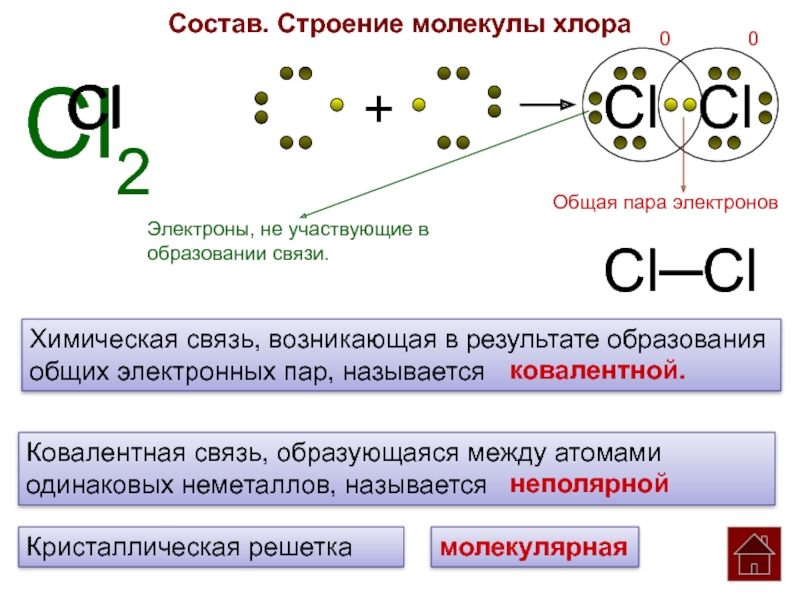
Состав. Строение молекулы хлора
Cl
Cl2
+
Электроны, не участвующие в
образовании связи.
0
0
Cl Cl
Общая пара электронов
Cl─Cl
Химическая связь, возникающая в результате образования
общих электронных пар, называется ковалентной.
Ковалентная связь, образующаяся между атомами
одинаковых неметаллов, называется неполярной
Кристаллическая решетка
молекулярная
6.
Получение хлора
В лаборатории:
2KMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O
В промышленности хлор получают электролизом раствора или
расплава хлорида натрия.
2NaCl + H2O → 2NaOH + Cl2
2NaCl → 2Na + Cl2
7.
Химические свойства хлора
1.Взаимодействие с простыми
веществами:
а) металлами
б) неметаллами
2. Взаимодействие со сложными
веществами
3. Взаимодействие с органическими
веществами
4. Кислородные соединения хлора
8.
1. Взаимодействие с простыми веществами (металлами):
а)Наиболее энергично хлор реагирует с металлами, причем с некоторыми
из них (сурьмой, цезием, рубидием) уже при обычных условиях.
Для реакций с другими металлами требуется нагревание.
Составьте уравнения реакций взаимодействия хлора с
сурьмой,
учитывая, что образуется
хлорид сурьмы (III) или (V)
2Sb0 + 3Cl20 = 2Sb+3Cl¯
Sb0 – 3e → Sb+3 3 2
Cl20 + 2e → 2Cl¯ 2 3
Sb – восстановитель,
процесс окисления.
Сl2 – окислитель,
процесс восстановления
железом
медью
2Fe0 + 3Cl20 = 2Fe+3Cl3¯
Cu0 + Cl20 = Cu+2Cl2¯
Fe0 – 3e → Fe+3 3 2
Cl20 + 2e →2Cl¯ 2 3
Fe – восстановитель,
Cu0 – 2e → Cu+2 2 1
Cl20 + 2e →2Cl¯ 2 1
Cu – восстановитель,
процесс окисления.
Сl2 – окислитель,
процесс восстановления
процесс окисления.
Сl2 – окислитель,
процесс восстановления
9.
Взаимодействие с простыми веществами (неметаллами)
Взаимодействие хлора с фосфором
Составьте уравнение реакции. Рассмотрите с т.зр. ОВР.
3Cl20 + 2P 0 = 2P+3Cl3¯
Cl20 + 2e →2Cl¯ 2 3
P0 ─ 3e → P+3 3 2
5Cl20 + 2P 0 = 2P+5Cl5¯
Cl20 + 2e →2Cl¯ 2 5
P0 ─ 5e → P+5 5 2
Cl2 ─окислитель, процесс восстановления.
P ─ восстановитель, процесс окисления.
10.
Взаимодействие хлора с водородом
Составьте уравнение реакции взаимодействия хлора с водородом. Рассмотрите
с т. зр. ОВР
Cl20 + H20 = 2H+Cl−
Cl2− окислитель, пр. восстановления.
0
−
Cl2 + 2e → 2Cl 2 1
H2− восстановитель, пр. окисления.
0
+
H2 – 2e → 2H 2 1
11.
Взаимодействие со сложными веществами
F2
Cl2
Br2
I2
Хлор энергично взаимодействует
с сероводородом.
уменьшение окислительных свойств
увеличение восстановительных свойств
Хлор вытесняет бром и иод из растворов
их солей:
Составьте уравнения реакции
взаимодействия хлора с сероводородом. Рассмотрите с т.зр. ОВР
Составьте уравнения реакций вытеснения
хлором брома и иода из раствора иодида
калия.
Cl2 + 2KBr = 2KCl + Br2
Cl2 + 2KI = 2KCl + I2
Cl20 + H2S─2 = S0 + 2HCl¯
Cl20 + 2e → 2Cl¯ 2 1
S─2 ─ 2e → S0
2 1
Cl2─ окислитель, пр. восстановления
S ─ восстановитель, пр. окисления.
12.
Хлор вступает в реакции с органическими веществами
13.
Взаимодействие хлора с органическими растворителями
Растворение хлора в воде сопровождается и химическим взаимодействием.
Cl2 + H2O ↔ HCl + HClO
хлорноватистая кислота
Хлорноватистая кислота при разложении образует атомарный кислород:
HClO = HCl + O
14.
Кислородные соединения хлора
Хлор непосредственно с кислородом не взаимодействует, однако этот галоген
образует достаточно много кислородных соединений.
степень
окисления
формула
кислоты
название
формула
аниона
название
пример
+1
HClO
хлорноватистая
ClO¯
гипохлорит-ион
NaClO
+3
HClO2
хлористая
ClO2¯
хлорит-ион
NaClO2
+5
HClO3
хлорноватая
ClO3¯
хлорат-ион
NaClO3
+7
HClO4
хлорная
ClO4¯
перхлорат-ион
NaClO4
HClO
HClO2
HClO3
HClO4
усиление кислотных свойств
Сила кислот увеличивается с увеличением степени окисления атома хлора
Когда хлор пропускают в холодный раствор NaOH получается раствор «Белизна»
CI2 + 2NaOH = NaCl + NaClO + H2O
Широко используется для отбеливания и дезинфекции хлорная известь СaCl(ClO)2 получаемая при
взаимодействии хлора с «гашеной известью»
Cl2 + Ca(OH)2 = Ca(ClO)2 + CaCl2 + H2O
Смесь KClO3 c фосфором взрывается при ударе
5KClO3 + 6P = 3P2O5 + 5KCl
KClO3 используют при производстве спичек и в
пиротехнике
15.
Применение хлора
1. Хлорирование воды
2. Лекарства
3. Средства защиты растений
4. Получение отбеливателей
5. Пластмассы
6. Растворители
7. Красители
8. Отбеливание ткани и бумаги
16.
1
2
3
Cl2
4
6
5
7
8
17.
Тест
ответы
1. Положение элемента хлора в ПСХЭ:
А) 2-период, главная подгруппа VII группа;
Б) 3-период, главная подгруппа VII группа;
Б
В) 2-период, главная подгруппа VII группа;
Г) 1-период, главная подгруппа VII группа.
2. Последовательность цифр 2 – 8 – 7 соответствует распределению
В
электронов по энергетическим уровням атома:
А) брома;
Б) иода;
В) хлора;
Г) фтора.
3. Электронная формула внешнего энергетического уровня атома
Г
хлора соответствует электронной конфигурации:
А) ns2np3
Б) ns2np4
В) ns2np6
Г) ns2np5
Б
4. Формула вещества с ковалентной неполярной связью:
А) NaCl;
Б) Cl2;
В) HCl;
Г) KCl.
5. Какая из данных формул относится к сильвиниту:
Г
А) NaCl;
Б) KCl;
В)CaCl2;
Г) KCl · NaCl
6. Хлор проявляет максимальную степень окисления в кислоте, формула
которой:
А
А) HClO4;
Б) HClO3;
В) HClO;
Г)HClO2
7. Свойство, характерное для хлора.
В
А) жидкость красно-бурого цвета;
В) газ желто-зеленого цвета;
Б) газ желтого цвета;
Г) твердое вещество.
8. Хлор взаимодействует с веществом, формула которого:
А
А) NaBr;
Б) NaF;
В) HF;
Г) O2.
Источник: ppt-online.org
Презентация на тему Хлор. Состав. Строение
Положение хлора в ПСХЭ 1. Положение хлора в ПСХЭ. 1. Положение хлора в ПСХЭ.Строение атома
2. Нахождение в природе
III. Хлор – простое вещество:
1. 1. Состав. Строение
2. 2. Получение:
а) в промышленности
б) в лаборатории
3. 3. Химические свойства
4. 4. Применение
IV. Тест

Слайд 2История открытия хлора
В 1774 году шведский химик
Карл Вильгельм
Шееле (1742 – 1786) провел опыт,
который позволил ему открыть элемент хлор.
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
Полученный газ шведский химик назвал «дефлогистированной муриевой кислотой».
В 1812 году французский химик Жозеф
Луи Гей-Люссак (1778 – 1850) дал газу,
полученному Шееле, его современное
название «хлор», в переводе с греческого
«желто-зеленый».

Слайд 3Положение хлора в ПСХЭ Д.И. Менделеева. Строение
атома.
период
группа
порядковый номер
Cl
неметалл
17
3
VIIA
+17
3
3s2
3p5
3d0
Строение электронной оболочки атома
можно изображать графически с
помощью квантовых ячеек.
Графические электронные формулы
атомов показывают распределение
электронов не только по уровням и по орбиталям.
Слайд 4Нахождение в природе
По распространенности в природе хлор
занимает 11-е место.
Хлор образует следующие важнейшие
минералы:
Галит (хлорид натрия NaCl).
2. Сильвин (хлорид калия KCl);
3. Сильвинит (хлорид калия-натрия KCl · NaCl);
4. Бишофит (хлорид магния MgCl2·6H2O);
5. Карналлит KCl ·MgCl2 · 6H2O);
6. Каинит (KCl · MgSO4 · 3H2O)/
Соединения хлора содержаться в гидросфере: соленых морях и озерах
(Эльтон, Баскунчак).
Соединения хлора обязательно присутствуют в живых организмах, прежде
всего в их жидких средах: крови, желудочном соке, лимфе и др.
Важнейший пищевой продукт,
консервирующее средство.
Широко используется в хими-
ческой промышленности для
получения хлора, соляной
кислоты, гидроксида натрия.

Слайд 5Cl2
Cl
Cl
+
Состав. Строение молекулы хлора
Химическая связь, возникающая в
результате образования
общих электронных пар, называется
ковалентной.
Общая пара
электронов
Электроны, не участвующие в
образовании связи.
Ковалентная связь, образующаяся между атомами
одинаковых неметаллов, называется
Слайд 6Получение хлора
В лаборатории:
2KMnO4+16HCl=2MnCl2+2KCl+5Cl2+8H2O
В промышленности хлор получают электролизом
раствора или расплава хлорида натрия.
H2O → 2NaOH + Cl2
2NaCl → 2Na + Cl2

Слайд 7Химические свойства хлора
Взаимодействие с простыми веществами:
а) металлами
б) неметаллами
2. Взаимодействие со
сложными веществами
3. Взаимодействие с органическими веществами
4. Кислородные соединения хлора

Слайд 8Взаимодействие с простыми веществами (металлами):
а)Наиболее энергично
хлор реагирует с металлами, причем с некоторыми
из них (сурьмой, цезием, рубидием) уже при обычных условиях.
Для реакций с другими металлами требуется нагревание.
Составьте уравнения реакций взаимодействия хлора с
сурьмой,
учитывая, что образуется
хлорид сурьмы (III) или (V)
2Sb0 + 3Cl20 = 2Sb+3Cl¯
Sb0 – 3e → Sb+3 3 2
Cl20 + 2e → 2Cl¯ 2 3
Sb – восстановитель,
процесс окисления.
Сl2 – окислитель,
процесс восстановления
2Fe0 + 3Cl20 = 2Fe+3Cl3¯
Fe0 – 3e → Fe+3 3 2
Cl20 + 2e →2Cl¯ 2 3
Fe – восстановитель,
процесс окисления.
Сl2 – окислитель,
процесс восстановления
Cu0 + Cl20 = Cu+2Cl2¯
Cu0 – 2e → Cu+2 2 1
Cl20 + 2e →2Cl¯ 2 1
Cu – восстановитель,
процесс окисления.
Сl2 – окислитель,
процесс восстановления

Слайд 9Взаимодействие хлора с фосфором
Составьте уравнение реакции. Рассмотрите
с т.зр. ОВР.
Взаимодействие с простыми веществами (неметаллами)
3Cl20
+ 2P 0 = 2P+3Cl3¯
Cl20 + 2e →2Cl¯ 2 3
P0 ─ 3e → P+3 3 2
5Cl20 + 2P 0 = 2P+5Cl5¯
Cl20 + 2e →2Cl¯ 2 5
P0 ─ 5e → P+5 5 2
Cl2 ─окислитель, процесс восстановления.
P ─ восстановитель, процесс окисления.

Слайд 10Взаимодействие хлора с водородом
Составьте уравнение реакции взаимодействия
хлора с водородом. Рассмотрите
с т. зр. ОВР
Cl20 + H20 = 2H+Cl−
Cl20 + 2e → 2Cl− 2 1
H20 – 2e → 2H+ 2 1
Cl2− окислитель, пр. восстановления.
H2− восстановитель, пр. окисления.

Слайд 11Взаимодействие со сложными веществами
F2
Cl2
уменьшение окислительных свойств
увеличение восстановительных свойств
Хлор вытесняет бром и иод из растворов
их солей:
Составьте уравнения реакций вытеснения
хлором брома и иода из раствора иодида
калия.
Cl2 + 2KBr = 2KCl + Br2
Cl2 + 2KI = 2KCl + I2
Хлор энергично взаимодействует
с сероводородом.
Составьте уравнения реакции
взаимодействия хлора с сероводоро-
дом. Рассмотрите с т.зр. ОВР
Cl20 + H2S─2 = S0 + 2HCl¯
Cl20 + 2e → 2Cl¯ 2 1
S─2 ─ 2e → S0 2 1
Cl2─ окислитель, пр. восстановления
S ─ восстановитель, пр. окисления.

Слайд 12Хлор вступает в реакции с органическими веществами

Слайд 13Взаимодействие хлора с органическими растворителями
Растворение
хлора в воде сопровождается и химическим взаимодействием.
+ H2O ↔ HCl + HClO
Хлорноватистая кислота при разложении образует атомарный кислород:

Слайд 14
Кислородные соединения хлора
Хлор непосредственно с кислородом не
взаимодействует, однако этот галоген
образует достаточно много кислородных
соединений.
HClO HClO2 HClO3 HClO4
усиление кислотных свойств
Сила кислот увеличивается с увеличе-
нием степени окисления атома хлора
Когда хлор пропускают в холодный раствор NaOH получается раствор «Белизна»
CI2 + 2NaOH = NaCl + NaClO + H2O
Широко используется для отбеливания и дезинфек-
ции хлорная известь СaCl(ClO)2 получаемая при
взаимодействии хлора с «гашеной известью»
Cl2 + Ca(OH)2 = Ca(ClO)2 + CaCl2 + H2O
Смесь KClO3 c фосфором взрывается при ударе
5KClO3 + 6P = 3P2O5 + 5KCl
KClO3 используют при производстве спичек и в
пиротехнике

Слайд 15Применение хлора
1. Хлорирование воды
3. Средства защиты растений
6.
Растворители
7. Красители
8. Отбеливание ткани
4. Получение отбеливателей

Слайд 16
Cl2
1
2
3
4
5
6
7
8

Слайд 17Тест
2. Последовательность цифр 2 – 8 –
7 соответствует распределению
электронов
по энергетическим уровням атома:
А) брома; Б) иода; В) хлора; Г) фтора.
6. Хлор проявляет максимальную степень окисления в кислоте, формула
которой:
А) HClO4; Б) HClO3; В) HClO; Г)HClO2
5. Какая из данных формул относится к сильвиниту:
А) NaCl; Б) KCl; В)CaCl2; Г) KCl · NaCl
Положение элемента хлора в ПСХЭ:
А) 2-период, главная подгруппа VII группа;
Б) 3-период, главная подгруппа VII группа;
В) 2-период, главная подгруппа VII группа;
Г) 1-период, главная подгруппа VII группа.
3. Электронная формула внешнего энергетического уровня атома
хлора соответствует электронной конфигурации:
А) ns2np3 Б) ns2np4 В) ns2np6 Г) ns2np5
4. Формула вещества с ковалентной неполярной связью:
А) NaCl; Б) Cl2; В) HCl; Г) KCl.
7. Свойство, характерное для хлора.
А) жидкость красно-бурого цвета; В) газ желто-зеленого цвета;
Б) газ желтого цвета; Г) твердое вещество.
8. Хлор взаимодействует с веществом, формула которого:
А) NaBr; Б) NaF; В) HF; Г) O2.
Источник: thepresentation.ru