Добавляя в крепкий чай кусочек лимона, перекусывая бутербродом с красной рыбкой, или потирая зудящую кожу на руке после раздавленного назойливого муравья мало кто задумывается о карбоновых кислотах. Карбоновые кислоты повсюду: молочная кислота образуется в теле человека при сокращении мышц, олеиновая необходима для синтеза клеточных мембран, муравьиная кислота используется как лекарство. Многие из карбоновых кислот зарегистрированы как пищевые добавки — те самые Е, которые старательно изучают на этикетке приверженцы ЗОЖ. Например, Е260 — уксусная кислота.
14 января 2019
Поделитесь в соц.сетях
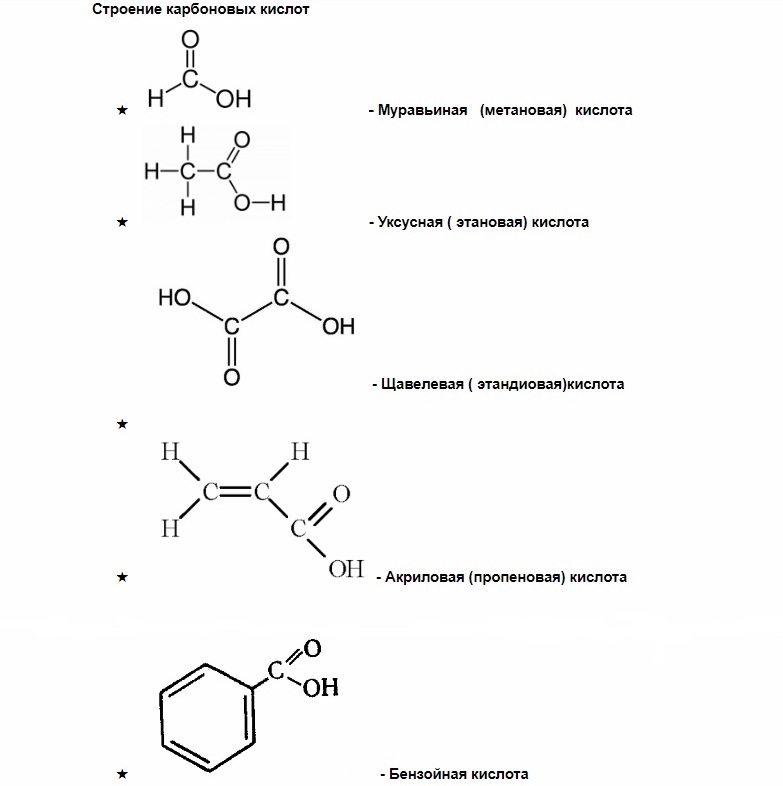
Если внимательно посмотреть на представленные химические формулы, во всех можно заметить общую часть , при записи химических формул используется буквенное обозначение СООН .
Эта часть называется карбоксильной группой , именно она определяет общие свойства, характерные для всей группы карбоновых кислот.
Записки юного химика. Качественные реакции в органической химии.
Карбоксильная группа, в свою очередь, делится на карбонильную группу С=О и гидроксильную группу О-Н.
Карбоновые кислоты — группа органических веществ, в состав которых входят одна или несколько карбоксильных групп и углеводородный радикал (алкил).
Как вы можете заметить, у муравьиной кислоты одна группа СООН, у щавелевой две, а у лимонной – целых три.
По количеству карбоксильных групп карбоновые кислоты делятся на
- одноосновные (муравьиная)
- двухосновные (щавелевая)
- многоосновные (лимонная)
В зависимости от структуры углеводородного радикала карбоновые кислоты делятся на
- насыщенные — (муравьиная, щавелевая) — все связи углерода одинарные.
- ненасыщенные (олеиновая, линолевая) — в составе радикала, между атомами углерода есть двойные связи.
- ароматические (бензойная) — в составе радикала есть бензольное кольцо. Хотя имеют специфический запах все карбоновые кислоты, эта группа особенно ароматна.
В группу карбоновых кислот входят вещества с различными углеводородными радикалами. Если количество атомов углерода в составе радикала больше шести — карбоновую кислоту называют жирной .

Химия. Базовый уровень. 10 класс. Рабочая тетрадь
Предлагаемая тетрадь — часть учебного комплекса к учебнику О. С. Габриеляна «Химия. 10 класс». Помимо тетради в состав УМК входят электронное приложение к учебнику, методическое пособие и рабочая программа. Бесплатный доступ к электронному приложению и рабочей программе можно получить на сайте www.drofa.ru. Специальными знаками отмечены задания, направленные на формирование метапредметных умений (планировать деятельность, выделять различные признаки, сравнивать, классифицировать, устанавливать причинно-следственные связи, преобразовывать информацию и др.) и личностных качеств учеников.
Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)
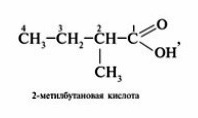
Номенклатура карбоновых кислот.
Некоторые карбоновые кислоты имеют свои народные или тривиальные названия: муравьиная, уксусная, лимонная и т.д.
Также есть официальное название кислоты в зависимости от углеводородного радикала.
Для того, чтобы правильно назвать карбоновую кислоту, нужно:
1.Определить и пронумеровать самую длинную (главную) углеродную цепочку, считая от атома карбоксильной группы.
2. Назвать согласно номенклатуре углеводород (как это сделать, можно посмотреть в учебнике Химия.10 класс под редакцией Габриеляна на портале LECTA)
3. Добавить -овая кислота.
Получение карбоновых кислот
Первой открыли и начали использовать уксусную кислоту. Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
На языке науки эта несложная реакция называется окислением спиртов.
Поскольку большинство из карбоновых кислот входят в состав природных продуктов, до сих пор около 30% получают из биологических объектов.
Однако карбоновые кислоты активно используются в фармацевтической, кожевенной, металлообрабатывающей промышленности и получать их химическим путем быстрее и дешевле. Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
Муравьиная кислота — в ряду карбоновых кислот эта самая скромная кислота с единственным атомом углерода в структуре обладает уникальными свойствами за счет одновременного присутствия в структуре карбонильной и карбоксильной групп.
При реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется блестящий осадок — реакция серебряного зеркала.
HCOOH + Ag2O (аммиачный раствор) CO2 + H2O + 2Ag
Больше интересных материалов:
- Массовая доля вещества
- Технология критического мышления на уроке химии
- Почему лимон кислый?
- Ведение нормативной документации в кабинете химии
- Методическая помощь учителю химии
Способы получения карбоновых кислот в химической промышленности
1. При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
2 RCHO + O2 2 RCOOH
2. При помощи катализатора провести реакцию окисления спиртов
RCH2OH + O2 RCOOH + H2O
3. При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
2 C4H10 + 5O2 4 CH3COOH + 2 H2O
Физические свойства карбоновых кислот
Поскольку, карбоновые кислоты довольно разнородная группа веществ, говорить об общих физических свойствах, характерных для всех представителей группы неправомерно.
По количеству атомов углерода, входящих в состав вещества, карбоновые кислоты делятся на:
- низшие — количество атомов от 1 до 3 — (муравьиная кислота) прозрачные жидкости с характерным запахом, отлично растворяются в воде
- средние — количество атомов от 4 до 9 — ( валериановая кислота) жидкости с резким, неприятным запахом. маслянистые на ощупь.
- высшие — количество атомов превышает 9 — (олеиновая кислота) — твердые вещества, нерастворяются в воде.
Молекулярная масса кислоты влияет на температуры плавления и кипения.
Плотность карбоновых кислот (за исключением муравьиной и уксусной кислот) меньше единицы.
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обратимо диссоциируют. Проверить это можно с помощью лакмусовой бумажки. Она покраснеет, как в растворе любой кислоты.
HCOOH HCOO — + H +
Чем длиннее радикал, тем меньше степень диссоциации, и тем меньше проявляются кислотные свойства.
2. Карбоновые кислоты по своей природе являются слабыми кислотами, и участвуют во всех реакциях, характерных для неорганических кислот. Реагируют с солями, металлами, оксидами и гидроксидами металлов. В результате образуются соли карбоновых соединений и вода.
Источник: rosuchebnik.ru
Муравьиная кислота, получение, свойства, химические реакции

Муравьиная кислота, получение, свойства, химические реакции.
Поделиться в:




Муравьиная кислота (также – метановая кислота) – органическое вещество, относящееся к насыщенным одноосновным карбоновым кислотам.
Муравьиная кислота, формула, характеристики:
Муравьиная кислота (также – метановая кислота) – органическое вещество, относящееся к насыщенным одноосновным карбоновым кислотам.
Химическая формула муравьиной кислоты CH₂O₂. Рациональная формула муравьиной кислоты HCOOH. Изомеров не имеет.
Строение молекулы муравьиной кислоты:

Муравьиная кислота (метановая кислота) – простейшая карбоновая кислота, родоначальник класса карбоновых кислот.
Муравьиная кислота – бесцветная жидкость , обладающая резко пахнущим запахом.
Муравьиная кислота – легковоспламеняющаяся жидкость с температурой вспышки 60 °С, температурой самовоспламенения 504 °С.
Водный раствор, содержащий 85% муравьиной кислоты, также является горючей жидкостью с температурой вспышки (в открытом тигле) 71 °С, температурой воспламенения 83 °С.
При температуре выше 69°C муравьиная кислота может образовывать взрывоопасныe смеси пар/воздух.
Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой , диэтиловым эфиром, этанолом.
В качестве пищевой добавки муравьиная кислота зарегистрирована как E236.
Муравьиная кислота своё название получила из-за того, что была впервые выделена в 1670 году английским натуралистом Джоном Рэйем из рыжих лесных муравьёв.
В природе муравьиная кислота содержится в яде пчел, в крапиве, хвое, выделениях медуз, фруктах (яблоках, малине, клубнике, авокадо и пр.).
Соли и анионы муравьиной кислоты называются формиатами.
Название муравьиной кислоты на английском – formic acid.
Муравьиная кислота обладает токсическим действием, опасна для жизни и здоровья (опасность зависит от концентрации), обладает разъедающими свойствами.
Физические свойства муравьиной кислоты:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | резкий запах |
| Вкус | кислый |
| Агрегатное состояние (при 25 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (при 25 °C и атмосферном давлении 1 атм.), г/см 3 | 1,2196 |
| Плотность (при 25 °C и атмосферном давлении 1 атм.), кг/м 3 | 1219,6 |
| Температура плавления, °C | 8,25 |
| Температура кипения, °C | 100,7 |
| Тройная точка, °C | 8,25 при 2,2 кПа |
| Критическая точка, °C | 315 при 5,81 МПа |
| Температура вспышки, °C | 60 |
| Температура самовоспламенения, °C | 504 |
| Константа диссоциации | 1,772⋅10 -4 |
| Константа диссоциации кислоты | 3,75 |
| Взрывоопасные концентрации смеси с воздухом, % объёмных | от 18 до 57 |
| Удельная теплота сгорания, МДж/кг | 4,58 |
| Молярная масса, г/моль | 46,03 |
Химические свойства муравьиной кислоты:
Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные.
Для нее характерны следующие химические реакции:
- 1. реакция муравьиной кислоты с щелочами:
HCOOH + NaOH → HCOONa + H2O,
HCOOH + KOH → HCOOK + H2O.
В ходе данной реакции образуется формиат натрия (формиат калия ) и вода .
- 2. реакция муравьиной кислоты с гидроксидами:
В ходе данной реакции образуется углекислый газ, оксид меди и вода .
- 3. реакция разложения муравьиной кислоты при нагревании:
При нагревании с сильными водоотнимающими средствами, такими как концентрированная серная кислота или оксид фосфора , разлагается на моноксид углерода (угарный газ) и воду .
- 4. реакция образования сложных эфиров:
Муравьиная кислота, вступая в реакцию со спиртами, образует сложные эфиры.
В результате химической реакции муравьиной кислоты с метанолом (метиловым спиртом) образуется метилформиат (метиловый эфир муравьиной кислоты) и вода .
- 5. реакцияс аммиачным раствором оксида серебра (реакция серебряного зеркала):
Поскольку муравьиная кислота проявляет свойства альдегидов, то для нее характерна реакция «серебряного зеркала». Реакция «серебряного зеркала» является качественной реакцией на альдегиды. В результате реакции образуется металлическое серебро . Если реакция проводится в сосуде с чистыми и гладкими стенками, то серебро осаждается на них в виде тонкой плёнки , образуя зеркальную поверхность . При наличии малейших загрязнений серебро выделяется в виде серого рыхлого осадка .
Получение муравьиной кислоты:
Муравьиную кислоту получают:
– окислением метанола (СН3ОН);
– как побочный продукт при окислении бутана в производстве уксусной кислоты;
– реакцией монооксида углерода с гидроксидом натрия (основной промышленный способ) в две стадии.
NaOH + CO → HCOONa → HCOOH
На первой стадии получают формиат натрия, затем его обрабатывают серной кислотой;
– разложением глицериновых эфиров щавелевой кислоты.
Безопасность при обращении с муравьиной кислотой. Требования ГОСТа:
Муравьиная кислота относится к веществам 2-го класса опасности (ГОСТ 12.1.007-76). Предельно допустимая концентрация ее в воздухе рабочей зоны производственных помещений (ПДК) составляет 1 мг/м 3 (см. ГОСТ 5848-73 Реактивы. Кислота муравьиная. Технические условия (с Изменениями N 1, 2, 3)).
При превышении предельно допустимой концентрации пары муравьиной кислоты действуют раздражающе на слизистую оболочку верхних дыхательных путей и глаз; муравьиная кислота вызывает также ожог кожи.
Муравьиная кислота и ее растворы – легковоспламеняющиеся жидкости . Все работы с муравьиной кислотой следует проводить вдали от огня.
Все помещения, в которых проводятся работы с муравьиной кислотой, должны быть оборудованы общей приточно-вытяжной механической вентиляцией. Анализ муравьиной кислотой следует проводить в вытяжном шкафу лаборатории.
При работе с ней следует применять индивидуальные средства защиты. Не допускать попадания препарата внутрь организма. Первая помощь при ожогах – обильное промывание водой.
Применение муравьиной кислоты:
Муравьиная кислота применяется:
– в сельском хозяйстве, как консервант сена и силоса,
– в химической промышленности в качестве растворителя,
– в пищевой промышленности в качестве консерванта ,
– в текстильной промышленности для окрашивания шерсти,
– в пчеловодстве как средство для борьбы с паразитами.
Источник: xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai
CH3COOH + [Ag(NH3)]OH = ? уравнение реакции
Срочно нужна помощь по химии. Необходимо записать уравнение реакции взаимодействия уксусной кислоты с аммиачным раствором оксида серебра согласно схеме CH3COOH + [Ag(NH3)]OH = ? Укажите основные физические и химические свойства уксусной кислоты, приведите способы её получения.
Xumuk Админ. ответил 6 лет назад
В результате взаимодействия уксусной кислоты с аммиачным раствором оксида серебра (CH3COOH + [Ag(NH3)]OH = ?) происходит образование средней соли ацетата аммония, воды, выделение аммиака и серебра. Реакцию проводят при нагревании. Молекулярное уравнение реакции имеет вид:
![]()
Уксусная (этановая) кислота представляет собой бесцветную жидкость, обладающую резким раздражающим запахом. При попадании на слизистые оболочки она вызывает ожоги. Уксусная кислота смешивается с водой в любых соотношениях. Образует азеотропные смеси с бензолом и бутилацетатом.
Уксусная кислота – это слабая одноосновная кислота. В водном растворе она диссоциирует на ионы:
![]()
Отличительным свойством карбоновых кислот является их способность вступать в реакции взаимодействия со спиртами, которые протекают по механизму нуклеофильного замещения. В качестве нуклеофила выступает молекула спирта, атакующая атом углерода карбоксильной группы уксусной кислоты, несущий частично положительный заряд. Отличительной особенностью этой реакции (этерификации) является то, что замещение протекает у атома углерода, находящегося в состоянии -гибридизации:
![]()
В промышленности уксусную кислоту получают каталитическим окислением н-бутана кислородом воздуха:
![]()
Значительные количества уксусной кислоты производят путем окисления ацетальдегида, который в свою очередь получают окислением этилена кислородом воздуха на палладиевом катализаторе:
![]()
Пищевую уксусную кислоту получают при микробиологическом окислении этанола (уксуснокислое брожение).
Источник: ru.solverbook.com