Пользователь
Регистрация: 13.06.2014
Откуда: Липецк
Сообщений: 1437
В друзьях у: 6
Голосов: 195 / 7
Добавлено: 17.11.2016 20:34:58
65%кислоту ни когда не разбавляю!Просто емкость надо брать с запасом!ну и для начала-от не опытности приготовить страховочный резервуар в который можно поместить сосуд- реактор.
Боюсь сказать,что я еще частенько подогреваю сосуд чтобы ускорить реакцию
Пользователь
Регистрация: 08.03.2016
Откуда: Москва МИХМ
Сообщений: 870
В друзьях у: 4
Голосов: 129 / 1
Добавлено: 17.11.2016 22:50:49
Выше я уже писал, что при использовании концентрированной кислоты её бесполезно теряется треть (на образование двуокиси азота «лисий хвост» ), так как реакция идёт совсем по другому. Ничего смертельного от концентрированной кислоты нет, просто потери и раствор более густой и больше пенится. Тут как в поговорке» кому нравится попадья, а кому и поп» .
Подогревать по любому надо, с разбавленным раствором саморазогрев меньше и реакция идёт спокойнее.
Азотная кислота + соль = золото
Для читающих формулы оба уравнения:
Ag + 2HNO3 = AgNO3 + NO2 + H2O (конц)
3Ag + 4HNO3 = 3AgNO3 + NO + 2H2O (разб)
| Растворение серебра в азотной кислоте протекает по разным схемам, в зависимости от концентрации кислоты. Азотная кислота уд. веса 1.42 (70%-ная) реагируя с серебром,полезно используется лишь на 50%, а другие 50% бесполезно теряются в виде N2O4. Кислота уд. веса 1,35 (55% -ная) полезно используется на две трети, а одна треть теряется в виде N2O3. Кислота уд. веса 1,2 (32% -ная) полезно используется на 75% и лишь 25% теряется в виде окиси азота NO. Оптимальной температурой принято считать 65 — 75 градусов. |
Цитата взята с сайта «химик.ру»
Пользователь
Регистрация: 26.09.2013
Сообщений: 723
В друзьях у: 4
Голосов: 30 / 1
Добавлено: 17.11.2016 23:34:00
Плотность азотной кислоты можно проверить автомобильным ареометром для серной к-ты, показания будут верны?
Пользователь
Регистрация: 13.06.2014
Откуда: Липецк
Сообщений: 1437
В друзьях у: 6
Голосов: 195 / 7
Добавлено: 18.11.2016 00:28:50
| (абитуриент 17.11.2016 23:34:00) Плотность азотной кислоты можно проверить автомобильным ареометром для серной к-ты, показания будут верны? |
Нет!шкалы этих ареометров отградированны на измерение растворов именно серной кислоты.
Пользователь
Регистрация: 08.03.2016
Откуда: Москва МИХМ
Сообщений: 870
В друзьях у: 4
Голосов: 129 / 1
Добавлено: 18.11.2016 10:22:51
Проще мерный стакан и весы.. ну или набор промышленных ареометров. Автомобильные не знаю, если шкала в г/см3 то они типовые (можно по воде проверить) если в единицах концентрации кислоты то надо пересчитывать. И про температуру градуировки не забывать.
Чистка серебра в кислоте
Пользователь
Регистрация: 30.10.2011
Откуда: КАЗАХСТАН
Сообщений: 341
В друзьях у: 0
Голосов: 15 / 5
Добавлено: 18.11.2016 20:56:45
ПРОЧИТАЛ ВСЮ ВЕТКУ ЗА 3 ЛИТРАМИ ПИВА. Я В УЖАСЕ. БРАТЬЯ. ПРОБЫВАЛ МНОГИЕ РЕЦЕПТЫ.
НО СОЛЯНКА У НАС ПРЕКУСОР (ЗАПРЕШЕНА ДЛЯ ПРОДАЖ ФИЗИЧИСКИМ ЛИЦАМ) ВИДИМО В УКРАИНЕ НЕТ.
НАФИГА СОЛЯНКА , САХАР АМИАК, ЦИНК, ГЛЮКОЗА, ВСЕ ПРОСТО. РАСТВОРЯЕМ ЛОМ В 35% РАСТВОРЕ АЗОТКИ, ДОЛИВАЕМ В ДВАРАЗА БОЛЬШЕ ВОДЫ , ЧТОБ ГОЛУБОВАТЫЙ СТАЛ ЦВЕТ, И СУЕМ КУСРК ЧИСТОЙ МЕДИ (НЕЛАТУНИ) СЕРЕБРО НАЧНЕТ ВЫПОДАТЬ В ОСАДОК С МЕДИ. ВСЕ ПРОЦЕЖИВАЕМ СЕРЕБРО С БУРОЙ ПЛАВИМ 998 ПРОБА А СЛИВ СОЛЬЮ МОЖЕТ И ХЛОРНОЕ ВЫПАССТЬ ЕСЛИ МЕДЬ ПЛОХАЯ. ХДОРНОЕ ПЛАВИМ С КАЛЬЦЕНИРОВАННОЙ ССОДОЙ И ВСЕ. ВЫХЛОП ОЧЕНЬ ХОРОШИЙ.
Пользователь
Регистрация: 01.10.2010
Откуда: Предгорья Алтая
Сообщений: 8629
В друзьях у: 21
Голосов: 805 / 34
Добавлено: 19.11.2016 14:51:50
talantin,
Так про твой способ мы все знаем. А похимичить . А эксперименты поставить . Интересно ведь.
Тот кто пляшет и поет — тот поет и пляшет, тот кто пашет и кует — тот кует и пашет.
Пользователь
Регистрация: 23.10.2016
Сообщений: 22
В друзьях у: 0
Голосов: 0 / 0
Добавлено: 19.11.2016 23:47:37
Друзья, подскажите- я тут похимичел с электролитическим аффинажем и результат такой:Сперва процес
шёл бодро, кристаллы росли красивые и быстро. Часа через два-три процесс замедлился. Я очистил анод и катод, заменил фильтр на аноде, но быстрее процесс не пошёл. Может электролит выработался? Может надо добавить азотки?
На аноде ещё большой кусок серебра, а процесса нет . Подскажите, что попробовать сделать?
Пользователь
Регистрация: 23.10.2016
Сообщений: 22
В друзьях у: 0
Голосов: 0 / 0
Добавлено: 20.11.2016 13:50:48
Вот какая красота при электролизе! (правда медленно!)

Пользователь
Регистрация: 08.01.2006
Откуда: Дагестан
Сообщений: 2716
В друзьях у: 1
Голосов: 301 / 98
Добавлено: 20.11.2016 16:17:14
Зарезинь и отливай!
Пользователь
Регистрация: 24.02.2015
Откуда: Украина
Сообщений: 1084
В друзьях у: 1
Голосов: 115 / 6
Добавлено: 20.11.2016 16:21:41
| (Dagmen 20.11.2016 16:17:14) Зарезинь и отливай! |
Мне восковку .
Пользователь
Регистрация: 13.06.2014
Откуда: Липецк
Сообщений: 1437
В друзьях у: 6
Голосов: 195 / 7
Добавлено: 20.11.2016 17:33:05
Сергей,
катод сделай просто пластиной.
Расскажи о электролите поподробней.
Пользователь
Регистрация: 23.10.2016
Сообщений: 22
В друзьях у: 0
Голосов: 0 / 0
Добавлено: 20.11.2016 18:49:29
| (ВитькОвский 20.11.2016 17:33:05) Сергей, катод сделай просто пластиной. Расскажи о электролите поподробней. |

Катод сделан просто согнутой пластинкой из нержавейки. По электролиту мне самому рассказали несколькими постами ранее на этом форуме. У меня было 100гр. азотнокислого серебра чда. Растворил в 1 литре дис. воды. Добавил 10 мл. азотки 65%. Вот и всё. Анод (+)- слиток «грязного» серебра, катод (-) -пластина нержавейки.
Напряжение 3,5 вольта , ампер не знаю сколько — нет амперметра, но ток большой т.к. блок питания сильно греется и я на него направил вентилятор для охлаждения. Вот и всё. Но процесс длительный, хотя кристаллы на глазах растут. Приходится контролировать процесс, что бы кристаллы не доросли до анода, а то будет К.З. Кристаллы растут от минуса к плюсу.
Я стеклянной палочкой кристаллы отодвигаю от + время от времени. Когда много набирается кристаллов, я их вынимаю, не останавливая процесса, промываю раз 5-6 и сушу на бумаге. Потом в банку до переплавки. Забыл сказать, что анод я завернул в одноразовое бумажное полотенце в один слой-этого хватает, чтобы фильтровать грязь. Бумага не разваливается до конца слитка.
Лишнюю бумагу отрезал.
Источник: www.jportal.ru
Какая кислота растворяет серебро?
Серебро не растворяется в соляной кислоте из-за появления тонкого слоя хлорида серебра. При условии добавления к раствору свободного кислорода в виде перекиси водорода реакция приведет к окислению серебра в хлорид серебра.
Что будет если смешать цинк и соляную кислоту?
Цинк растворяется в соляной кислоте с образованием газообразного водорода.
Сколько нужно азотной кислоты для растворения серебра?
1) Растворение серебра в азотной кислоте , не содержащей соляную или хлориды, необходимо для перевода серебра в раствор и отделения его от золота (если оно присутствует в сплаве). Для растворения 10 грамм чистого серебра необходимо 12 грамм азотной кислоты 100%. Обычно она идет 60-65 % т.
Как серебро влияет на организм человека?
Как влияют на здоровье серебряные украшения Металл 925 пробы защищает от эмоциональных травм, депрессии, создает энергетический щит, не вызывает аллергии и обладает следующими свойствами: нормализует кровообращение; регулирует температуру тела; улучшает местный иммунитет.
Как соляная кислота реагирует с серебром?
Растворение серебра в соляной кислоте Этот металл не растворяется в соляной кислоте из-за тонкого слоя хлорида серебра. Если добавить к раствору свободный кислород в виде перекиси водорода, то реакция приведет к окислению серебра в хлорид серебра.
Почему серебро не растворяется в царской водке?
Серебро не растворяется в царской водке из-за пассивации поверхности образующейся плёнкой хлорида серебра. Пассивация поверхности металла кислотоустойчивыми оксидами является причиной устойчивости к царской водке хрома, титана, тантала, циркония, гафния и ниобия. Царская водка не растворяет фторопласт-4 (тефлон).
Как растворить серебро в домашних условиях?
Химический способ №1. Содержащие серебро предметы помещаются в азотную кислоту. Для этого подготавливается смесь воды с кислотой (пропорция 1:1), размешивается кварцевой палочкой. Растворение металла происходит на протяжении нескольких часов.
Чем можно почистить серебро?
Все что вам понадобится, это: вода, сода и фольга.
- В кипяченую воду добавьте 2 ст. л. соды.
- Опустите туда полоску алюминиевой фольги.
- И оставьте в ней серебро на 15-20 минут.
- После прополоскайте серебро под краном и хорошо вытрите.
Как определить серебро или нет?
Инструкция для такой проверки достаточно проста:
- Слегка поцарапайте изделие иголкой и капните на царапину уксусом;
- Если царапина покрывается пеной зеленоватого цвета – перед вами подделка;
- Если пены нет, а царапина покрыта субстанцией белого цвета – это настоящее серебро.
Какие валентности у серебра?
| Электродный потенциал | +0,799 |
| Степени окисления | +1, +2 |
| Энергия ионизации | 1‑я: 730,5 кДж/моль (эВ) 2‑я: 2070 кДж/моль (эВ) 3‑я: 3361 кДж/моль (эВ) |
| Термодинамические свойства простого вещества |
Как реагирует с разбавленными кислотами цинк?
Взаимодействие разбавленной серной кислоты с цинком — основной лабораторный способ получения водорода. Для этого используется чистый зерненый (гранулированный) цинк либо технический цинк в виде обрезков и стружек. Если взяты очень чистые цинк и серная кислота, то водород выделяется медленно, особенно в начале реакции.
Что произошло при добавлении цинка в кислоте?
Цинк, как активный металл, может образовывать с концентрированной серной кислотой сернистый газ, элементарную серу, и даже сероводород.
Что может реагировать с соляной кислотой?
Она способна вступать в химические взаимодействия с металлами, их оксидами и гидроксидами, с солями других (менее сильных) кислот и основаниями.
Что такое соли цинка?
Имеют вид бесцветных кристаллов, используются при производстве вискозы, красок, глазурей. Также широко применяются в металлургической, медицинской и аграрной промышленности. Вся продукция сертифицирована, поставка осуществляется в мешках.
Какой металл реагирует активней с соляной кислотой?
Алюминий более активно реагирует с раствором соляной кислоты, восстанавливая водород. Наиболее энергично восстанавливает водород из соляной кислоты магний. Мы увидели, что металлы, стоящие в электрохимическом ряду напряжений до водорода (железо, алюминий и магний), восстанавливают его из растворов кислот.
Кому можно пить цинк?
Дополнительный прием цинка необходим также следующим категориям граждан:
- Тем, кто имеет проблемы желудочно-кишечной системы, страдает анорексией или перенес операцию на органах пищеварения.
- Вегетарианцам, так как главные источники цинка — продукты животного происхождения.
Как восстановить серебро из азотной кислоты?
Серебросодержащие изделия помещают в химический стакан и заливают концентрированной азотной кислотой (2 см кислоты на 1г лома). Подогревая стакан с раствором, растворяют металл. Если металл не растворился, доливают немного азотной кислоты. После растворения серебра полу чаю і нитрат серебра и соли металлов.
Источник: toptitle.ru
§ 3. Химические свойства серебра
По своей химической активности серебро занимает промежуточное положение между золотом и медью. С кислородом серебро непосредственно не соединяется, но в расплавленном состоянии растворяет около 20 объемов кислорода на один объем металла (рис. 2). В твердом серебре раство-
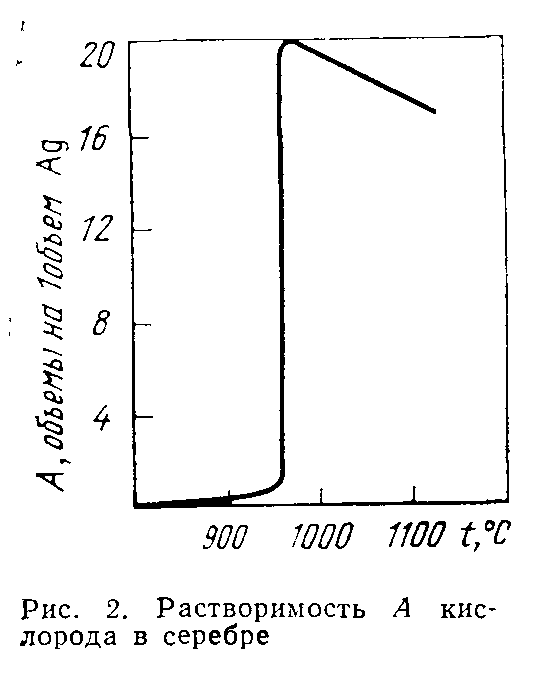
римость кислорода мала, поэтому при затвердевании расплавленного серебра происходит выделение растворенного в нем кислорода, сопроводающееся иногда разбрызгиванием металла. С водородом, азотом и углеродом серебро непосредственно не взаимодействует. Фосфор действует на серебро лишь при температуре красного каления с образованием фосфидов. При нагревании с серой серебро легко образует сульфид Ag2S. Это же соединение получается при действии на серебро газообразной серы, выде-
ляющеися при термической диссоциации некоторых сульфидов (пирита, пирротина, халькопирита), и при нагреве металла в контакте с этими сульфидами. При воздействии сероводорода поверхность серебра покрывается черной пленкой Ag2S. Процесс медленно идет уже в обычных ус-.ловиях и является причиной постепенного потемнения се-ребянных изделий. Серебро взаимодействует также со свободными хлором, бромом и иодом с образованием соответствующих галогенидов. Эти процессы медленно протекают,
даже при обычных температурах и ускоряются в присутствии влаги, при нагревании и под действием света.
Электродный потенциал серебра в водных растворах высок
Поэтому, как и золото, серебро не вытесняет водород из водных растворов кислот, устойчиво по отношению к щелочам. Однако в отличие от золота оно растворяется в кислотах, являющихся достаточно сильными окислителями, например, в азотной и концентрированной серной.
Подобно золоту, серебро легко взаимодействует с царской водкой и насыщенной хлором соляной кислотой, но при этом оно остается в нерастворимом остатке вследствие образования малорастворимого хлорида AgCl. Такие различия в поведении золота и серебра часто используют для разделения этих металлов. Тонкодисперсное серебро в контакте с кислородом воздуха растворяется в разбавленной серной кислоте. Подобно золоту, серебро растворяется также в насыщенных воздухом водных растворах цианидов щелочных и щелочноземельных металлов, в водном растворе тиомоче-вины в присутствии солей железа (III).
В подавляющем большинстве своих соединений серебро имеет степень окисления (+1). Соединения с более высокой степенью окисления серебра (+2 и +3) сравнительно малочисленны и практического значения не имеют.
Оксид серебра Ag20 черно-коричневого цвета может быть получен введением щелочи в раствор, содержащий ионы Ag^. Вначале, по-видимому, образуется гидроксид, тотчас переходящий в оксид:
Ag + + ОН~= AgOH; 2AgOH = Ag20 + Н20.
Хотя оксид серебра — малорастворимое в воде соединение, его водная суспензия имеет четко выраженную основную реакцию, поэтому соли серебра в водных растворах не гид-ролнзуются и дают нейтральную реакцию. При нагревании до 185—190 °С Ag20 разлагается на элементы. Перекись водорода легко восстанавливается Ag20 уже при комнатной температуре:
В водном растворе аммиака Ag20 растворяется с образованием комплексного соединения:
При стоянии из раствора осаждается чрезвычайно взрывчатый даже во влажном состоянии осадок нитрида серебра Ag3N (гремучее серебро).
Галогениды серебра — малорастворимые соединения. Исключение составляет лишь легкорастворимый фторид AgF. Хлорид AgCl, бромид AgBr и ноднд Agl выпадают в осадок при введении в раствор, содержащий ионы Ag + (например, раствор AgN03), ионов CP, В г- и I — . Их произведения растворимости составляют соответственно 1,8-10 -10 (AgCl), 5,3-Ю- 1 » (AgBr) и8,3-10-‘ 7 (Agl).
В гидрометаллургии и аффинаже благородных металлов широко используют прием осаждения серебра в виде хлорида, осуществляемый введением в серебросодержащие растворы NaCl или НС1. Хлорид серебра плавится при 455°С. Температура кипения AgCl 1550°С, но заметное улетучивание наблюдается уже при температуре выше 1000 °С.
Ионы серебра образуют прочные комплексы с целым рядом ионов и молекул (CN~, S2O3″, SOl~ CP, NH3, CS(NH2b и т.д.). Благодаря этому практически нерастворимый в воде AgCl легко растворяется в водных растворах цианистого калия, тиосульфата и сульфита натрия, аммиака, например:
AgCl + 2CN~ = Ag (CN)7 + СП;
AgCl -4- 2S2Cf — = Ag (S202)l~ + CP;
Вследствие образования комплексов с ионами CP хлорид серебра заметно растворим также в концентрированных соляной кислоте и растворах других хлоридов:
Например, в концентрированном растворе NaCl растворимость хлорида серебра составляет 6,7-10 _3 моль/л (0,72 г/л Ag) против 1,3-Ю -5 в воде. Концентрированные растворы NaCl использовали ранее для выщелачивания серебра из огарков хлорирующего обжига.
Таким образом при введении хлор-ионов в серебросодержащие растворы концентрация серебра вначале падает (образование AgCl), а затем начинает возрастать (в результате комплексообразования). Поэтому для достижения полноты осаждения серебра следует избегать большого избытка ионов хлора.
Электроотрицательными металлами (цинком, железом) хлорид серебра, взятый в виде суспензии в разбавленной серной кислоте, легко восстанавливается до металла. Этот простой прием получения металлического серебра из его хлорида широко применяют в аффинажном производстве.
Бромид серебра AgBr похож по своим свойствам на AgCl. Он растворим в аммиачных, тиосульфатных, сульфитных и цианистых растворах, легко восстанавливается до металла.
Иодид Agl — наименее растворимый из галогенидов серебра, поэтому в отличие от AgCl и AgBr он не растворим в аммиачных растворах, но растворим в присутствии ионов CN~ и S203~ , с которыми серебро образует более прочные, нежели с аммиаком, комплексы. Заметной растворимостью Agl обладает также в концентрированных растворах иодидов щелочных металлов, что объясняется образованием комплексных ионов Agio».
Весьма характерной и важной особенностью труднорастворимых галогенидов серебра является их светочувствительность, заключающаяся в том, что под действием света они разлагаются на металлическое серебро и свободный галоид: 2Agr = 2Ag-r-r2.
Это свойство галоидных солей серебра лежит в основе их применения для производства фотоматериалов — светочувствительных пленок, пластинок и бумаги. Светочувствительность галидов серебра возрастает в ряду AgKAgCKAgBr, поэтому чаще всего для производства фотоматериалов используют бромид серебра.
К галогенидам серебра очень близок по своим свойствам цианид AgCN. Он выпадает в виде белого осадка при добавлении к раствору, содержащему ионы Ag 4 -, раствора цианида щелочного металла (без избытка). Подобно галогенидам серебра, AgCN практически нерастворим в воде (произведение растворимости 2.3-10 -16 ) и разбавленных кислотах, но растворим в аммиачных, тиосульфатных и цианистых растворах, вследствие образования соответствующих комплексных соединений. В отличие от галогенидов цианид серебра под действием света не разлагается.
Из других соединений серебра большое практическое значение имеют нитрат и сульфат серебра.
Нитрат серебра AgN03 получают действием азотной кислоты на металлическое серебро:
Нитрат серебра представляет собой бесцветные негиг-роскопические кристаллы, плавящиеся при 208,5 °С ; при температуре выше 350 °С термически разлагается. AgN03 очень легко растворяется в воде. При 20 °С его растворимость составляет 222 г на 100 г воды, при 100°С она возрастает до 952 г на 100 г.
В присутствии органических веществ нитрат серебра чернеет вследствие частичного восстановления до металла.
Нитрат серебра — технически наиболее важное соединение этого металла. Эта соль служит исходным продуктом для приготовления остальных соединений серебра. Водный раствор AgNC>3 используют в качестве электролита при электролитическом рафинировании серебра.
Сульфат серебра Ag2S04 может быть получен растворением металлического серебра в горячей концентрированной серной кислоте:
Сульфат серебра образует бесцветные кристаллы, плавящиеся при 660 °С. При температуре выше 1000 °С термически разлагается. Растворимость Ag2S04 в воде невелика, при 25 °С она составляет 0,80 г на 100 г воды. В концентрированной серной кислоте растворимость значительно выше вследствие образования более растворимого бисульфата AgHS04.
Сульфид серебра Ag2S — наиболе трудно растворимая соль этого металла (произведение растворимости 6.3X Х10~ 50 ). Он выпадает в виде черного осадка при пропускании сероводорода через растворы солей серебра. Образование Ag2S происходит также при действии H2S на металлическое серебро в присутствии влаги и кислорода воздуха;
Как было отмечено, этот процесс является причиной потемнения серебряных изделий при длительном хранении. Сульфид серебра можно получить также непосредственно из элементов, нагревая металлическое серебро с элементарной серой.
В цианистых растворах Ag2S растворяется в результате образования комплексного соединения:
Ag2S + 4CN~ ц£ 2Ag (CN)7 + S 2 ~. (34)
Эта реакция обратима, протеканию ее слева направо способствует повышение концентрации иновов CN~ и удале
ние ионов S 2 ~ окислением их кислородом продуваемого воздуха.
С разбавленными минеральными кислотами Ag2S не взаимодействует. Концентрированная серная и азотная кислота окисляют сульфид серебра до сульфата. При нагревании в атмосфере воздуха Ag2S разлагается с образованием металлического серебра и диоксида серы:
Из ранее упоминавшихся комплексных соединений серебра наибольший интерес для гидрометаллургии этого металла представляют хорошо растворимые комплексные цианистые соединения калия, натрия и кальция. Подобно аналогичным соединениям золота, комплексные цианиды серебра образуются при растворении металлического серебра в растворе соответствующего цианида при доступе кислорода воздуха:
4Ag + 8CN~ 4- 02 + 2Н20 = 4Ag(CN)7 4- 4С4Г. (36)
Эта реакция, как и аналогичная реакция с золотом, лежит в основе процесса цианирования.
Как и золото, серебро растворяется в водных растворах тиомочевины в присутствии солей Fe(III), образуя комплексные катионы Ag[CS(NH2)2]-i~
Источник: studfile.net