Вопрос 1.
а) Характеристика фосфора.
1. Фосфор — (лат. Phosphorus), Р, химический элемент V группы периодической системы Менделеева, атомный номер 15, Z = 15, атомная масса 30,97376. Атом фосфора содержит в ядре 15 протонов, 16 нейтронов и 15 электронов:
Атомы фосфора проявляют как окислительные свойства (принимают недостающие для завершения внешнего уровня три электрона, проявляя при этом степень окисления -3, например, в соединениях с менее электроотрицательными элементами — металлами, водородом и тп.) так и восстановительные свойства (отдают 3 или 5 электронов более электроотрицательным элементам — кислороду, галогенам и т.п., приобретая при этом степени окисления +3 и +5.).
Фосфор менее сильный окислитель, чем азот, но более сильный, чем мышьяк, что связано с ростом радиусов атомов от азота к мышьяку. По этой же причине восстановительные свойства, наоборот, усиливаются.
2. Фосфор — простое вещество, типичный неметалл. Фосфору свойственно явление аллотропии. Существуют аллотропные модификации фосфора такие, как белый, красный и черный фосфор, которые обладают разными химическими и физическими свойствами.
Самый простой способ понять ХИМИЮ — Типы Кристаллических Решеток и Свойства Вещества
3. Неметаллические свойства фосфора выражены слабее, чем у азота, но сильнее, чем у мышьяка (соседние элементы в группе).
4. Неметаллические свойства фосфора выражены сильнее, чем у кремния, но слабее, чем у серы (соседние элементы в периоде).
5. Высший оксид фосфора имеет формулу Р2О5. Это кислотный оксид. Он проявляет все типичные свойства кислотных оксидов. Так, например, при взаимодействии его с водой получается фосфорная кислота Н3РО4:
При взаимодействии Р2О5 с основными оксидами и основаниями он дает соли:
6. Высший гидроксид фосфора — фосфорная кислота Н3РО4, проявляет все типичные свойства кислот:
взаимодействие с основаниями и основными оксидами:
7. Фосфор образует летучее соединение Н3Р — фосфин.
б) Характеристика калия.
1. Калий имеет порядковый номер 19, Z = 19 и Аr(К) = 39. Соответственно заряд ядра его атома +19 равен числу протонов. Следовательно, число нейтронов в ядре равно 20. Число электронов, содержащихся в атоме калия, равно 19.
Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так:
Исходя из строения атома, можно предсказать степень окисления калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1. Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что связано с ростом радиусов от Na к Rb.
2. Калий — простое вещество, для него характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
З. Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
Кристаллические решетки: заучить или понять за 20 минут? | Химия ЕГЭ 2023 | Умскул
4. Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона атома кальция.
5. Оксид калия К2О является основным оксидом и проявляет все типичные свойства основных оксидов, взаимодействие с кислотами и кислотными оксидами:
6. В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами:
7. Летучего водородного соединения калий не образует, а образует гидрид калия KH.
Вопрос 2.
Вопрос 3.
Магний — простое вещество, для него характерна металлическая кристаллическая решетка; он обладает металлическим блеском, электропроводностью.
Аллотропия химических элементов
Вопрос 4.
Аллотропия — явление существования химического элемента в виде нескольких простых веществ, различных по строению и свойствам (так называемых аллотропных форм).
а) В молекулах состава S2 реализуется ковалентно-неполярный тип связи (т.е. не происходит смещения электронной пары, образующей связь).
б) В молекулах состава Н2S реализуется ковалентно-полярный тип связи, т.к. происходит смещение электронной пары к более электроотрицательному атому — сере (S):
Физические свойства ромбической серы (S2):
вещество лимонно-желтого цвета, устойчивое до t = 95,6 °С, растворяется в сероуглероде (CS2), анилине, бензоле, феноле.
Уравнения реакций:
Вопрос 5.
Неметаллические свойства кремния выражены слабее, чем у фосфора, но сильнее, чем у алюминия.
Вопрос 6.
а) У азота кислотные свойства выражены сильнее, чем у фосфора, т.к. в группах сверху вниз происходит усиление основных и ослабление кислотных свойств.
б) У серы кислотные свойства выражены сильнее, чем у фосфора, так как в периодах слева направо происходит усиление кислотных и ослабление основных свойств.
Вопрос 7.
Вопрос 8.
Вопрос 9.
Нет, нельзя. Прежде всего, из-за различия в степенях окисления. В оксиде сера имеет степень окисления 6+. В сернистой кислоте — 4+. Высшему оксиду SO3 соответствует серная кислота H2SO4.
Сернистой кислоте H2SO3 соответствует оксид SO2.
Данные соответствия можно показать гидролизом оксидов:
Вопрос 10.
- Вы здесь:
- Главная

- Химия

- О.С. Габриелян-9кл

- Практическая работа 13. «Распознавание волокон»
Источник: buzani.ru
Свойства калия
Калием называется элемент, находящийся в периодической системе Менделеева под 19-ым номером. Вещество принято обозначать заглавной буквой К (от латинского Kalium). В русской химической номенклатуре настоящее название элемента появилось благодаря Г.И. Гессу в 1831 году. Изначально калий называли «аль-кали», что в переводе с арабского означает «зола растений».
Именно едкий кали стал материалом для самого первого получения вещества. Едкий кали, в свою очередь, добывался из поташа, который являлся продуктами горения растений (карбонат калия). Его первооткрывателем стал Х. Дэви. Стоит отметить, что карбонат калия является прототипом современного моющего средства.
Позже он использовался для удобрений, используемых в сельском хозяйстве, в производстве стекла и других целей. В настоящее поташ – это пищевая добавка, прошедшая официальную регистрацию, а калий научились добывать совершенно другими путями.
В природе калий можно обнаружить только в виде соединений с другими элементами (например, морская вода, или минералы), свободный его вид не встречается вообще. Он способен в достаточно короткий промежуток времени окисляться на открытом воздухе, а также вступать в химические реакции (например, при взаимодействии калия с водой, образуется щелочь).
Описание калия
Калий в виде простого вещества представляет собой щелочной металл. Для него характерен серебристо-белый окрас. На свежей поверхности моментально появляется блеск. Калий является мягким металлом, легко поддающимся плавлению. Если вещество или его соединения поместить в пламя горелки, то огонь приобретет розово-фиолетовый цвет.
Физические свойства калия
Калий очень мягкий металл, который легко разрезать обычным ножом. Его твердость по Бринеллю составляет 400 кн/м 2 (или 0,04 кгс/мм 2 ). Он имеет объемноцентрированную кубическую кристаллическую решетку (5=5,33 А). Его плотность составляет 0,862 г/см 3 (20 0 С).
Вещество начинает плавиться при температуре в 63,55 0 С, закипать – при 760 0 С. Имеет коэффициент термического расширения, который равняется 8,33*10 -5 (0-50 0 С). Его удельная теплоемкость при температуре в 20 0 С составляет 741,2 дж/(кг*К) или же 0,177 кал/(г* 0 С). При той же температуре имеет удельное электросопротивление, равное 7,118*10 -8 ом*м. Температурный коэффициент электросопротивления металла составляет 5,8*10 -15 .
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Калий является щелочным металлом. В связи с этим, металлические свойства калия проявляются типично, так же, как и других подобных металлов.
Элемент проявляет свою сильную химическую активность, а кроме этого, также выступает в роли сильного восстановителя Как уже говорилось выше, металл активно вступает в реакцию с воздухом, о чем свидетельствует появление пленок на его поверхности, в результате чего его цвет становится тусклым. Данную реакцию можно наблюдать невооруженным глазом.
Если калий на протяжении достаточно длительного времени контактирует с атмосферой, то есть вероятность его полного разрушения. При вступлении в реакцию с водой, происходит характерный взрыв. Это связано с выделяющимся водородом, который воспламеняется характерным розовато-фиолетовым пламенем. А при добавлении в воду, реагирующую с калием фенолфталеина, она приобретает малиновый цвет, который свидетельствует о щелочной реакции образующегося гидроксида калия (КОН).
При взаимодействии металла с такими элементами, как Na, Tl, Sn, Pb, Bi , образуются интерметаллиды
Указанные характеристики калия говорят о необходимости соблюдений определенных правил безопасности и условий во время хранения вещества. Так, вещество следует покрывать слоем бензина, керосина или силикона. Это делается для полного исключения его контакта с воздухом или водой.
Стоит отметить, что в условиях комнатной температуры металл вступает в реакцию с галогенами. Если его немного нагреть, то он легко взаимодействует с серой. В случае же увеличения температуры, калий способен соединяться с селеном и теллуром.
Если повысить температуру более 200 0 С в атмосфере водорода, то образуется гидрид КН, который способен воспламеняться без посторонней помощи, т.е. самостоятельно. Калий совершенно не взаимодействует с азотом, даже если для этого создать надлежащие условия (повышенные температуру и давление). Однако, контактировать эти два вещества можно заставить, повлияв на них электрическим разрядом. В данном случае получится азид калия KN3 и нитрид калия K3N. Если нагреть вместе графит и калий, то в результате получатся карбиды KC8 (при 300 °С) и KC16 (при 360 °C).
При взаимодействии калия и спиртов получаются алкоголяты. Кроме этого, калий делает существенно быстрее процесс полимеризации олефинов и диолефинов. Галогеналкилы и галогенарилы вместе с девятнадцатым элементом в результате дают калийалкилы и калийарилы.
Энергия ионизации (первый электрон)
Электронное строение атома калия
Калий имеет положительно заряженное ядро атома (+19). В середине этого атома присутствуют 19 протонов и 19 нейтронов, которые окружаются четырьмя орбитами, где в постоянном движении находятся 19 электронов. Электроны распределены на орбиталях в следующем порядке:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 .
На внешнем энергетическом уровне атома металла находится всего 1 валентный электрон. Это объясняет тот факт, что абсолютно во всех соединениях калий имеет валентность 1. В отличие от лития и натрия, данный электрон располагается на более удаленном расстоянии от ядра атома. Это является причиной повышенной химической активностью калия, чего нельзя сказать об упомянутых двух металлах. Таким образом, внешняя электронная оболочка калия представлена следующей конфигурацией:
Не смотря на присутствие вакантных 3p- и 3d-орбиталей, возбужденное состояние отсутствует.
Источник: mining-prom.ru
Типы кристаллических решёток

Этот видеофрагмент даёт возможность учащимся сделать вывод о единой природе химической связи. На примерах рассматриваются свойства веществ в зависимости от типа химической связи.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет.
Получите невероятные возможности

1. Откройте доступ ко всем видеоурокам комплекта.

2. Раздавайте видеоуроки в личные кабинеты ученикам.

3. Смотрите статистику просмотра видеоуроков учениками.
Получить доступ
Конспект урока «Типы кристаллических решёток»
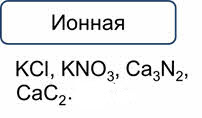
Для определения типа кристаллической решётки поступают следующим образом. Если связь в соединении ионная, то кристаллическая решётка всегда ионного типа: хлорид калия, нитрат калия, нитрид кальция, карбид кальция, оксид алюминия.
Если связь металлическая, то и кристаллическая решётка всегда металлическая: латунь, железо, медь, натрий.

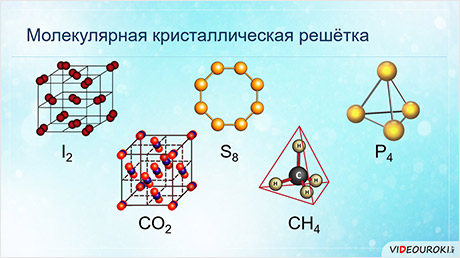
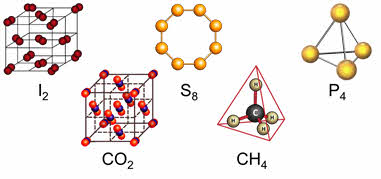
Если связь ковалентная, то решётка может быть, как атомной, так и молекулярной. Веществами с атомной кристаллической решёткой являются: карборунд, оксид кремния четыре, бор, кремний, алмаз, графит, чёрный и красный фосфор.

У веществ с молекулярной кристаллической решёткой в узлах кристаллической решётки расположены молекулы, прочность данной связи слабая.
Для веществ с молекулярной кристаллической решёткой характерны низкие температуры плавления, то есть они легкоплавки и летучи, значительная сжимаемость, иногда запах, а также явление сублимации, или возгонки, как для йода и твёрдого углекислого газа.
Для веществ с молекулярной кристаллической решёткой характерна небольшая твёрдость, большинство этих веществ хорошо растворимы в воде. Молекулярную кристаллическую решётку имеют газы и жидкости в твёрдом агрегатном состоянии. Например, кристаллический йод, сера, белый фосфор, углекислый газ, большинство органических соединений.
У веществ с атомной кристаллической решёткой в узлах расположены атомы. Связь между атомами в кристаллические решётки – ковалентная, очень прочная. Для этих веществ характерны высокие температуры кипения и плавления, то есть они тугоплавки и нелетучий, очень твёрдые, практически не растворимы в воде и не имеют запаха.
Примером веществ с таким типом кристаллических решёток являются алмаз и графит.
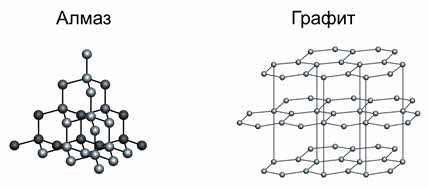
Как известно, твёрдость алмаза оценивается по шкале Мооса самым высоким значением – 10. Благодаря высокой твёрдости алмаз используют для изготовления буров, свёрл, шлифовальных инструментов, стеклорезов. Алмаз является камнем ювелиров, они используют отшлифованные алмазы – бриллианты.
Графит также является веществом с атомной кристаллической решёткой, но несмотря на это, он мягкий, так как имеет слоистую структуру. В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, связаны в правильные шестиугольники. Связи между слоями непрочные, за счёт этого графит мягкий. Графит, как и алмаз, тугоплавкий. Из него изготавливают электроды, твёрдые смазки, стержни для карандашей, замедлители нейтронов в ядерных реакторах.
Атомные кристаллические решётки имеют не только простые, но и сложные вещества. Например, все разновидности оксида алюминия. Такие, как наждак, корунд, рубин, сапфир.

Наиболее распространённое соединение кремния – это оксид кремния четыре, который также имеет атомную кристаллическую решётку. Почти чистым оксидом кремния четыре является минерал кварц.

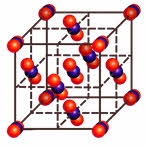
У веществ с ионным типом связи в узлах кристаллической решётки расположены ионы, связь между частицами – ионная, она прочная.
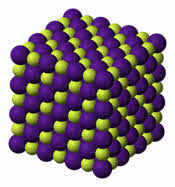
Для веществ с ионным типом связи характерны следующие свойства: высокие температуры плавления и кипения, они тугоплавки и нелетучи, они твёрдые, хрупкие, многие растворимы в воде. Их хрупкость объясняется тем, что если попробовать деформировать такую кристаллическую решётку, то один из её слоёв будет двигаться относительно другого слоя до тех пор, пока одинаково заряженные ионы не будут друг против друга. Эти ионы начнут отталкиваться друг от друга, и кристаллическая решётка разрушиться.
Вещества с ионным типом связи плохо проводят электрический ток и тепло. Но их растворы и расплавы проводят электрический ток. Вещества с ионным типом связи не имеют запаха.
Ионное соединение представляет собой гигантскую ассоциацию ионов, расположенных в пространстве благодаря равновесию сил притяжения и отталкивания.
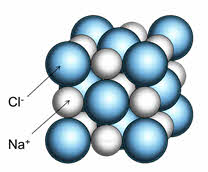
Например, кристалл хлорида натрия состоит из катионов натрия и анионов хлора. Каждый катион натрия окружён шестью анионами хлора, а каждый анион хлора – шестью катионами натрия. Наименьшей структурной единицей кристалла является элементарная ячейка. Строение элементарной ячейки зависит от соотношения размеров катиона и аниона.
У веществ с металлическим типом связи в узлах кристаллической решётки расположены атом-ионы, связь между ними металлическая. Связь может быть различной по прочности.
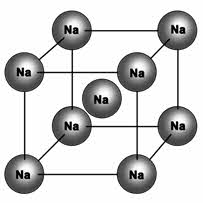
Металлическая кристаллическая решётка определяет свойства металлов: ковкость, пластичность, электро-и теплопроводность, металлический блеск, способность образовывать сплавы.
Пластичность выражается в способности металлов деформироваться под действием механической нагрузки. Это свойство лежит в основе ковки, прокатки металлов, их способности вытягиваться в проволоку. Пластичность объясняется тем, что под воздействием силы слои перемещаются относительно друг друга без разрыва связи между ними.
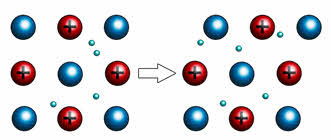
Например, если двумя плоскими стеклянными пластинками поместить несколько капель воды, то пластинки будут свободно скользить относительно друг друга, но вот разъединить их будет достаточно сложно. Таким образом, в данном опыте вода играла роль свободных электронов, которые находятся в металлической кристаллической решётке.
Наиболее пластичными металлами являются золото, серебро и медь. Именно из золота можно сделать самую тонкую фольгу толщиной три тысячных миллиметра. Такую тонкую фольгу использую для золочения. Примером может служить Янтарная комната в Большом Екатерининском дворце.
Высокая электропроводность металлов обусловлена наличием свободных электронов, которые под действием электрического тока приобретают направленное движение.
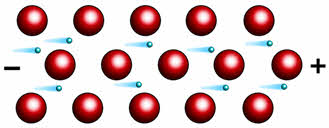
Лучшими проводниками электрического ока являются серебро и медь, немного худшим – алюминий. Однако в большинстве случаев в качестве электропроводов используют алюминий, а не медь.
Теплопроводность металлов также объясняется движением свободных электронов, которые сталкиваются с атом-ионами в узлах кристаллической решётки и обмениваются с ними энергией. Благодаря этому свойству металлическая посуда равномерно нагревается.
Вещества с металлическим типом кристаллической решётки имеют металлический блеск из-за отражения световых лучей.
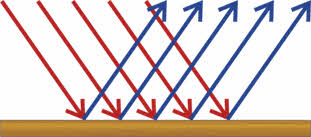
Высокой светоотражающей способностью обладают ртуть, серебро, палладий и алюминий. Из серебра, палладия и алюминия изготавливают зеркала, прожектора и фары. В порошкообразном состоянии металлы теряют свой блеск, только магний и алюминий сохраняют его.

Большинство металлов имеет серебристо-белый цвет. Только золото окрашено в жёлтый цвет, а медь в красный.
Металлическая кристаллическая решётка характерна не только для металлов, но и для сплавов. Это отличает металлические сплавы от других сплавов: стекла, фарфора, керамики, базальтов, гранитов, гнейсов.
Источник: videouroki.net
