Медь, свойства атома, химические и физические свойства.
Поделитесь информацией:
63,546(3) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1
Медь — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 29. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), четвертом периоде периодической системы.
Общие сведения:
| 100 | Общие сведения | |
| 101 | Название | Медь |
| 102 | Прежнее название | |
| 103 | Латинское название | Cuprum |
| 104 | Английское название | Copper |
| 105 | Символ | Cu |
| 106 | Атомный номер (номер в таблице) | 29 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, тяжёлый, цветной металл |
| 109 | Открыт | Известна с глубокой древности |
| 110 | Год открытия | 9000 г. до н.э. |
| 111 | Внешний вид и пр. | Пластичный металл золотисто-розового цвета (либо розового цвета при отсутствии оксидной плёнки) |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0068 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10 -7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 6,0·10 -6 % |
| 122 | Содержание в Солнце (по массе) | 0,00007 % |
| 123 | Содержание в метеоритах (по массе) | 0,011 % |
| 124 | Содержание в организме человека (по массе) | 0,0001 % |
Свойства атома меди :
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 63,546(3) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 |
| 203 | Электронная оболочка | K2 L8 M18 N1 O0 P0 Q0 R0 |
Химические свойства меди:
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, 0, +1, +2 , +3, +4 |
| 302 | Валентность | I, II |
| 303 | Электроотрицательность | 1,90 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 745,48 кДж/моль (7,726380(4) эВ) |
| 305 | Электродный потенциал | Cu + + e — → Cu, E o = +0,520 В, |
Cu 2+ + e — → Cu + , E o = +0,153 В,
Кристаллические решетки.
Кристаллические решетки металлов | Матвед 1
Физические свойства меди:
| 400 | Физические свойства | |
| 401 | Плотность* | 8,96 г/см 3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), |
8,02 г/см 3 (при температуре плавления 1084,62 °C и иных стандартных условиях, состояние вещества – жидкость),
7,962 г/см 3 (при 1127 °C и иных стандартных условиях, состояние вещества – жидкость),
7,881 г/см 3 (при 1227 °C и иных стандартных условиях, состояние вещества – жидкость),
7,799 г/см 3 (при 1327 °C и иных стандартных условиях, состояние вещества – жидкость),
7,471 г/см 3 (при 1727 °C и иных стандартных условиях, состояние вещества – жидкость),
7,307 г/см 3 (при 1927 °C и иных стандартных условиях, состояние вещества – жидкость),
10 Па (при 1661 K),
100 Па (при 1850 K),
1 кПа (при 2089 K),
10 кПа (при 2404 K),
0 кДж/моль (при 298 К, для состояния вещества – твердое тело),
Кристаллическая решётка меди:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
Дополнительные сведения:
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-50-8 |
Примечание:
205* Эмпирический радиус атома меди согласно [1] и [3] составляет 128 пм.
206* Ковалентный радиус меди согласно [1] и [3] составляет 132±4 пм и 117 пм соответственно.
401* Плотность меди согласно [3] составляет 8,92 г/см 3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело).
402* Температура плавления меди согласно [3] и [4] составляет 1083,4 °С (1356,55 K, 1982,12 °F) и 1083 °С (1356,15 K, 1981,4 °F) соответственно.
403* Температура кипения меди согласно [3] и [4] составляет 2567 °С (2840,15 K, 4652,6 °F) и 2543 °C (2816,15 К, 4609,4 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) меди согласно [3] и [4] составляет 13,01 кДж/моль и 13 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) меди согласно [3] и [4] составляет 304,6 кДж/моль и 302 кДж/моль соответственно.
- https://en.wikipedia.org/wiki/Copper
- https://de.wikipedia.org/wiki/Kupfer
- https://ru.wikipedia.org/wiki/Медь
- http://chemister.ru/Database/properties.php?dbid=1https://chemicalstudy.ru/med-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/» target=»_blank»]chemicalstudy.ru[/mask_link]
1. Кристаллическая структура меди
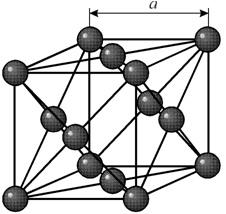
1. Из равенства осевых единицa=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число атомов меди в элементарной ячейке 1/8*8+1/2*6=4. 1/8 – доля каждого атома меди, находящегося в вершине в элементарной ячейке данной структуры. 8 – число таких атгмов.1/2 – доля каждого атома находящегося в грани элементарной ячейки меди.
3. Атомы меди образуют сложную кубическую гранецентрированную ячейку Бравэ.
4. Поскольку ячейки атомов меди гранецентрированные, в базисе указываются координаты 4-х атомов. [[000;1/2 1/2 0; 1/2 0 1/2;0 1/2 1/2]]. Записывая базис, мы указываем координаты тех атомов, трансляцией которых можно получить всю пространственную решетку.
5. Основные трансляции для атомов меди –
. Перемещая любой из атомов меди (например, расположенный в начале координат) на величины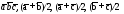
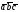 , мы получим все другие атомы меди в пространственной решетке, расположенные в вершинах ячеек.
, мы получим все другие атомы меди в пространственной решетке, расположенные в вершинах ячеек.
6. В структуре меди любой атом, расположенный в вершине ячейки имеет двенадцать ближайших соседей, которыми является атомы, находящиеся в центрах граней. Поэтому КЧ=12.
2. Кристаллическая структура вольфрама.
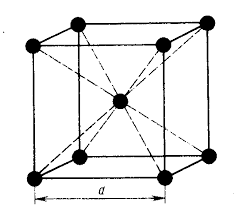
Рис. 2. Крист. структура вольфрама
1. Из равенства осевых единиц a=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число атомов вольфрама в элементарной ячейке, ZW= 1/8 х 8 +1= 2, где 1/8 — доля каждого атома вольфрама, находящегося в вершине, в элементарной ячейке данной структуры; 8 — число такихатомов. 1 атом находится в центре ячейки.
3. Атомы вольфрама образуют сложную кубическую объемноцентрированную ячейку Бравэ.
4. Базисы для атомов вольфрама -[[1/2 1/2 1/2]], [[000]]. Записывая базис, мы указываем координаты того атома, трансляцией которого можно получить всю пространственную решетку.
5. Основные трансляции для атомов вольфрама –
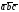 . Перемещая атом, расположенный в начале координат на величины
. Перемещая атом, расположенный в начале координат на величины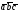 .
.6. В структуре вольфрама каждый атом окружен восемью атомами, расположенными в вершинах ячейки. КЧ=8.
3. Кристаллическая структура , α-Ti
Рис. 3. Крист. структура α-Ti.
1. Из равенства осевых единиц a=b≠c и осевых углов α=β =90°,γ=120 следует, что сингония является гексагональной
2. Определим число атомов α-Ti в элементарной ячейке 1/8*8+1=2. 1/8 – доля каждого атома α-Ti, находящегося в вершине в элементарной ячейке данной структуры. 8 – число таких атгмов.1 –атома находящегося внутри элементарной ячейки.
3. Из рис. 4 очевидно, что атомы α-Ti образуют гексагональную компактную плотноупакованная решетку Браве.
4. Базисы для атомов α-Ti -[[2/3 1/3 1/2]], [[000]]. Записывая базис, мы указываем координаты того атома, трансляцией которого можно получить всю пространственную решетку.
5. –
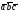 ,222222 . Они присущи примитивной ячейке Браве. Перемещая любой из атомов α-Ti (например, расположенный в начале координат) на величины
,222222 . Они присущи примитивной ячейке Браве. Перемещая любой из атомов α-Ti (например, расположенный в начале координат) на величины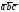 , мы получим все другие атомы в пространственной решетке, расположенные в вершинах ячеек. Также транслируя 2222222 мы получим атомы внутри решетки.
, мы получим все другие атомы в пространственной решетке, расположенные в вершинах ячеек. Также транслируя 2222222 мы получим атомы внутри решетки.6. В структуре α-Ti каждый атом имеет 12 ближайших соседей атомов поэтому КЧ = 12.
4. Кристаллическая структура NaCl
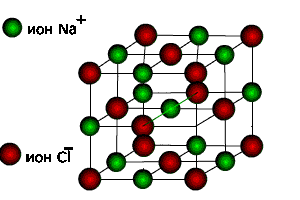
Рис. 4 Крист. структура NaCl.
1. Из равенства осевых единиц a=b=c и осевых углов α=β=γ=90° следует, что сингония является кубической.
2. Определим число ионов натрия ZNa и хлораZClв элементарной ячейке,ZNa= 1/8 х 4 = 1/2, где 1/8 — доля каждого иона натрия, находящегося в вершине, в элементарной ячейке данной структуры; 4 — число таких ионов.ZCl= 1/8 х 4 = 1/2, где 1/8 — доля каждого иона хлора, находящегося в вершине, в элементарной ячейке данной структуры; 4 — число таких ионов. Число ионов натрия равно числу ионов хлора.
3. Из рис. 4, очевидно, что ионы натрия образуют кубическую гранецентрированную ячейку Браве. Чтобы определить, какую ячейку образует ионы хлора, нужно рассмотреть и соседние ячейки. Выделив в них ионы хлора, нетрудно видеть, что они также образуют гранецентрированную ячейку Браве Р.
4. Запишем базис для ионов натрия и ионов хлора. Поскольку ячейки ионов натрия и хлора примитивные, в базисе указываются координаты двух ионов. Для иона хлора — [[1/2 1/2 1/2]], [[000]]. Для иона натрия — [[1/2 1/2 1/2]], [[000]].
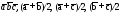
5. Основные трансляции для ионов натрия – . Для ионов хлора трансляция те же.
6. В структуре хлористого натрия каждый ион хлора окружен шестью ионами натрия. Число ближайших ионов хлора к каждому иону натрия также равно шести.. Поэтому КЧNaпо Cl = 6 и КЧСl поNa= 6.
Источник: studfile.net
Медь

Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки).
Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
- Структура
- Свойства
- Запасы и добыча
- Происхождение
- Применение
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
Смотрите так же:


СТРУКТУРА
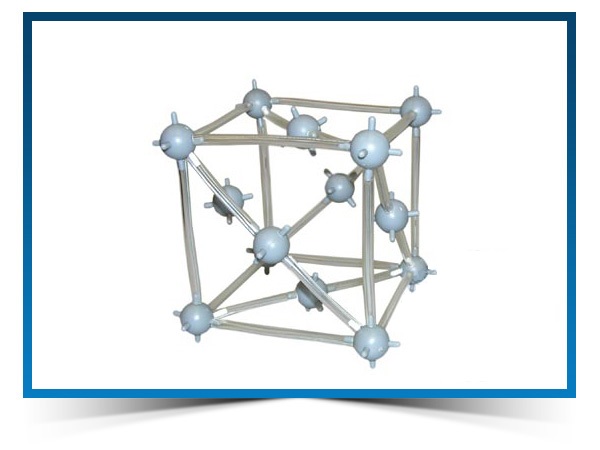
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура – кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками “медной зелени” (малахит), “медной сини” (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА
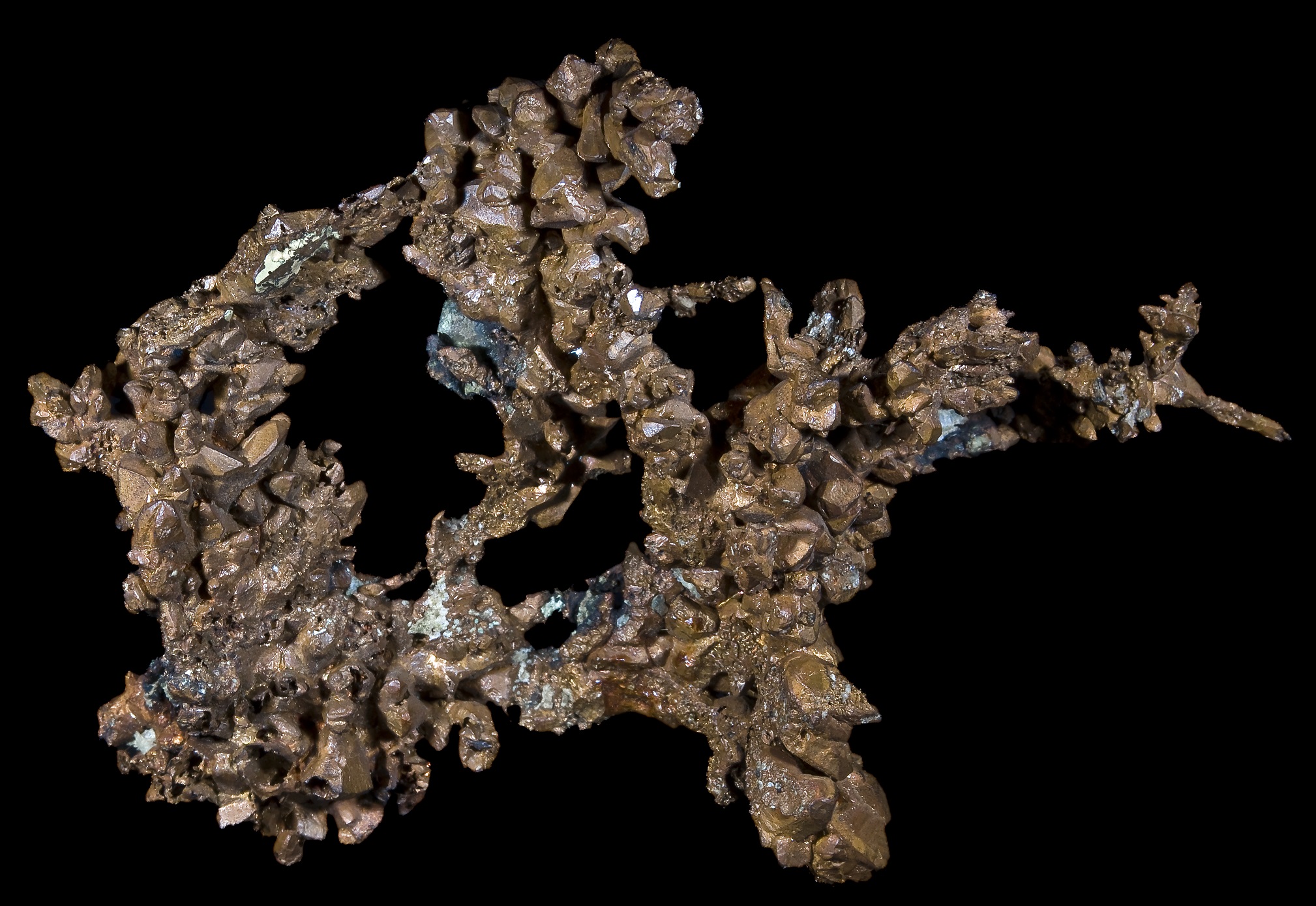
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА

Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
ПРОИСХОЖДЕНИЕ

Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).
Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.
Наиболее известные месторождения самородной меди – Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).ПРИМЕНЕНИЕ

Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.Медь (англ. Copper) – Cu
Молекулярный вес 63.55 г/моль Происхождение названия От греческого “Kyprium”, то есть “кипрский металл”, по названию острова Кипр IMA статус действителен, описан впервые до 1959 (до IMA) КЛАССИФИКАЦИЯ
Strunz (8-ое издание) 1/A.01-10 Nickel-Strunz (10-ое издание) 1.AA.05 Dana (7-ое издание) 1.1.1.3 Dana (8-ое издание) 1.1.1.3 ФИЗИЧЕСКИЕ СВОЙСТВА
Цвет минерала медно-красный, тускнеющий в черный или зеленый на воздухе Цвет черты медно-красный Прозрачность непрозрачный Блеск металлический Спайность нет Твердость (шкала Мооса) 2,5-3 Прочность ковкий Излом зазубренный Плотность (измеренная) 8.94 – 8.95 г/см 3 Радиоактивность (GRapi) Магнетизм диамагнетик ОПТИЧЕСКИЕ СВОЙСТВА
Цвет в отраженном свете розовато-белый Плеохроизм не плеохроирует Люминесценция в ультрафиолетовом излучении не флюоресцентный КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
Точечная группа m3m (4/m 3 2/m) – гексоктаэдрический Пространственная группа Fm3m (F4/m 3 2/m) Сингония кубическая Параметры ячейки a = 3.615Å Морфология кубы, додекаэдры и тетрагексаэдры; редко октаэдры и сложные комбинации; нитевидные, древовидные Двойникование Двойники по по шпинелевому закону Источник: mineralpro.ru