
Диаграмма Пурбе системы Hg-HgO [12]
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg2 2+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые. В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:


добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакциинитрата ртути (II) со ртутью получается нитрат ртути (I):
УРАНОВЫЙ ЛОМ В РТУТИ / классика и оригинал

В степени окисления +2 ртуть образует катионы Hg 2+ , которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (

В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса:
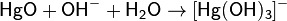
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6d 10 — электронной оболочки, что приводит к возможности существования соединений ртути(IV), но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4.
Свойства металлической ртути
Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке [15] :

и азотной кислоте:

Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:

РТУТЬ, ОСТОРОЖНО!
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2.
При нагревании до 300 °C ртуть вступает в реакцию с кислородом:

При этом образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.

Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода. При нагревании ртути с серой образуется сульфид ртути(II):

Ртуть также реагирует с галогенами (причём на холоде — медленно).
Ртуть можно окислить также щелочным раствором перманганата калия:

и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.

Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
Источник: studfile.net
Электронная конфигурация атома ртути (Hg)
Hg (ртуть) — элемент с прядковым номером 80 в периодической системе. Находится в VI периоде. Температура плавления: -38.9 ℃. Плотность: 13.55 г/см 3 .
Электронная формула атома ртути в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10
Электронная формула атома ртути в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2
Сокращенная электронная конфигурация Hg:
[Xe] 4f 14 5d 10 6s 2
Ниже приведена электронно-графическая схема атома ртути

Распределение электронов по энергетическим уровням в атоме Hg
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 18
4-й уровень (N): 32
5-й уровень (O): 18
6-й уровень (P): 2

Валентные электроны ртути
Количество валентных электронов в атоме ртути — 12.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| s | 6 | +1/2 | ||
| s | 6 | -1/2 | ||
| d | 5 | 2 | -2 | +1/2 |
| d | 5 | 2 | -1 | +1/2 |
| d | 5 | 2 | +1/2 | |
| d | 5 | 2 | 1 | +1/2 |
| d | 5 | 2 | 2 | +1/2 |
| d | 5 | 2 | -2 | -1/2 |
| d | 5 | 2 | -1 | -1/2 |
| d | 5 | 2 | -1/2 | |
| d | 5 | 2 | 1 | -1/2 |
| d | 5 | 2 | 2 | -1/2 |
Степени окисления, которые может проявлять ртуть: +1, +2, +4
![]()
Поделитесь информацией с друзьями
![]()
Скачать перечень калькуляторов
Источник: your-online.ru
D-металлы II группы

D-металлы II группы – цинк, кадмий, ртуть – характеризуются наличием двух электронов в наружном слое атома: электронная конфигурация – (n–1)d 10 ns 2 , поэтому в своих соединениях эти элементы двухвалентны. Цинк и кадмий имеют постоянную степень окисления +2. Эта же степень окисления характерна и для ртути, однако ртуть может образовывать соединения типа Cl–Hg–Hg–Cl, в которых она двухвалентна, но имеет степень окисления +1. Диссоциация таких соединений в растворе протекает с образованием иона Hg2 2+ :
Цинк и кадмий – активные металлы, стоящие в ряду напряжений до водорода. Цинк и кадмий схожи по своим химическим свойствам, с тем лишь различием, что гидроксид и оксид кадмия не являются амфотерными соединениями. Как и для d-элементов I группы для кадмия и цинка характерны реакции образования амминокомплексов, цианидных комплексов, аквакомплексов, а для цинка ещё и гидроксокомплексов. Цинк как амфотерный металл способен растворяться в растворах щелочей, проявляя свойства сильного восстановителя:
Порошкообразный цинк восстанавливает нитрат- и нитрит-ионы в щелочном растворе до аммиака (см. также раздел 5.2.4 «Азотистая кислота и её соли» лекции 5): 4 Zn + KNO3 + 7 KOH + 6 H2O ® NH3 + 4 K2[Zn(OH)4]
Ртуть – единственный металл, который при обычных условиях находится в жидком состоянии. Ртуть способна растворять в себе многие металлы, образуя с ними сплавы – амальгамы.
Одна из особенностей химии ртути заключается в том, что при действии щелочей на растворы солей ртути, как и в случае серебра, образуются не гидроксиды, а оксиды ртути. Гидроксиды ртути не получены:
Нитрат ртути (I) Hg2(NO3)2 – одна из немногих растворимых солей ртути в степени окисления +1 – получается действием холодной разбавленной азотной кислоты на избыток ртути:
Используя раствор Hg2(NO3)2, можно обменной реакцией получить любую малорастворимую соль ртути (I), например, каломель Hg2Cl2:
Нитрат ртути (II) образуется при взаимодействии ртути с избытком горячей концентрированной HNO3: Hg + 4 HNO3 (конц.) ® Hg(NO3)2 + 2 NO2 + 2 H2O.
Хлорид ртути (II), или сулема, образуется при непосредственном взаимодействии простых веществ или нагреванием сульфата ртути (II) с хлоридом натрия; образующаяся сулема сублимируется; от последнего слова она и получила своё название:
Сулема – одна из немногих солей, которая в водном растворе слабо диссоциирована. Сулема, как и все растворимые соли ртути, – сильный яд.
Соединения Hg2 2+ в зависимости от условий реакции проявляют как окислительные, так и восстановительные свойства:
Соединения ртути в степени окисления +1 склонны к диспропорционированию по схеме: Hg2 2+ ® Hg 0 + Hg 2+ .
Соединения ртути (II) обладают окислительными свойствами, например, Hg2Cl2 можно также получить, нагревая металлическую ртуть с сулемой:
Ион ртути Hg 2+ является комплексообразователем в реакциях образования ацидокомплексов, из которых наиболее прочными являются цианидные и галогенидные комплексы. Например, малорастворимые в воде осадки цианида и иодида ртути (II) способны растворяться в избытке растворов цианида и иодида калия с образованием комплексных соединений:
Хром

Электронная конфигурация невозбуждённого атома хрома – 3d 5 4s 1 .
Для хрома в соединениях наиболее характерны степени окисления +2, +3 и +6.
Хром – металл, находящийся в ряду напряжений до водорода; поэтому металлический хром восстанавливает водород из разбавленных растворов HCl и H2SO4. В холодной концентрированной азотной кислоте хром нерастворим и после обработки ею становится пассивным.
Хром образует три оксида: основной CrO, амфотерный Cr2O3, кислотный CrO3.
Соли двухвалентного хрома образуются при растворении металлического хрома в соляной или разбавленной серной кислотах. При добавлении к раствору соли хрома (II) выпадает жёлтый осадок гидроксида хрома (II), обладающего основными свойствами: Cr 2+ + 2 OH – ® Cr(OH)2¯.
Соединения хрома (II) неустойчивы, являются сильными восстановителями, окисляясь до соединений хрома (III), которые окрашены в различные тона зелёного цвета: 4 Cr(OH)2 + O2 + 2H2O ® 4Cr(OH)3.
Соли хрома (II) способны вытеснять водород из кислот ( = –0,41 В; = 0 В), а также постепенно разлагать воду при отсутстствии другого окислителя ( = –0,41 В при pH = 7):
Таким образом, хлорид хрома (II), образующийся при растворении металлического хрома в соляной кислоте, можно рассматривать как промежуточное соединение, которое окисляется ионами водорода до хлорида хрома (III):
2 Cr + 6 HCl ® 2 CrCl3 + 3 H2.
Степень окисления хрома +3 является самой устойчивой, поэтому соединения хрома (III) не проявляют ярко выраженных окислительных или восстановительных свойств. Для восстановления соединений хрома (III) в соединения хрома (II) необходим сильный восстановитель, например, атомарный водород в момент выделения, который является промежуточным продуктом взаимодействия цинка с соляной кислотой:
Сильные окислители (хлор, бром, пероксид водорода) окисляют в щелочной среде соединения хрома (III) до соединений хрома (VI):
Оксид и гидроксид хрома (III) – амфотерные соединения, поэтому они взаимодействуют со щелочами, образуя при сплавлении метахромиты, а в водном растворе – гидроксокомплексы: Cr2O3 + 2 NaOH ® 2 NaCrO2 + H2O;
Важнейшие соединения хрома (VI) – триоксид хрома, или хромовый ангидрид, и соли соответствующих ему кислот: хромовой H2CrO4 (хроматы) и дихромовой H2Cr2O7 (дихроматы). Сами кислоты существуют только в растворе и при попытке их выделения распадаются на ангидрид и воду. Хроматы окрашены в жёлтый цвет, дихроматы – в оранжевый. Хромат-ионы неустойчивы в кислой среде и превращаются при подкислении раствора в дихромат-ионы:
При этом жёлтая окраска раствора изменяется на оранжевую. Напротив, дихромат-ионы неустойчивы в щелочной среде и при подщелачивании раствора превращаются в хромат-ионы, вследствие чего оранжевый цвет раствора изменяется на жёлтый:
Дихроматы в кислой среде проявляют сильные окислительные свойства ( = + 1,33 В) и восстанавливаются до солей хрома (III):
Cr2O7 2– + 14 H + + 6 e – ® 2 Cr 3+ + 7 H2O;
Источник: studopedia.org