Золото (Au, от латинского Aurum) — химический элемент, который находится в I группе Таблицы Менделеева, входит в группу благородных металлов. К этой группе, помимо золота, относятся также серебро, платина, рутений, родий, палладий, осмий, иридий и иногда рений. Это название вышеперечисленные металлы получили благодаря высокой химической стойкости.
Золото очень ценится во всем мире ещё с самых древних времен. О его особой ценности говорит тот факт, что любой средневековый алхимик считал целью своей жизни получить золото из других веществ, чаще всего в качестве исходного использовалась ртуть. Существуют легенды, что некоторым, таким как Николя Фламель, это даже удалось.
Золото, свойства атома, химические и физические свойства.
196,966569(4) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s1
Золото — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 79. Расположен в 11-й группе (по старой классификации — побочной подгруппе первой группы), шестом периоде периодической системы.
Типы Химических Связей — Как определять Вид Химической Связи? Химия 9 класс
Атом и молекула золота. Формула золота. Строение атома золота
Изотопы и модификации золота
Свойства золота (таблица): температура, плотность, давление и пр.
Физические свойства золота
Химические свойства золота. Взаимодействие золота. Химические реакции с золотом
Таблица химических элементов Д.И. Менделеева
Экономические сведения
Золото в экономике играет роль общенационального эквивалента. С его помощью выражают стоимость всех товаров, в некоторых случаях оно становится полноценными деньгами или средством обмена. Есть несколько физических и химических свойств, которые позволяют выделять золото в товарном мире:
- делимость;
- однородность;
- пластичность и ковкость;
- портативность — значительная стоимость при небольшой массе;
- лёгкая обработка.
Во многих государствах драгметалл используется для чеканки монет, а его слитки хранятся в банковских учреждениях.
Его применяют не только в ювелирной сфере, для какой его добывал изначально, но и для производства некоторых деталей электроники, промышленной и бытовой техники. Сначала вещество использовали только для отделки украшений и одежды, но в 1500 году до нашей эры в Китае, Месопотамии, Египте и Индии оно стало играть роль денежных средств. Вместе с золотом эти функции выполняли серебро и медь.
Желание разбогатеть подталкивало добытчиков к поиску новых месторождений. Так были открыты и колонизованы многие территории. Источники полезного ископаемого нашли в Европе, Азии, Африке, Южной и Северной Америке, Австралии. Его активно вывозили в развитые страны — Англию, Испанию, Францию, Германию.
Великобритания стала первым государством, которое перешло на монометаллическую политику и исключило из обихода серебряные монеты. К XX веку эта валюта была утверждена в большинстве мировых стран.
После этого наступает кризис капитализма, государства начинают использовать бумажные деньги, которые нельзя разменять на золото. На некоторых территориях ограничивают и запрещают вывоз и ввоз металла, подготавливаются специальные рынки для работы с ним. Сегодня многие предприниматели и экономисты инвестируют в этот материал и получают неплохую прибыль за операции с ним.
Атом и молекула золота. Формула золота. Строение атома золота:
Золото (лат. Aurum) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Au и атомным номером 79. Расположен в 11-й группе (по старой классификации – побочной подгруппе первой группы), шестом периоде периодической системы.
Золото – металл. Относится к группе переходных металлов, а также к драгоценным металлам и металлам платиновой группы.
Золото обозначается символом Au.
Как простое вещество золото при нормальных условиях представляет собой мягкий, тяжёлый металл жёлтого цвета.
Молекула золота одноатомна.
Химическая формула золота Au.
Электронная конфигурация атома золота 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s1. Потенциал ионизации (первый электрон) атома золота равен 890,13 кДж/моль (9,225554(4) эВ).
Строение атома золота. Атом золота состоит из положительно заряженного ядра (+79), вокруг которого по шести оболочкам движется 79 электронов. При этом 78 электронов находятся на внутреннем уровне, а 1 электрон – на внешнем. Поскольку золото расположен в шестом периоде, оболочек всего шесть. Первая – внутренняя оболочка представлена s-орбиталью.
Вторая – внутренняя оболочка представлены s- и р-орбиталями. Третья и пятая – внутренние оболочки представлены s-, р- и d-орбиталями. Четвертая – внутренняя оболочка представлены s-, р-, d- и f-орбиталями. Шестая – внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома золота на 6s-орбитали находится один неспаренный электрон.
В свою очередь ядро атома золота состоит из 79 протонов и 118 нейтронов. Золото относится к элементам d-семейства.
Радиус атома золота (вычисленный) составляет 174 пм.
Атомная масса атома золота составляет 196,966569(4) а. е. м.
Содержание золота в земной коре составляет 3,1×10-7 %, в морской воде и океане – 5,0×10–9 %.
Золото, свойства атома, химические и физические свойства
Значение в искусстве
С самого начала разработки месторождений золото применяют для производства ювелирных изделий, украшений, религиозной и дворцовой утвари, посуды и столовых приборов. Мягкость и ковкость металла позволяет чеканить из него монеты, покрывать предметы гравировкой, заниматься литьём и изготовлением проволоки. Вещество применяется для создания филиграни, полировки поверхностей, которая будет после обработки переливаться световыми бликами с богатой игрой света и тени. Золото красиво смотрится в сочетании с другими материалами — серебром, платиной, жемчугом, драгоценными камнями, эмалью и чернью.
В медицине металл содержится в отечественных и импортных препаратах: взвеси масла, кризанил, миокризин, а также водорастворимых лекарствах, применяемых для приготовления растворов. Лекарства могут вызывать некоторые побочные эффекты, среди которых выделяют проблемы с почками, повышение температуры, раздражение кишечника. Нельзя прописывать средства, содержащие крупицы золота, тем, кто страдает от тяжёлых форм туберкулёза, почечной и печёночной недостаточности, заболеваний сосудистой системы и сахарного диабета.
Бета- и гамма-терапия подразумевает ввод в мягкие ткани гранул и штифтов из золота. Оно необходимо при лечении опухолей, но только в сочетании с хирургической и медикаментозной терапией. Предварительно проводят диагностику внутренних органов организма.
Золото играет большую роль в жизни человечества. Оно используется во многих сферах: экономической, ювелирной, медицинской, промышленной. Драгоценный металл имеет высокую стоимость, что обусловлено его физическими и химическими свойствами.
Свойства золота (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
Источник: lombard-mos.ru
Типы связей простым языком для ОГЭ по химии за 5 минут.
Химические связи бывают четырёх типов: ковалентная (полярная и неполярная), ионная, металлическая. Без знания теории их трудно отличать друг от друга, но благодаря данному материалу вы сможете понять тему буквально за 5-7 минут. Приятного изучения!
1. Металлическая связь — связь, в результате возникновения которой происходит образование простых веществ-металлов (Na, Mg, K и т.д).
Исходя из определения можно понять, что во всех простых веществах-металлах (см. по Периодической таблице химических элементов) находится металлическая связь.
2. Неполярная ковалентная связь — связь, в результате возникновения которой образуются простые вещества-неметаллы (алмаз, графит, фуллерен, S₈, N₂, а также исключения: PH₃ — фосфин; H₂O₂, Na₂O₂ и т.д — пероксиды).
3. Ковалентная полярная связь — связь между разными неметаллами (SO₂, NO₂, PCl₅ и т.д, кроме PH₃ — фосфина).
4. Ионная связь — связь между металлом (или катионом аммония NH₄⁺) и неметаллом (KCl, Li₃N, NH₄F и т.д).
Важно! В одном соединении может быть несколько химических связей: NH₄NO₃ — между катионом NH₄⁺ и анионом NO₃⁻ образована ионная связь , а в NO₃⁻ между азотом и кислородом образована ковалентная полярная связь .
Схема для «чайников»:
- Ме — металл
- неМе — неметалл
А теперь практика на задании 5 из ОГЭ.
1. Из предложенного перечня выберите два вещества с ионной связью.
- оксид кремния(IV)
- бромид калия
- магний
- сероводород
- пероксид натрия
1) Оксид кремния(IV) SiO₂ — состоит из неМе’+неМе», значит в оксиде кремния(IV) — ковалентная полярная связь . Ответ неверный.
2) Бромид калия KBr — состоит из Ме и неМе, связь — ионная . Ответ верный.
3) Магний Mg — состоит из Ме, связь — металлическая . Ответ неверный.
4) Cероводород H₂S — состоит из неМе’+неМе», связь — ковалентная полярная. Ответ неверный.
5) Пероксид натрия Na₂O₂ (структурная формула Na-O-O-Na) — в соединении имеется два типа связи. Между натрием и кислородом связь ионная, т.к Ме+неМе (ответ правильный). Между атомами кислорода связь ковалентная неполярная .
Домашнее задание
1. Из предложенного перечня выберите два вещества с ковалентной неполярной связью.
2. Из предложенного перечня выберите два вещества, которые имеют такой же тип химической связи, как и угарный газ.
- углерод
- веселящий газ (N₂O — оксид азота(I))
- нитрид натрия
- кислород
- сернистый газ (SO₂ -оксид серы(IV))
3. Для каждого вещества определите тип химической связи.
Ответы на домашнее задание
Задание 1. 14
Задание 2. 25
- I₂ — ковалентная неполярная
- HBr — ковалентная полярная
- Na₂O₂ — ковалентная неполярная и ионная
- PH₃ — ковалентная неполярная
- HNO₃ — ковалентная полярная
- (NH₄)₂SO₄ — ковалентная полярная и ионная
- Au — металлическая
Если вам понравилась статья, то подписывайтесь, ставьте лайки, пишите комментарии.
Источник: dzen.ru
Ковалентная связь: полярная, неполярная, механизмы ее появления

Сам термин «ковалентная связь» происходит от двух латинских слов: «со» – совместно и «vales» – имеющий силу, так как это связь происходящая за счет пары электронов, принадлежащей одновременно обоим атомам (или говоря более простым языком, связь между атомами за счет пары электронов, являющихся общими для них). Образование ковалентной связи происходит исключительно среди атомов неметаллов, причем появляться она может как в атомах молекул, так и кристаллов.
Впервые ковалентная химическая связь была обнаружена в далеком 1916 году американских химиком Дж. Льюисом и некоторое время существовала в виде гипотезы, идеи, лишь затем была подтверждена экспериментально. Что же выяснили химики по ее поводу? А то, что электроотрицательность неметаллов бывает довольно большой и при химическом взаимодействии двух атомов перенос электронов от одного к другому может быть невозможным, именно в этот момент и происходит объединение электронов обоих атомов, между ними возникает самая настоящая ковалентная связь атомов.
Типы связи
- обменный,
- донорно-акцептный.
При обменном типе ковалентной связи между атомами каждый из соединяющихся атомов представляет на образование электронной связи по одному неспареному электрону. При этом электроны эти должны иметь противоположные заряды (спины).
Примером подобной ковалентной связи могут быть связи происходящие молекуле водорода. Когда атомы водорода сближаются, в их электронные облака проникают друг в друга, в науке это называется перекрыванием электронных облаков. Как следствие, электронная плотность между ядрами увеличивается, сами они притягиваются друг к другу, а энергия системы уменьшается. Тем не менее, при слишком близком приближении ядра начинают отталкиваться, и таким образом возникает некое оптимально расстояние между ними.
Более наглядно это показано на картинке.
Что же касается донорно-акцепторного типа ковалентной связи, то он происходит когда одна частица, в данном случае донор, представляет для связи свою электронную пару, а вторая, акцептор – свободную орбиталь.
Также говоря о типах ковалентной связи можно выделить неполярную и полярную ковалентные связи, более подробно о них мы напишем ниже.
Неполярная связь
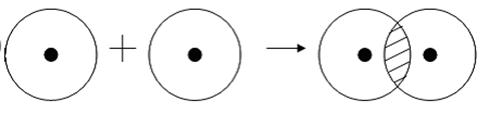
Определение ковалентной неполярной связи просто, это связь, которая образуется между двумя одинаковыми атомами. Пример образование неполярной ковалентной связи смотрите ниже на схеме.
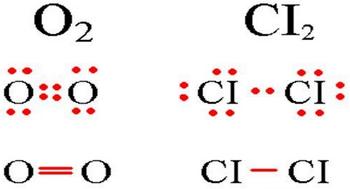
Схема ковалентной неполярной связи.
В молекулах при ковалентной неполярной связи общие электронные пары располагаются на равных расстояниях от ядер атомов. Например, в молекуле кислорода (на схеме выше), атомы приобретают восьми электронную конфигурацию, при этом они имеют четыре общие пары электронов.
Веществами с ковалентной неполярной связью обычно являются газы, жидкости или сравнительно низкоплавные тверды вещества.
Полярная связь
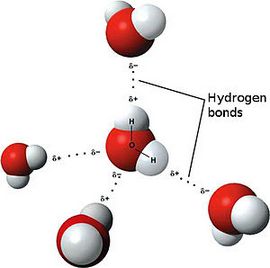
Теперь же ответим на вопрос какая связь ковалентная полярная. Итак, ковалентная полярная связь образуется, когда ковалентно связанные атомы имеют разную электроотрицательность, и обобществленые электроны не принадлежат в равной степени двум атомам. Большую часть времени обобществленые электроны находятся ближе к одному атому, чем к другому. Примером ковалентной полярной связи могут служить связи, возникающие в молекуле хлороводорода, там обобществленые электроны, ответственные за образование ковалентной связи располагаются ближе к атому хлора, нежели водорода. А все дело в том, что электроотрицательность у хлора больше чем у водорода.

Так выглядит схема ковалентной полярной связи.
Ярким примером вещества с полярной ковалентной связью является вода.
Как определить связь
Что же, теперь вы знаете ответ на вопрос как определить ковалентную полярную связь, и как неполярную, для этого достаточно знать свойства и химическую формулу молекул, если эта молекула состоит из атомов разных элементов, то связь будет полярной, если из одного элемента, то неполярной. Также важно помнить, что ковалентные связи в целом могут возникать только среди неметаллов, это обусловлено самим механизмом ковалентных связей, описанным выше.
Видео
И в завершение видео лекция о теме нашей статьи, ковалентной связи.
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika19[email protected] или в Фейсбук, с уважением автор.
Эта статья доступна на английском языке – Covalent Bond.
Источник: www.poznavayka.org