В химии степень окисления элементов говорит о том, как проходят окислительно-восстановительные реакции, а точнее — как при этом атомы перераспределяют между собой электроны. Это не очень сложная тема, но в ней часто бывает путаница. Разберемся, как считать степень окисления в разных соединениях.
18 декабря 2021
· Обновлено 30 декабря 2022
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
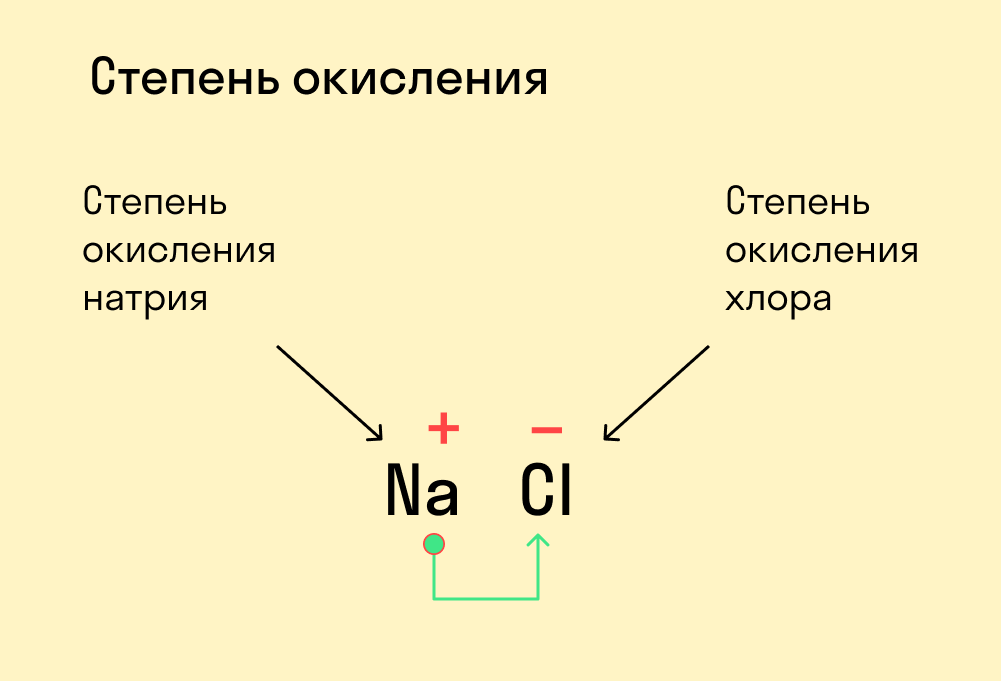
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Как определить степень окисления элементов | Железо и его соединения | Видеоурок | Химия ЕГЭ ОГЭ ВПР
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
- Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
- У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
- У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
- Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Получай лайфхаки, статьи, видео и чек-листы по обучению на почту
![]()
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Получить подарок!
Как рассчитать степень окисления
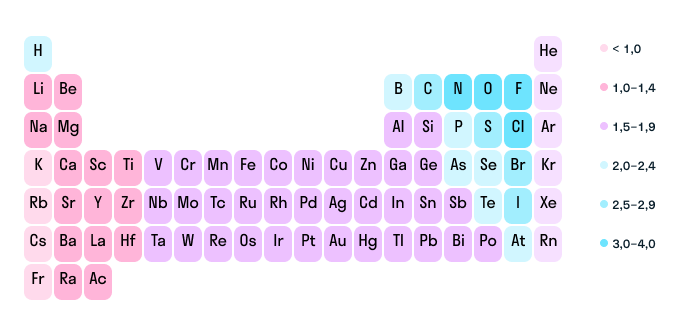
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Как определить степень окисления в веществе, где много элементов? #shorts
Шкала относительной электроотрицательности
В нейтральной молекуле все окислительные числа в сумме образуют ноль. В ионе их сумма равна заряду иона.
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
- у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
- у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
- у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
- у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.

Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
- Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
- Пример Степень окисления Cl2, S8 равна 0.
- Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N -3 H4 +1 .
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
1.4. Химические свойства
Для железа характерны степени окисления железа — +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe3+ нацело гидролизуются даже в кислой среде. Fe(OH)3 растворяется (и то не полностью), только в концентрированных щелочах. Fe2O3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли кислоты несуществующей в свободном виде кислоты HFeO2):
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe+2(Fe+3O2)2.
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
1.4.2. Свойства простого вещества
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующего дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
С кислородом железо реагирует при нагревании. При сгорании железа на воздухе образуется оксид Fe3O4, при сгорании в чистом кислороде — оксид Fe2O3. Если кислород или воздух пропускать через расплавленное железо, то образуется оксид FeO. При нагревании порошка серы и железа образуется сульфид, приближённую формулу которого можно записать как FeS.
При нагревании железо реагирует с галогенами. Так как FeF3 нелетуч, железо устойчиво к действию фтора до температуры 200—300 °C. В хлоре железо горит (при температуре около 200 °C), при этом образуется коричневый летучий димер Fe2Cl6. Если взаимодействие железа и брома протекает при комнатной температуре или при нагревании и повышенном давлении паров брома, то образуется FeBr3.
При нагревании FeCl3 и, особенно, FeBr3 отщепляют галоген и превращаются в галогениды железа(II). При взаимодействии железа и иода образуется иодид Fe3I8.
При нагревании железо реагирует с азотом, образуя нитрид железа Fe3N, с фосфором, образуя фосфиды FeP, Fe2P и Fe3P, с углеродом, образуя карбид Fe3C, с кремнием, образуя несколько силицидов, например, FeSi.
При повышенном давлении металлическое железо реагирует с оксидом углерода(II) CO, причём образуется жидкий, при обычных условиях легко летучий пентакарбонил железа Fe(CO)5. Известны также карбонилы железа составов Fe2(CO)9 и Fe3(CO)12. Карбонилы железа служат исходными веществами при синтезе железоорганических соединений, в том числе и ферроцена состава (η5-C5H5)2Fe.
Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом.
С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II):
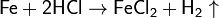
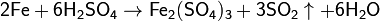
При взаимодействии железа с приблизительно 70%-й серной кислотой при нагревании реакция протекает с образованием сульфата железа(III):
Источник: studfile.net
V. Характерные степени окисления железа.

Fe — металл серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Железо относится к умеренно тугоплавким металлам. Температура плавления железа 1539 °C, температура кипения — 2862 °C.
III. Химические свойства.
Железо относится к металлам средней активности.
При хранении на воздухе при температуре до 200 °C железо постепенно покрывается плотной плёнкой оксида, препятствующей дальнейшему окислению металла. Во влажном воздухе железо покрывается рыхлым слоем ржавчины, который не препятствует доступу кислорода и влаги к металлу и его разрушению. Ржавчина не имеет постоянного химического состава, приближённо её химическую формулу можно записать как Fe2O3·xH2O.
1. Взаимодействие с кислородом.
Железо горит в кислороде, нагретое горит на воздухе.
| 150 — 600°C |
| t |
Пропускание кислорода или воздуха через расплавленное железо:
| t |
2. Взаимодействие с серой.
3. Взаимодействие с углеродом.
Fe + C → Fe3C (карбид железа)
4. Взаимодействие с азотом.
| t |
Fe + N2 → Fe3N (нитрид железа)
5. Взаимодействие с хлором.
| t |
2Fe + 3Cl2 → 2FeCl3 (хлорид железа)
| t |
6. Взаимодействие раскалённого железа с водяным паром:
7. Взаимодействие с кислотами.
8. Особенности взаимодействия железа с концентрированными H2SO4 и HNO3.
| t |
Fe + H2SO4 (конц)→ пассивирует
Fe + HNO3 (конц)→ пассивирует
С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
9. Взаимодействие с растворами солей — железо способно восстанавливать металлы, стоящие в ряду активности правее него.
10. Железо восстанавливает соединения железа (III):
11. Железо, при повышенном давлении, реагирует с несолеобразующим оксидом – СО с образованием веществ сложного состава – карбонилов — Fe(CO)5, Fe2(CO)9 и Fe3(CO)12.
IV. Получение железа
Основной способ получения железа – из железной руды (гематит (Fe2O3), магнетит (FeO·Fe2O3)) или электролиз растворов его солей (в этом случае получают «чистое» железо, т.е. железо без примесей).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Химизм доменного процесса следующий:
FeO + CO = Fe + CO2.
V. Характерные степени окисления железа.
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
| +2 | FeO | Fe(OH)2 | Слабоосновный | Слабый восстановитель |
| +3 | Fe2O3 | Fe(OH)3 | Очень слабое основание, иногда — амфотерный | Слабый окислитель |
| +6 | Не получен | 2FeO4> * | Кислотный | Сильный окислитель |
* Кислота в свободном виде не существует — получены только её соли.
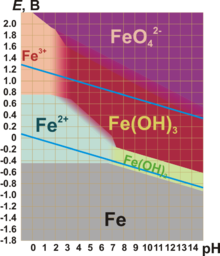
Для железа характерны степени окисления — +2 и +3.
Соединения Fe +2 .
FeO — основный оксид черного цвета, в воде не растворим, растворим в к кислотах, бурый железняк.
При взаимодействии с водородом при температуре 350 о С и коксом при температуре выше 1000 о С восстанавливается до чистого железа.
Получают оксид железа (II) разными способами:
1. В результате реакции восстановления оксида трёхвалентного железа угарным газом.
2. Нагревая железо при низком давлении кислорода
3. Разлагая оксалат двухвалентного железа в вакууме
4. Взаимодействием железа с оксидами железа при температуре 900-1000 о
Fe(OH)2 — кристаллическое вещество белого цвета. Иногда имеет зеленоватый оттенок из-за примесей солей железа. Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде. При нагревании разлагается.
1. Взаимодействие с кислотами.
2. При нагревании реагирует с концентрированными растворами солей аммония
| 150 — 200°C |
3. При нагревании разлагается.
4. Fe(OH)2 не устойчив, легко окисляется.
Получение Fe(OH)2.
1. В виде осадка в обменных реакциях растворов солей железа(II) со щёлочью
2. Образование гидроксида железа(II) является одной из стадий ржавления железа:
Качественные реакции на Fe +2
1. Pеакция с красной кровяной солью ( гексацианоферрат калия K3[Fe(CN)6]).
турнбуллева синь (гексацианоферрат (II) железа (III) — калия)
Появление турнбуллевой сини доказывает присутствие в растворе ионов железа (II).
2. Pеакция со щелочью.
Соединения Fe +3 .
Fe2O3 — оксид, проявляющий слабоамфотерные свойства, порошок бурого цвета, в воде не растворим. В природе встречается как минерал гематит.
Fe2O3 имеет и другие названия: окись железа, железный сурик, крокус, пигмент красный 101, пищевой краситель E172.
Может взаимодействовать как с кислотами, так и со щелочами.
1. Взаимодействие с кислотами.
2. Взаимодействие со щелочами.
3. Взаимодействие с солями щелочных металлов.
4. При температуре выше 1400°С разлагается:
1. Термическое разложение гидроксида железа (III)
2. Окисление пирита
Fe(OH)3 — образуется в виде осадка, называемым ржавчиной коричнево-бурого цвета, слабоамфотерный гидроксид с преобладанием основных свойств. В воде нерастворим. Легко образует коллоидные растворы.
1. Взаимодействие с кислотами.
2. Взаимодействие с концентрированными растворами щелочей.
гексагидроксоферрат (III) натрия
При сплавлении со щелочами или щелочными реагентами образует ферриты:
3. При нагревании разлагается:
Получение Fe(OH)3.
Соли железа (III).
Железо (III) образует соли практически со многими анионами.
В растворе соли железа (III) значительно более устойчивы, чем соли железа (II). Растворы солей имеют желто-бурую окраску и, вследствие гидролиза, кислую среду:
Fe 3+ + H2O = FeOH 2+ + H + .
Соли железа (III) гидролизуют в большей степени, чем соли железа (II), по этой причине соли железа (III) и слабых кислот нельзя выделить из раствора, они мгновенно гидролизуют с образованием гидроксида железа (III):
Проявляют все свойства солей.
Обладают преимущественно окислительными свойствами:
Качественные реакции на Fe 3+
1. Взаимодействие с гексацианоферратом (II) калия (желтой кровяной солью):
осадок синего цвета
берлинская лазурь (гексацианоферрат (III) железа (II) — калия)
2. Взаимодействие солей железа (III) с роданидом калия или аммония:
Но стоит только к кроваво-красному раствору роданида железа добавить раствор фторида натрия, как он становится совершенно бесцветным. Образуется очень прочный комплексный ион [FeF6] 3- , при этом роданидный комплекс разрушается:
Реакция со щелочью.
В природе встречается как минерал магнетит, или магнитный железняк. Он является хорошим проводником электрического тока и обладает магнитными свойствами. Образуется при горении железа и при действии перегретого пара на железо.
1. Нагревание при температуре 1538 о С приводит к его распаду
2. Вступает в реакцию с кислотами
3. Со щелочами реагирует при сплавлении
4. Вступает в реакцию с кислородом воздуха
5. Восстановление происходит при реакции с водородом и монооксидом углерода
Соединения Fe +6 .
H2FeO4 в свободном состоянии не существует.
Источник: poisk-ru.ru