Все углеводороды горят с образованием СО2 и Н2О.
Алканы при комнатной температуре очень стойки к действию обычных окислителей (KmnO4, K2Cr2O7).
Алкены и алкадиены с изолированными и куммулированными двойными связями при комнатной обесцвечивают раствор KmnO4:
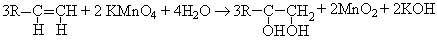
Вероятный механизм реакции:
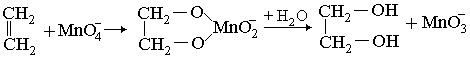
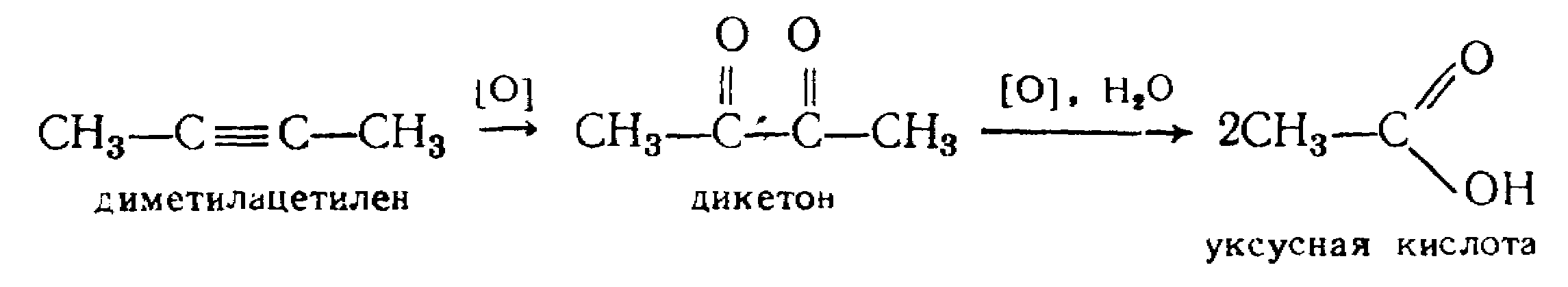
лкины более стойки к действию обычных окислителей, чем алкены. Окисление перманганатом приводит к разрыву С – С-связи и образованию карбоновых кислот:
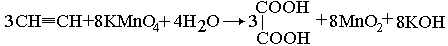
алканы с бромной водой не реагируют. С галогенами реакция протекает только на свету или при нагревании – реакция замещения по радикальному механизму (SR).
Алкины. Органическая химия
Взаимодействие с галогенами. На свету, в темноте при нагревании (250–400° С) или в присутствии катализаторов (хлориды меди, сурьмы, олова или иод) газообразный хлор последовательно замещает в молекуле метана все четыре атома водорода с образованием галогенпроизводных:
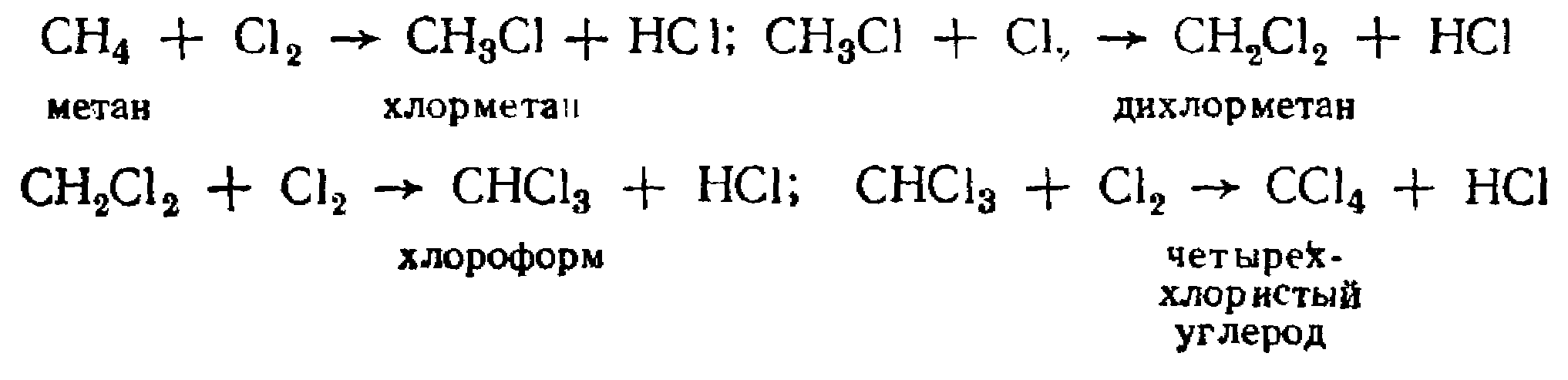
На практике при галогенировании алканов образуется сложная смесь продуктов, это связано с суммарным действием всех перечисленных ранее факторов. Так, при галогенировании изобутана образуются:
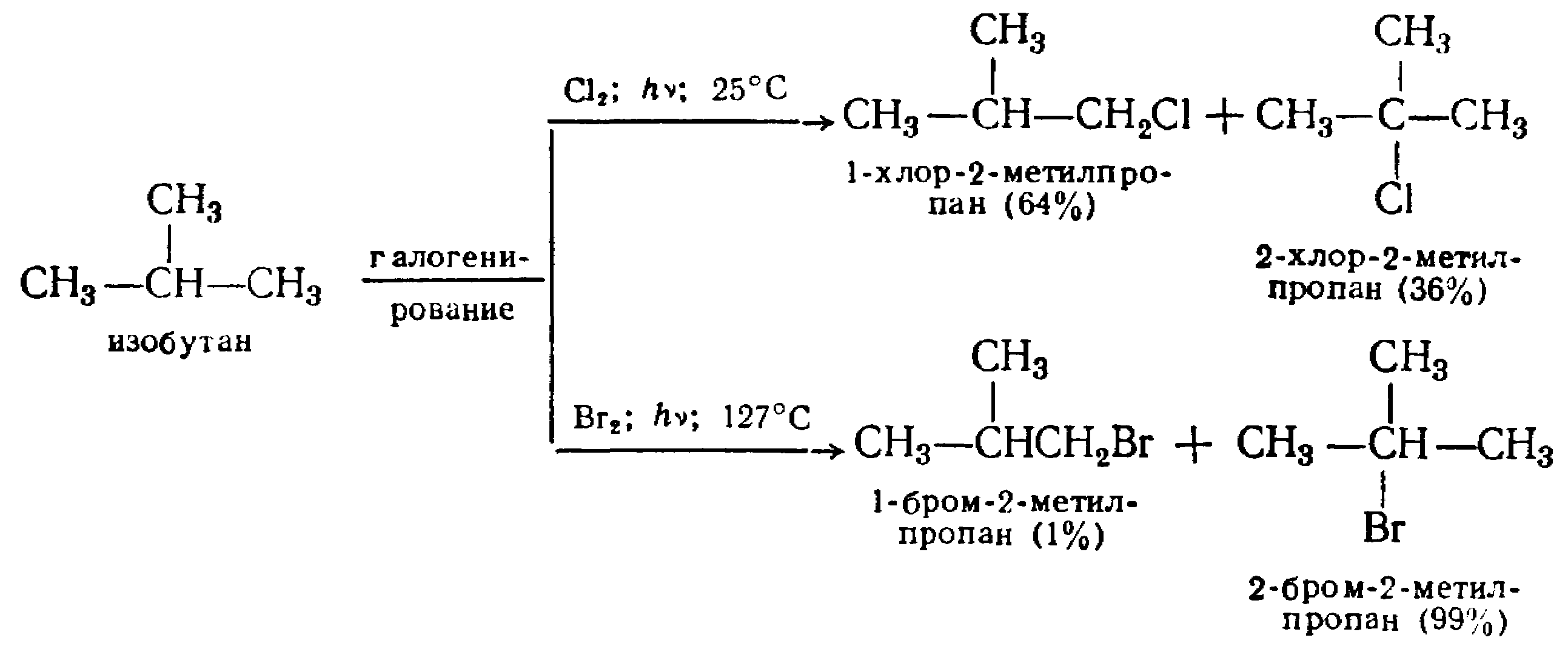
Кроме того, нужно помнить, что вероятность замещения девяти атомов водорода при первичных углеродных атомах больше, чем замещение одного водородного атома у третичного углерода. Хлорирование в присутствии катализаторов протекает по цепному ионному механизму:
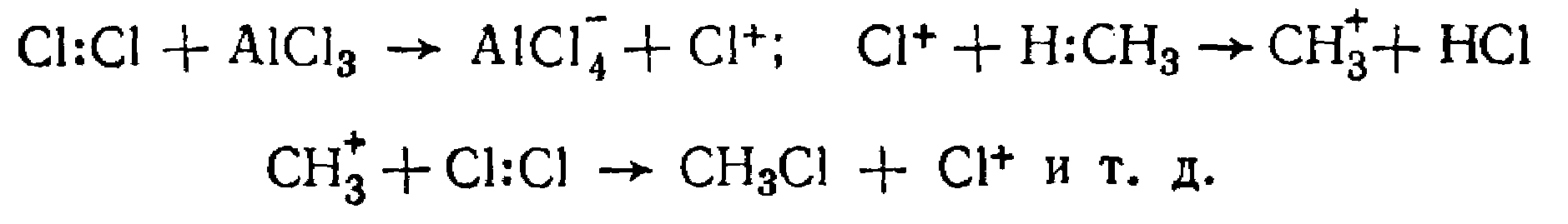
В лабораторной практике обычно не применяют прямое галогенирование для получения галогенпроизводных алканов, в технике значительное применение нашло галогенирование метана для синтеза СН3С1; СН2С12; СНС13 и CС14.
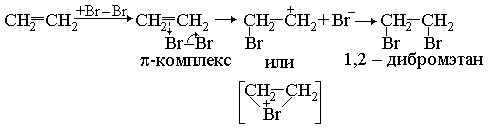
алкены и алкины обесцвечивают бромную воду. Происходит присоединение по ионному электрофильному механизму (АЕ). Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый -комплекс. Затем отделяется отрицательный ион галогена.
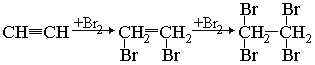
этин 1,2-дибромэтилен 1,1,2,2-тетрабромэтилен
Для приготовления реактива Толленса смешивают растворы NaOH и AgNO3, в результате чего выпадает осадок Ag2O:
Задание №35. Окисление алкина | ЕГЭ по Химии | От Марии Юрьевны
При осторожном добавлении водного раствора аммиака осадок растворяется и образуется ион [Ag(NH3)2] + :
алканы с аммиачным раствором оксида серебра не реагируют.
Алкены и алкины с аммиачным раствором оксида серебра реагируют по механизму нуклеофильного замещения (sn).
Внимание. В большинстве учебников отмечается, что эта реакция характерна лишь для алкинов с концевой тройной связью.
Источник: studfile.net
Химические свойства алкинов
ХИМИЧЕСКИЕ СВОЙСТВА
1️⃣ Галогенирование
СH≡CH + 2Cl₂ → Cl₂HC-CHCl₂ (1,1,2,2-тетрахлорэтан)
Алкины обесцвечивают бромную воду.


2️⃣ Гидрогалогенирование
Условие: t°C, соли ртути Hg²⁺
СH≡C-СH₃ + 2HCl → СH₃-C(Cl₂)-СH₃ (t°C, Hg²⁺)
Присоединение протекает по правилу Марковникова.
Гидрогалогенирование протекает ступенчато.
3️⃣ Гидрирование
Условие: t°C, Ni
СH≡CH + 2H₂ → СH₃-СH₃ (t°C, Ni)
Гидрирование протекает ступенчато.
4️⃣ Гидратация
Условие: t°C, соли ртути Hg²⁺, кислая среда H⁺
СH≡CH + H₂O → СH₃-CHO (t°C, Hg²⁺, H⁺)
При гидратации ацетилена образуется уксусный альдегид.
СH≡C-СH₃ + H₂O → СH₃-С(O)-СH₃ (t°C, Hg²⁺, H⁺)
При гидратации остальных алкинов образуются кетоны (в примере выше — ацетон).
5️⃣ Димеризация ацетилена
Условие: NH₄Cl, CuCl
2СH≡CH → CH₂=CH-C≡CH (NH₄Cl, CuCl)
Образуется винилацетилен. Из винилацентилена получают хлоропрен (путем гидрогалогенирования).
6️⃣ Тримеризация
Условие: t°C, активированный уголь
3СH≡CH → бензол (t°C, Сакт)
3СH≡C-СH₃ → 1,3,5-триметилбензол (t°C, Сакт)
Все реакции присоединения к алкинам протекают по ионному механизму
7️⃣ Реакция с аммиачным раствором оксида серебра (только для терминальных)
СH≡CH + 2[Ag(NH₃)₂]OH → AgС≡CAg + 4NH₃ + 2H₂O
Ацетиленид серебра — белый осадок. Эта реакция является качественной на терминальные алкины
8️⃣ Жёсткое окисление перманганатом калия
СH≡CH + 2KMnO₄ + 3H₂SO₄ → 2CO₂ + 2MnSO₄ + K₂SO₄ + 4H₂O
Протекает аналогично реакции окисления алкенов!
9️⃣ Горение (полное окисление)
Условие: t°C
2С₂H₂ + 5O₂ → 4CO₂ + 2H₂O (t°C)
Источник: bez-smenki.ru
Какие алкины реагируют с аммиачным раствором оксида серебра
называются непредельные углеводороды, молекулы которых содержат одну тройную связь. Первый член ряда – ацетилен `»HC»-=»CH»`, поэтому углеводороды этого ряда часто называют ацетиленовыми. Ближайшие гомологи ацетилена:
Общая формула гомологического ряда алкинов `»C»_n»H»_(2n-2)`. Она совпадает с общей формулой алкадиенов, поэтому алкины и алкадиены являются межклассовыми изомерами.
| Связь | `»C»-«C»` | `»C»=»C»` | `»C»-=»C»` |
| Длина, нм | `0,154` нм | `0,134` нм | `0,120` нм |
Алкины обладают структурной изомерией:
а) изомерия строения углеродного скелета (начиная с `»C»_5″H»_8`):
б) изомерия положения тройной связи в молекуле (начиная с `»C»_4″H»_6`):
| `»HC»-=»C» — «CH»_2 — «CH»_3` | `»H»_3″C» — «C»-=»C» — «CH»_3` |
| бутин-1 | бутин-2 |
в) межклассовая изомерия алкинов с алкадиенами:
| `»HC»-=»C» — «CH»_2 — «CH»_3` | `»H»_2″C»=»CH» — «CH»=»CH»_2` |
| бутин-1 | бутадиен-1,3 |
Пространственная изомерия для алкинов не характерна.
Номенклатура
В алкинах с неразветвленной углеродной цепью нумерацию начинают с того конца, ближе к которому находится тройная связь. В названии соответствующего алкана суффикс -ан заменяется на -ин. В разветвленных алкинах выбирают главную цепь так, чтобы она содержала тройную связь, даже если она при этом и не будет самой длинной. Перед названием главной цепи указывают номер атома углерода, при котором находится заместитель, и название этого заместителя.
Номер после главной цепи указывает положение тройной связи, например:
Физические свойства
В ряду алкинов наблюдаются те же закономерности, что и у алканов и алкенов. При обычных условиях `»C»_2 — «C»_4` — газы, `»C»_5-«C»_16` — жидкости, начиная с `»C»_17` — твёрдые вещества. Низшие алкины растворяются в воде плохо, однако лучше, чем алканы и алкены. В неполярных органических растворителях низшие алкины растворяются хорошо.
1. Дегидрогалогенирование дигалогенпроизводных соответствующих алканов, у которых два атома галогена находятся или при одном атоме углерода:
(структура продукта реакции определяется правилом Зайцева), или при двух соседних атомах углерода:
2. Дегалогенирование тетрагалогеналканов:
3. Высшие алкины можно получить по реакции:
`»CH»_3 — «C»-=»C» — «Na» + «Br» — «CH»_2 — «CH»_2 — «CH»_3 ->`
`-> «CH»_3 — «C»-=»C» — «CH»_2 — «CH»_2 — «CH»_3 + «NaBr»`.
4. Низшие алкины в лаборатории можно получить гидролизом карбидов:
`»CaC»_2 + 2″H»_2″O» -> «C»_2″H»_2 + «Ca(OH»)_2`
`»CaC»_2 + 2″HCl» -> «C»_2″H»_2 + «CaCl»_2`.
5. Ацетилен в промышленности получают крекингом углеводородов:
Химические свойства
а) гидрогалогенирование проходит в две стадии, использование катализатора `»AlCl»_3` облегчает протекание реакции:
б) при гидратации алкинов (реакция Кучерова) на первой стадии образуется неустойчивый непредельный спирт, который затем изомеризуется в альдегид или кетон:
в) галогенирование также проходит в две стадии с промежуточным образованием производных этилена, а затем этана:
`»HC»≡»CH» + «Br»_2 -> «CHBr»=»CHBr»`
`»CHBr»=»CHBr»+»Br»_2 -> «CHBr»_2 — «CHBr»_2`.
Обесцвечивание бромной воды является качественной реакцией на тройную связь.
2. Алкины, содержащие тройную связь в конце цепи, проявляют очень слабые кислотные свойства. Ацетилен и алкины-`1` способны образовывать соли (ацетилениды) при реакции с одновалентными металлами или их ионами:
$$ mathrm-mathrmequiv mathrm+mathrmto mathrm-mathrmequiv mathrm-mathrm+<mathrm>_uparrow $$
При взаимодействии ацетилена с аммиачным раствором оксида серебра образуется жёлтый осадок диацетиленида серебра:
`->»Ag» — «C»-=»C» — «Ag»darr + 4″NH»_3 + 2″H»_2″O»`.
Ацетилениды легко гидролизуются растворами кислот:
`»CH»_3 — «C»-=»C» — «Ag» + «HCl» -> «CH»_3 — «C»-=»CH» + «AgCl»darr`.
3. Алкины вступают в реакции окисления и восстановления.
а) При действии сильных окислителей в кислой среде ацетилен окисляется до щавелевой кислоты:
5 HC ≡ CH + 8 KMnO 4 + 12 H 2 SO 4 → → 5 HCOO — COOH + 8 MnSO 4 + 4 K 2 SO 4 + 12 H 2 O 5mathrmequiv mathrm+8<mathrm>_+12<mathrm>_<mathrm>_to phantom>to 5mathrm-mathrm+8<mathrm>_+4<mathrm>_<mathrm>_+12<mathrm>_mathrm
б) В водном растворе перманганат калия окисляет ацетилен до оксалата калия:
в) Использование в качестве окислителя раствора KMnO4 в серной кислоте при нагревании приводит к расщеплению тройной связи и образованию карбоновых кислот, в молекулах которых число атомов углерода соответствует числу атомов углерода в «осколках» после разрыва тройной связи:
г) Горение алкинов в кислороде – сильно экзотермическая реакция:
д) Гидрирование алкинов протекает при нагревании с металлическими катализаторами (Ni, Pt, Pd). Реакция может идти в две стадии:
` 4. Алкины способны к полимеризации.
а) Ацетилен димеризуется при пропускании через водно-аммиачный раствор `»CuCl»`:
Присоединение к винилацетилену хлороводорода приведёт к об разованию хлоропрена
– исходного сырья для производства хлоропренового каучука.
б) Тримеризация ацетилена на активированном угле приводит к образованию бензола.
Аналогичная реакция пропина приводит к образованию смеси гомологов бензола:
Источник: zftsh.online