Свойства алкинов – физические и химические похожи на свойства алкенов и алкадиенов. Однако кислотные свойства алкинов создают ряд отличительных химических свойств.
Физические свойства алкинов
Алкины, за исключением ацетилена, не имеют цвета и запаха. При нормальных условиях первые 4 члена ряда являются газами, с 5 по 15 – жидкостями, более 15 – твердыми веществами.
Растворимость алкинов
Алкины являются относительно полярными молекулами, поэтому хорошо растворимы в полярных растворителях или растворителях с низкой полярностью. В воде алкины растворяются незначительно, но лучше, чем алканы и алкены.
Точки плавления и кипения алкинов
Как правило, алкины плавятся и кипят при более высоких температурах, по сравнению соответствующих алканов и алкенов. Температуры плавления и кипения алкинов, увеличиваются пропорционально их молекулярной массе.
В таблице приведены физические постоянные некоторых алкинов:
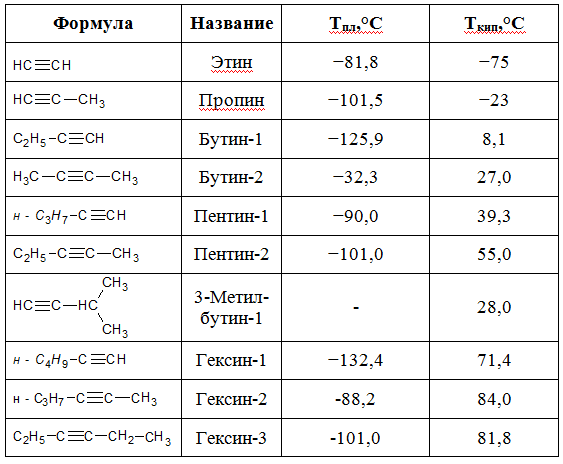
Алкины 0052
Химические свойства алкинов
В общем алкины более реакционноспособны, чем алканы и алкены. Большинство реакций, в которых они участвуют являются реакциями электрофильного присоединения. Однако терминальные алкины (тройная связь находится в конце цепи) также подвергаются и реакциям замещения. Атомы водорода при sp-гибридизованном атоме углерода способны подвергаться протонизации, вследствие чего алкины имеют относительно кислую природу.
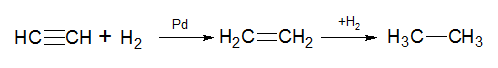
1) Гидрирование алкинов. В присутствии активных катализаторов (никель, платина) восстанавление алкинов водородом происходит сразу до алканов. При использовании менее активных катализаторов (Pd, железо Ренея) реакция протекает через стадию образования алкена:
При гидрировании гомологов ацетилена на первой стадии получаются цис-олефины.
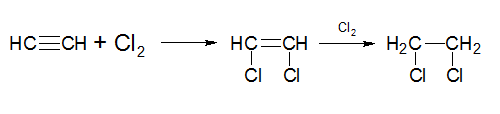
2) Галогенирование алкинов протекает в две легко разделимые стадии, из которых первая стадия протекает более энергично. При недостатке галогена реакция идет в одну стадию, при избытке – две стадии:
Взаимодействие ацетилена с аммиачным раствором оксида серебра
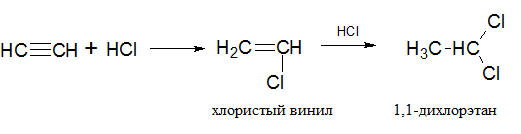
3) Гидрогалогенирование алкинов также протекает в две разделимые стадии. При гидрохлорировании ацетилена на первоначальном этапе образуется важный в промышленности продукт – хлористый винил, далее происходит образование 1,1-дихлорэтан:
Присоединение молекулы HCl к хлористому винилу происходит по правилу Марковникова. Аналогичным образом присоединяется молекула HBr.
4) Гидратация алкинов происходит согласно правилу Марковникова с участием Hg 2+ в качестве катализатора (реакция Кучерова). В ходе такой реакции, из ацетилена образуется ацетальдегид, а из его гомологов — кетоны: 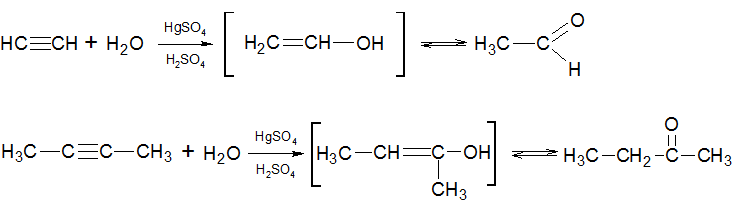
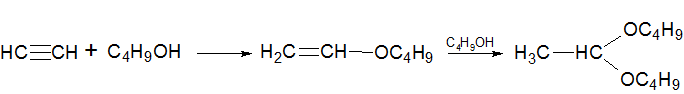 Подобным образом происходит присоединение меркаптанов.
Подобным образом происходит присоединение меркаптанов.
6) Присоединение кислот.
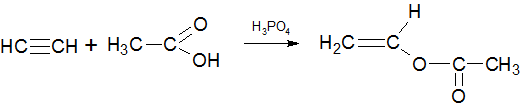
Присоединение уксусной кислоты к ацетилену происходит в условиях гетерогенного катализа (H3PO4 или B2O3) с образованием винилацетата:

Винилацетат хорошо полимеризуется с образованием поливинилацетата (ПВА):

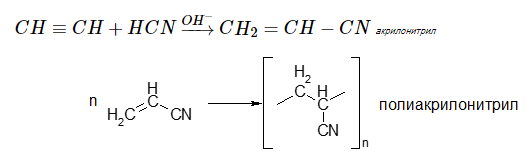
Присоединение синильной кислоты к ацетилену происходит с образованием акрилонитрила:
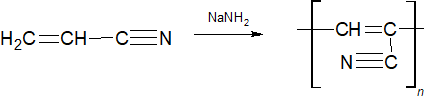
Акрилонитрил используют для получения полиакрилонитрила: 7) Присоединение хлоридов некоторых металлов к ацетилену:
Димеризация ацетилена происходит в присутствии солей Cu (I) с образованием винилацетилена. Дальнейшее его взаимодействие с соляной кислотой приводит к образованию хлоропрена, который используют при получении хлоропреновых каучуков:

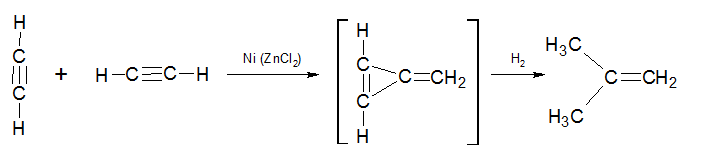
А.Д. Петров путем кросс-димеризации ацетилена получил изобутилен. В качестве катализаторов выступает никель в присутствии хлорида цинка:

Тримеризация ацетилена в присутствии активного угля и при температуре около 600°С ведет к образованию такого важного продукта, как бензол (реакция Зелинского):
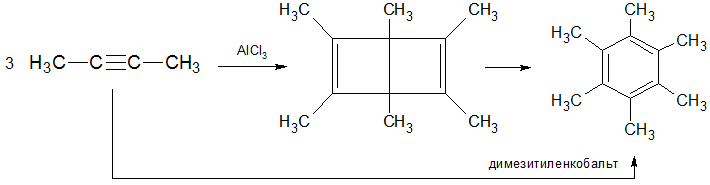
Ученый Шеффер в 1966 г обнаружил, что при пропускании над хлоридом алюминия раствора диметилацетилена в бензоле, последний тримеризуется. Продуктом реакции является гексаметилбицикло[2,2,0]гексадиен (гексаметилдьюаровский бензол), который далее при при воздействии температуры подвергается изомеризации в гексаметилбензолПри использовании в качестве катализатора димезитиленкобальта гексаметилбензол получается непосредственно из диметилацетилена:
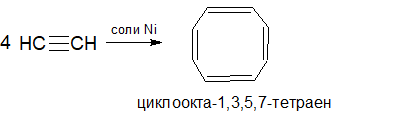
Тетрамеризация ацетилена под действием комплексных солей никеля ведет к образованию циклоокта-1,3,5,7-тетраена (синтез Реппе):

10) Окисление алкинов концентрированным раствором перманганата калия (KMnO4) в кислой среде протекает с образованием карбоновых кислот. Розовый раствор KMnO4 в ходе реакции обесцвечивается:
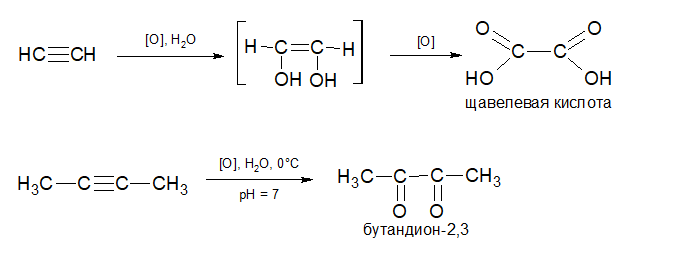
Окисление алкинов в мягких условиях, т.е. разбавленный раствор KMnO4, комнатная температура, происходит без разрыва связей. При окислении ацетилена продуктом реакции является щавелевая кислота, при окислении его гомологов в нейтральной среде реакцию можно остановить на стадии образования дикетонов:
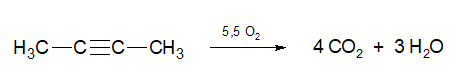
При горении алкинов происходит их полное окисление до углекислого газа и воды. Реакция экзотермическая и протекает с выделением 1300 кДж/моль тепла:
1) Взаимодействие с солями тяжелых металлов (качественная реакция). При взаимодействии ацетилена и монозамещенных гомологов с аммиачными растворами окиси серебра или полухлористой меди обрадуются нерастворимые осадки ацетиленидов:
Ацетилинид серебра Ag-C≡C-Ag – бесцветный и R-C≡C-Ag — белый
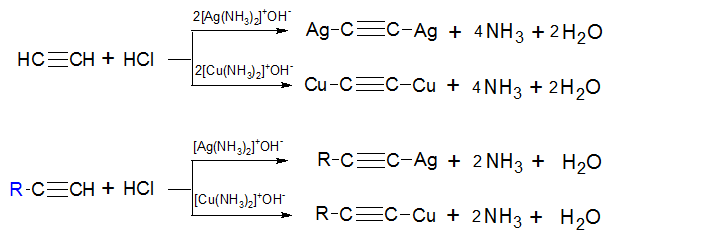
Ацетилинид меди Cu-C≡C-Cu – вишнево-бурый и R-C≡C-Cu – желто-бурый
Ацетилениды – взрывчатые вещества. Под действием кислот разлагаются с образованием ацетилена и соответствующих солей металлов.
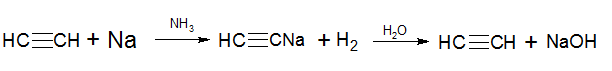
2) Взаимодействие ацетилена и его гомологов с щелочными и щелочноземельными металлами в жидком аммиаке также приводит к образованию ацетилинидов:
Действие производных Na и Mg, известных как реактив Иоцича, подобно реактиву Греньяра, поэтому широко используются в органическом синтезе.
3) Взаимодействие ацетилена и его гомологов с кетонами в присутствии едкого кали, под небольшим давлением (А.Е. Фаворский): 
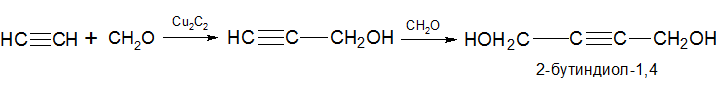 5) Ацетилен-аллен-диеновая перегруппировка Фаворского происходит при нагревании ацетиленов с металлическим натрием. При этом расположенная «внутри» соединения тройная связь перемещается в конец. А при нагревании ацетиленов с расположенной в конце тройной связью со спиртовым раствором щелочи происходит перемещение тройной связи к центру молекулы:
5) Ацетилен-аллен-диеновая перегруппировка Фаворского происходит при нагревании ацетиленов с металлическим натрием. При этом расположенная «внутри» соединения тройная связь перемещается в конец. А при нагревании ацетиленов с расположенной в конце тройной связью со спиртовым раствором щелочи происходит перемещение тройной связи к центру молекулы: 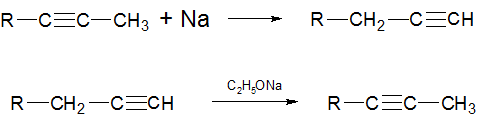
Рубрики
- ОБЩАЯ ХИМИЯ
- Основные понятия и законы химии
- Строение атомов элементов
- Периодический закон Д.И.Менделеева
- Химическая связь и строение молекул
- Основы термодинамики
- Химическая кинетика и равновесие химической реакции
- Растворы
- Окислительно-восстановительные реакции
- Электролиз
- Коррозия металлов
- Комплексные соединения
- Дисперсные системы. Коллоидные растворы
- I группа (щелочные металлы)
- II группа (щелочноземельные металлы)
- III группа (алюминий)
- IV группа (углерод, кремний)
- V группа (азот, фосфор)
- VI группа (кислород, сера)
- VII группа (галогены)
- Краткая история органической химии
- Теория строения А.М. Бутлерова
- Классификация органических соединений
- Изомерия и номенклатура органических соединений
- Типы химических реакций
- Алканы
- Алкены, алкадиены
- Алкины
- Спирты
- Простые эфиры
- Альдегиды, кетоны
- Карбоновые кислоты и сложные эфиры
Источник: zadachi-po-khimii.ru
Химические свойства алкинов
Гидрирование алкинов происходит примерно в тех же условиях и в присутствии тех же катализаторов, что и гидрирование алкенов. Первая стадия гидрирования ацетилена до этилена более экзотермична, чем вторая, где этилен превращается в этан:
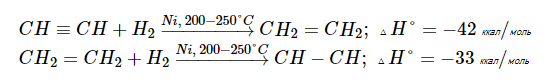
Отсюда следует, что теоретически гидрирование алкинов можно остановить на стадии образования алкена. Однако на практике в данных условиях алкины гидрируются прямо до алканов (вместо никеля в качестве катализатора также может быть использована и платина):
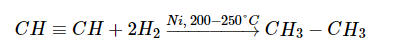
Галогенирование алкинов
В ходе галогенирования алкинов атомы галогена последовательно присоединяются к атомам углерода, участвующим в образовании кратной связи:
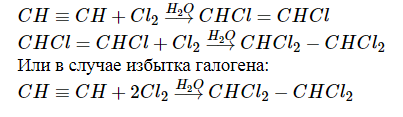
Гидрогалогенирование алкинов
При гидрогалогенировании алкинов реакция идет по правилу Марковникова, т.е. атом водорода присоединяется к наиболее гидрогенизированному углеродному атому кратной связи:
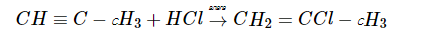
«Химические свойства алкинов»
Готовые курсовые работы и рефераты
Решение учебных вопросов в 2 клика
Помощь в написании учебной работы
Однако при дальнейшем гидрогалогенировании до соответствующего алкана присоединение галогеноводорода к кратной связи идет уже против правила Марковникова:
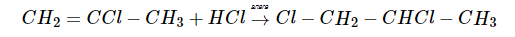
Гидроборирование алкинов
Алкины легко присоединяют диборан против правила Марковникова, образуя цис-алкенилбораны:
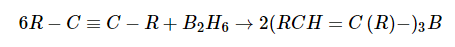
Далее алкенилбораны легко переводятся в соответствующие цис-алкены действием уксусной кислоты:
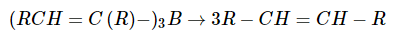
или окислить перекисью водорода до альдегида или кетона:
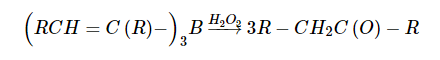
Гидратация алкинов
В результате гидратации ацетилена образуется ацетальдегид (реакция Кучерова):
В случае гидратации прочих алкинов с терминальной тройной связью образуются соответствующие кетоны. Например, в результате гидратации пропина образуется ацетон:
Взаимодействие с циановодородом
Данная реакция лежит в основе получения синтетических волокон:
Олигомеризация алкинов и циклообразование
В результате реакции олигомеризации получается дивинил
(бутадиен-1,3), который является сырьем для производства бутадиенового каучука:
Также ацетилен является реагентом для получения бензола:
Продукт этой реакции – бензол – широко применяется в промышленности для производства лекарств, пластмасс, резины, красителей.
Взаимодействие со спиртами
В результате взаимодействия со спиртами образуются простые эфиры. В качестве примера можно привести реакцию получения винилбутилового эфира, который является сырьем для синтеза бальзама Шостаковского, используемого в качестве антисептика при лечении трофических язв, гнойных ран, ожогов и обморожений:
Взаимодействие с уксусной кислотой
В результате взаимодействия ацетилена с уксусной кислотой получается винилацетат:
При дальнейшей полимеризации винилацетата получается поливинилацетат — клей ПВА.
А) Полное окисление:
Все эти реакции экзотермичны, т.е. окисление происходит с выделением большого количества теплоты. Температура горения ацетилена достигает 1500 – 2000 °С. Именно поэтому его используют для резки и сварки металлов и сплавов.
- Окисление перманганатом калия в кислой среде:
- Окисление хромовой смесью
Источник: spravochnick.ru