Слово «металл» заимствовано из немецкого языка и окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл», а разграничение этих понятий произошло во времена М.В.Ломоносова.
Немецкое слово «metall» произошло от латинского «metallum» — «рудник, металл».
В латинский язык слово пришло из греческого — μεταλλον: «рудник, копь».
В современном понимании, металлы — группа химических элементов, в виде простых веществ, обладающих характерными металлическими свойствами: высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Однако в астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия.
Как химические элементы металлы очень распространены. Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
6 элементов в группе щелочных металлов,
Тема 1.6 Металлы и неметаллы
6 в группе щёлочноземельных металлов,
38 в группе переходных металлов,
11 в группе лёгких металлов,
7 в группе полуметаллов,
14 в группе лантаноиды + лантан,
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
вне определённых групп — бериллий и магний.
Таким образом, к металлам относится 96 элементов из всех открытых.
Свойства металлов
Характерные свойства металлов
Металлический блеск (характерен не только для металлов: его имеют и неметаллы иод и углерод в виде графита)
Хорошая электропроводность (из неметаллов электропроводностью обладает также углерод)
Возможность лёгкой механической обработки (см.: пластичность; однако некоторые металлы, например, германий и висмут, непластичны)
Высокая плотность (обычно металлы тяжелее неметаллов)
Высокая температура плавления (исключения: ртуть , галлий и щелочные металлы)
Большая теплопроводность
В реакциях чаще всего являются восстановителями
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью.
Температуры плавления чистых металлов лежат в диапазоне от −39°C (ртуть) до 3410°C (вольфрам). За исключением щелочных, металлы плавятся при высокой температуре, однако некоторые, например, олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность затруднительно: требуется полностью очистить металлы, так как любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий.
Однако проволока из цинка или олова хрустит при сгибании, марганец и висмут почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла. Очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым.
Все металлы хорошие проводники. Это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность. По этой причине последние два металла чаще всего используют в качестве материала для проводов.
Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла. Широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Источник: dzen.ru
Какие химические элементы относятся к металлам
Видеоурок «Положение металлов в периодической системе химических элементов Д.И. Менделеева и особенности строения их атомов»
В разделе Химия 5 уроков
§ 1 Положение металлов в периодической системе химических элементов Д.И. Менделеева
В современной периодической системе Д.И. Менделеева размещено 118 химических элементов. Большая часть из них относится к металлам.
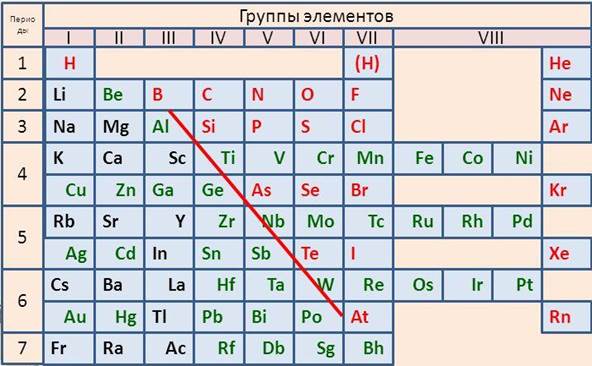
Металлы содержатся во всех группах этой системы, например, в первой группе все элементы, кроме водорода, относятся к металлам. Во второй группе — все металлы, в третьей группе все элементы являются металлами, кроме бора. В IV, V, VI группах металлы располагаются в побочных подгруппах и внизу главных подгрупп (в IV группе — это германий, олово, свинец, в V группе – сурьма, висмут, в VI группе – полоний). В VII – VIII группах металлы располагаются только в побочных подгруппах.
Таким образом, условная граница между элементами-металлами и элементами-неметаллами в главных подгруппах проходит по диагонали B (бор) — Si (кремний) – As (мышьяк) — Te (теллур) – At (астат). Все элементы побочных подгрупп относятся к металлам.
§ 2 Названия групп металлов в периодической системе химических элементов Д.И. Менделеева
Металлы I группы главной подгруппы — литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr) — называются щелочными. Их так назвали, потому что их гидроксиды являются растворимыми в воде основаниями – щелочами.
Металлы II группы главной подгруппы – магний (Mg), кальций (Ca), стронций (Sr),
барий (Ba), радий(Ra) — называются щелочноземельными. Их гидроксиды обладают щелочными свойствами, а оксиды сходны по тугоплавкости с оксидами алюминия и железа, которые ранее называли «земли».
В периодической системе выделяют группу благородных металлов: золото (Au),
серебро (Ag), платина (Pt) и металлы платиновой группы рутений (Ru), родий (Rh),
палладий (Pd), осмий (Os), иридий (Ir), их так назвали из-за блеска в изделиях и их способности не окисляться на воздухе.
§ 3 Строение атомов в металлах
Из положения металлов в периодической системе химических элементов можно определить и особенности их строения.
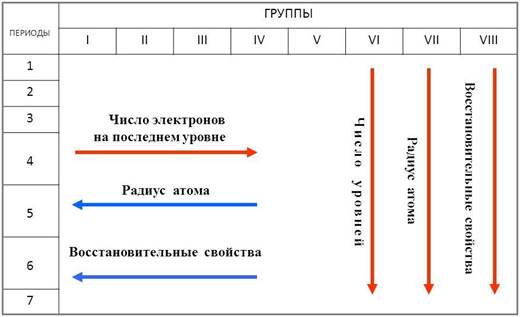
Первой особенностью является небольшое число электронов на внешнем уровне
(от 1 до 3 электронов) у большинства металлов.
Ко второй особенности можно отнести сравнительно большой радиус атома.
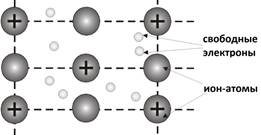
Атомы металлов в отличие от атомов неметаллов легко отдают наружные электроны и превращаются в положительно заряженные ионы. Свободные электроны перемещаются между ионами металлов. Положительные ионы металлов удерживаются все вместе за счет притяжения ко всем свободно движущимся в металлах электронам. Между этими частицами (свободными электронами и ионами металлов) возникает связь, которую называют металлической.
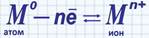
Схематично такую связь можно изобразить так:
; где М-символ элемента металла.
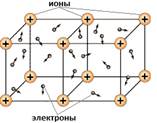
Электроны находятся в постоянном движении, при их столкновении с положительно заряженными ионами металлов ионы превращаются в нейтральные атомы, а затем снова в ионы, и такой процесс происходит непрерывно. Поэтому ввели понятие – ион-атом металла.
Металлическая связь имеется в металлах, находящихся в жидком и твердом состоянии. Твердые металлы – вещества кристаллические. Их кристаллические решетки называются металлическими. В узлах их решеток находятся ион-атомы металлов, а между ними передвигаются относительно свободные электроны. Металлическая связь является очень прочной.
§ 4 Краткие итоги по теме урока
В периодической системе Д.И. Менделеева из 118 химических элементов большая часть относится к металлам. Металлы содержатся во всех группах периодической системы.
Они в основном расположены в левой нижней части системы, условная граница между элементами-металлами и элементами-неметаллами в главных подгруппах проходит по диагонали B (бор) — Si (кремний) – As (мышьяк) — Te (теллур) – At (астат). Все элементы побочных подгрупп относятся к металлам. Для металлов характерна металлическая химическая связь и металлическая кристаллическая решетка. Металлическая связь очень прочная.
Список использованной литературы:
- Габриелян О.С. Химия. 9 класс: учебник для общеобразовательных учреждений/ — М.: Дрофа, 2010.
- Химия. 9 класс: Настольная книга учителя/О.С. Габриелян, И.Г. Остроумов. – М.: Дрофа, 2003.
- Рудзитис Г.Е., Фельдман Ф.Г. Химия: Неорган. химия. Орган. химия: Учеб. для 9 кл. общеобразоват. учреждений. -М.: Просвещение, 1999.
- https://ru.wikipedia.org/wiki/
Источник: znaika.ru
Металлы
Запрос «Металл» перенаправляется сюда; см. также другие значения.
Металлы — одни из самых распространённых материалов, используемых цивилизацией на протяжении практически всей её истории.
Мета́ллы (лат. metallum от др.-греч. metallon — шахта, рудник [1] ) — группа химических элементов, обладающих в виде простых веществ при нормальных условиях характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и характерный металлический блеск.
Источник: wiki2.org
