Но в реакциях (например, с кислородом или водой) на поверхности алюминия сразу образуется защитная оксидная пленка, металл пассивируется.
Как можно обеспечить постоянный доступ реагентов к поверхности металла?
Если царапать поверхность алюминия чем-нибудь твёрдым, оксидная плёнка вновь очень быстро образуется, и реакция прекратится.
Есть другой способ. Можно использовать способность алюминия образовывать амальгаму — сплав с ртутью , с которой плёнка оксида алюминия легко удаляется.
Если погрузить алюминий на несколько секунд в подкисленный раствор хлорида или нитрата ртути((II)), то произойдёт реакция замещения, и получится металлическая ртуть, которая осаждается на поверхности алюминия и образует с ним амальгаму:
(Al + Hg = Al(Hg)).
При нагревании алюминий активно реагирует с кислородом, серой, галогенами:
2 Al + 3 S = t Al 2 S 3 .
При взаимодействии алюминия с иодом нагревания не требуется, а катализатором реакции является капля воды:
Источник: www.yaklass.ru
Свойства алюминия
Химические свойства алюминия
Алюминий – металл. На внешнем электронном слое у атома алюминия три электрона в состоянии … 
 .Алюминий – сильный восстановитель, он находится в левой части электрохимического ряда напряжений металлов. Алюминий реагирует со многими простыми и сложными веществами.
.Алюминий – сильный восстановитель, он находится в левой части электрохимического ряда напряжений металлов. Алюминий реагирует со многими простыми и сложными веществами.
I)Взаимодействие алюминия с простыми веществами
1)при взаимодействии с галогенами образуются галогениды:

(хлорид алюминия)
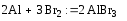
(бромид алюминия)
2)Алюминий легко соединяется с кислородом при комнатной температуре,при этом на поверхности алюминия образуется оксидная пленка (слой 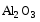 ). Эта пленка очень тонкая (
). Эта пленка очень тонкая ( мм),но прочная.Она защищает алюминий от дальнейшего окисления, поэтому называется защитной пленкой:
мм),но прочная.Она защищает алюминий от дальнейшего окисления, поэтому называется защитной пленкой:
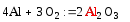
3)при взаимодействии с серой образуется сульфид:

(сульфид алюминия)
4)при взаимодействии с азотом при высокой температуре образуется нитрид:
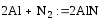
Элементы 13 (IIIA) группы и их соединения. Алюминий. 1 часть. 9 класс.
5)при очень высокой температуре алюминий взаимодействует с углеродом и образует карбид:

II) Взаимодействие алюминия со сложными соединениями
1)если на поверхности алюминия удалить оксидную пленку, то он активно взаимодействует с водой:

2)при высокой температуре алюминий реагирует с оксидами металлов,при этом образуется свободный металл и оксид алюминия. Взаимодействие алюминия при высокой температуре с оксидами металлов называется алюминотермией.Алюминотермию используют в металлургии для получения металлов:

3)Взаимодействия алюминия со щелочами.
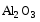
Алюминий, как и другие металлы, образующие амфотерные оксиды и гидроксиды, взаимодействует с растворами щелочей. Алюминий при обычных условиях покрыт защитной пленкой оксида . При погружении алюминия в раствор щелочи эта пленка растворяется:

Освобожденный от защитной пленки алюминий, будучи активным металлом, взаимодействует с водой подобно щелочным и щелочноземельным металлам:
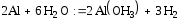
(1)
Образовавшийся гидроксид алюминия, являясь амфотерным гидроксидом ,взаимодействует со щелочью:

(2)
Складывая уравнения (1) и (2) ,получаем суммарное уравнение взаимодействия алюминия с раствором щелочи :

4)взаимодействие с разбавленными кислотами:

А)

3 2 окисление
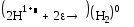
2 3 востановление

= = 1.662 В

= -6*96500*1.662= -962 кДж/моль
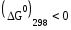
Реакция термодинамически возможна, т.к.

Б)

3 8 окисление
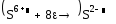
8 3 востановление

= =0.732 В

= -6*96500*0.732= -1695 кДж/моль
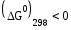
Реакция термодинамически возможна, т.к.

В)

3 2 окисление
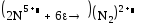
6 1 востановление
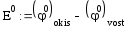
= =1.962 В
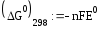
= -6*96500*1.962 = -1136 кДж/моль

Реакция термодинамически возможна, т.к.
5)А)взаимодействие с концентрированной серной кислотой при нагревании:

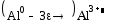
3 2 окисление

2 3 востановление

= =1.182 В
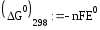
= -6*96500*1.182= -684 кДж/моль

Реакция термодинамически возможна, т.к.
На холоду алюминий не взаимодействует с концентрированной серной кислотой, так как пассивируется ею.
Б) с концентрированной азотной кислотой алюминий не реагирует. Она пассивирует алюминий. Поэтому концентрированную азотную кислоту хранят в алюминиевых емкостях.
Источник: studfile.net
Химические реакции алюминия

Химические свойства алюминия определяются его положением в периодической системе химических элементов.
Ниже представлены основные химические реакции алюминия с другими химическими элементами. Эти реакции определяют основные химические свойства алюминия.
С чем реагирует алюминий
Простые вещества:
- галогены (фтор, хлор, бром и иодин)
- сера
- фосфор
- азот
- углерод
- кислород (горение)
Сложные вещества:
- вода
- минеральные кислоты (соляная, фосфорная)
- серная кислота
- азотная кислота
- щелочи
- окислители
- оксиды менее активных металлов (алюмотермия)
С чем не реагирует алюминий
Алюминий не реагирует:
- с водородом
- в обычных условиях – с концентрированной серной кислотой (из-за пассивации – образования плотной оксидной пленки)
- в обычных условиях – с концентрированной азотной кислотой (также из-за пассивации)
Алюминий и воздух
Обычно поверхность алюминия всегда покрыта тонким слоем оксида алюминия, который защищает ее от воздействия воздуха, точнее, кислорода. Поэтому считается, что алюминий не вступает в реакцию с воздухом. Если же этот оксидный слой повреждается или удаляется, то свежая поверхность алюминия реагирует с кислородом воздуха. Алюминий может гореть в кислороде ослепительно белым пламенем с образованием оксида алюминия Al2O3.
Реакция алюминия с кислородом:
Алюминий и вода
Алюминий реагирует с водой по следующим реакциям [2]:
В результате этих реакций образуются, соответственно, следующие соединения алюминия:
- модификация гидроксида алюминия байерит и водород (1)
- модификация гидроксида алюминия богемит и водород (2)
- оксид алюминия и водород (3)
Эти реакции, кстати, представляют большой интерес при разработке компактных установок для получения водорода для транспортных средств, которые работают на водороде [2].
Все эти реакции являются термодинамически возможными при температуре от комнатной до температуры плавления алюминия 660 ºС. Все они являются также экзотермическими, то есть происходят с выделением тепла [2]:
- При температуре от комнатной до 280 ºС наиболее устойчивым продуктом реакции является Al(OH)3.
- При температуре от 280 до 480 ºС наиболее устойчивым продуктом реакции является AlO(OH).
- При температуре выше 480 ºС наиболее устойчивым продуктом реакции является Al2O3.
Таким образом, оксид алюминия Al2O3 становится термодинамически более устойчивым, чем Al(OH)3 при повышенной температуре. Продуктом реакции алюминия с водой при комнатной температуре будет гидроксид алюминия Al(OH)3.
Реакция (1) показывает, что алюминий должен самопроизвольно реагировать с водой при комнатной температуре. Однако на практике кусок алюминия, опущенный в воду, не реагирует с водой в условиях комнатной температуры и даже в кипящей воде. Дело в том, что алюминий имеет на поверхности тонкий когерентный слой оксида алюминия Al2O3. Эта оксидная пленка прочно удерживается на поверхности алюминия и предотвращает его реакцию с водой. Поэтому, чтобы начать и поддерживать реакцию алюминия с водой при комнатной температуре необходимо постоянно удалять или разрушать этот оксидный слой [2].
Алюминий и галогены
Алюминий бурно реагирует со всем галогенами – это:
- фтор F
- хлор Cl
- бром Br и
- иодин (йод) I,
с образованием соответственно:
Алюминий и кислоты
Алюминий активно вступает в реакцию с разбавленными кислотами: серной, соляной и азотной, с образованием соответствующих солей: сернокислого алюминия Al2SO4, хлорида алюминия AlCl3 и нитрата алюминия Al(NО3)3.
С концентрированными серной и соляной кислотами при комнатной температуре не взаимодействует, при нагревании реагирует с образованием соли, окислов и воды.
Алюминий и щелочи
Алюминий в водном растворе щелочи – гидроксида натрия – реагирует с образованием алюмината натрия.
Реакция алюминия с гидроксидом натрия имеет вид:
Все важнейшие реакции с алюминием
Для полноты информации приводим перечень основных реакций с участием алюминия из фундаментальной книги про алюминий [3]:

Важнейшие реакции с участием алюминия [3]
1. Chemical Elements. The first 118 elements, ordered alphabetically / ed. Wikipedians – 2018
2. Reaction of Aluminum with Water to Produce Hydrogen /John Petrovic and George Thomas, U.S. Department of Energy, 2008
3. Тринадцатый элемент: Энциклопедия / А. Дроздов – Библиотека РУСАЛа, 2007.
- ← Previous Алюминиевые сплавы 6060 и 6063
- Вторичный алюминий Next →
Источник: aluminium-guide.com