Металлы — относительно новый материал, применяемый в строительной технике, по сравнению с древесиной, камнем, керамикой.
Металлами называют вещества, обладающие металлическим блеском, высокой прочностью, пластичностью, электро- и теплопроводностью, ковкостью, свариваемостью. Такие признаки металлов обусловлены их кристаллическим строением и электронными межатомными связями.
Кроме чистых металлов в технике чаще применяют металлические сплавы.
Сплавы металлов (или металлические сплавы) — это твердые системы, полученные сплавлением нескольких металлов.
В настоящее время в технике используют более 10 тыс. сплавов.
Свойства сплавов обычно резко отличаются от свойств чистых металлов и их можно регулировать.
Металлы и сплавы будем называть единым термином «металлы».
Из имеющих практическую ценность для современной техники металлов в земной коре в значительных количествах содержатся: алюминий— 8,8%, железо— 4,65, магний— 2,1, титан— 6,3%. Сотыми и тысячными долями процента определяются природные запасы меди, марганца, хрома, цинка, свинца, никеля и других ценных металлов.
8. Цветные металлы. Окружающий мир — 2 класс
Металл — один из самых распространенных материалов во всех отраслях промышленности, в том числе и в строительстве. Производство металлов в значительной степени определят уровень технического прогресса в любой стране. Применение их в строительстве разнообразно. Из металла строят каркасы, мосты, фермы, балки перекрытий, резервуары, изготовляют трубы, арматуру для железобетона, водопроводную, отопительную и вентиляционную арматуру, кровельную сталь, металлочерепицу и профнастил, различные металлические изделия, заклепки, болты, гвозди и др.
Широкому использованию металлов в строительстве способствует ряд ценных технических свойств: высокая прочность, пластичность, технологичность — способность обработки давлением, резанием, свариванием. Вместе с тем металлы имеют существенные недостатки: при действии различных газов и влаги сильно коррозируют, действие „ высоких температур вызывает значительные деформации.
В настоящее время широко используются алюминиевые сплавы, отличающиеся богатой пластикой, малой плотностью, сравнительно высокой прочностью, коррозионной стойкостью и другими ценными свойствами.
Современная техника позволяет окрашивать металлы в любой цвет, придавать различную фактуру, что позволяет использовать металлические изделия как в городских ансамблях, мемориалах, внешней отделке зданий, так и в интерьерах (чеканки, светильники, бра, подвесные потолки, скульптурные панно, дверная и оконная арматура и т.д.
Металлы, применяемые в строительстве, разделяют на две основные группы: черные и цветные.
Черные металлы — это сплав железа с углеродом. Кроме того, черные металлы могут содержать в небольшом количестве марганец, серу, кремний, фосфор и другие химические элементы. Для улучшения свойств черных металлов к ним добавляют легирующие элементы (улучшающие) — медь, хром, никель и др.
Что Будет, Если СПЛАВИТЬ ВСЕ МЕТАЛЛЫ Вместе?
В зависимости от содержания в черных металлах углерода их подразделяют на чугун и сталь; на их долю приходится около 95% металлопродукции мирового производства.
Чугун — железоуглеродистый сплав, в котором углерода более 2% (2. 4,3%), содержащий постоянные примеси кремния, марганца, фосфора и серы. По назначению чугуны подразделяют на литейные, передельные и специальные (ферросплавы).
Литейный чугун является конструкционным материалом, из него изготовляют отливки различных строительных деталей.
Передельный чугун — промежуточный продукт, используемый для переработки в сталь.
Специальные чугуны с более высокими механическими свойствами применяют для изготовления чугунного литья специального назначения.
В зависимости от содержания примесей и формы, в которой углерод находится в чугуне, различают белый (передельный) и серый (литейный) чугуны. Эти названия соответствуют цвету чугуна.
В белом чугуне углерод химически связан с железом (карбид железа — цементит РезС). Белый чугун имеет высокую твердость, весьма хрупкий.
В сером чугуне углерод находится в свободном состоянии в виде графита (мелкий и хрупкий компонент). Серый чугун в расплавленном состоянии хорошо «течет», заполняет формы, дает малую усадку при затвердевании, легко поддается механической обработке.
Разновидность серого чугуна — модифицированный. Его получают путем введения в жидкий сплав серого чугуна модификаторов. Этот чугун обладает высокими механическими свойствами.
При длительном отжиге белого чугуна получают ковкий чугун. В отличие от серых ковкие чугуны более прочные и пластичные, легче обрабатываются.
Маркировка чугунов. Серый и модифицированный чугуны маркируют буквами СЧ, например СЧ 120-280. Первая цифра марки показывает, предел прочности при растяжении (МПа), вторая — предел прочности при изгибе (МПа).
Сталь — железоуглеродистый сплав, в котором углерода менее 2%. От хрупкого чугуна сталь отличается пластичностью и упругостью.
По способу производства стали подразделяют на конверторные, мартеновские и электростали, по химическому составу их делят на углеродистые и легированные.
В зависимости от содержания углерода стали делят на малоуглеродистые (до 0,25%), среднеуглеродистые (0,25. 0,6%) и высокоуглеродистые (более 0,6%).
Углеродистые стали бывают обыкновенного качества, качественные конструкционные (для ответственных строительных конструкций) и инструментальные (для изготовления деталей машин).
Сталь обыкновенного качества, в зависимости от ее свойств, делят на три группы А, Б и В. Углеродистую сталь, полученную различными способами, разделяют на спокойную (СП), полуспокойную (ПС) и кипящую (КП).
Легированные стали — стали, в состав которых входят легирующие элементы: хром, никель, вольфрам, титан, медь. Легирующие элементы значительно улучшают свойства сталей: повышается механическая прочность, закаливаемость, коррозионная стойкость.
Марганец увеличивает прочность, твердость и сопротивление стали износу; кремний и хром повышают прочность и жаростойкость; медь — стойкость к атмосферной коррозии; никель — вязкость без снижения прочности.
По суммарному содержанию добавок стали разделяют на низколегированные (до 2,5%), среднелегированные (2,5. 10%) и высоколегированные (более 10%). В строительстве чаще используют низколегированные стали.
Например, 30 ХМА — молибден-хромовая сталь высокого качества содержит 0,3% углерода, до 1% хрома и молибдена.
В табл. 6.1 приведены механические свойства углеродистой стали.
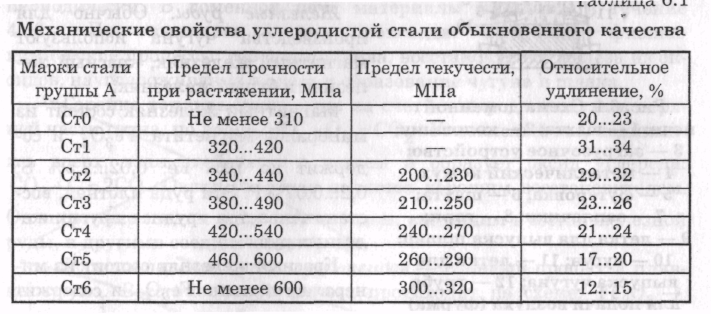
Цветные металлы. Подразделяются на легкие плотностью до 5 г/см 3 и тяжелые плотностью свыше 5 г/см 3 . В чистом виде цветные металлы практически не используют, чаще применяют их сплавы.
Легкие металлы — это алюминий, магний и их сплавы. Наибольшее распространение получили алюминиево-кремнеземистые, алюминиево-магниевые и сплавы типа дюралюминия и силумин.
Тяжелые металлы — медь и ее сплавы, цинк, свинец. Среди тяжелых сплавов применяют бронзу (сплав меди с оловом) и латунь (сплав меди с цинком).
Источник: studfile.net
Какие металлы называют
Все химические элементы в Периодической таблице делятся на металлы, неметаллы и полуметаллы. Металлы занимают большую часть и расположены слева от ступенчатой линии, неметаллы справа, а между ними располагаются полуметаллы — B, Si, Ge, As, Sb, Te, At.

На данном уроке рассмотрим металлы, в частности элементы IА – IIIА групп.
Все металлы блестящие, кроме ртути твердые, но пластичные и ковкие. Хорошо проводят тепло и электричество. В химических реакциях легко расстаются с электронами, передают их другим атомам. Чем легче происходит такая передача, тем металл активнее реагирует с другими веществами. Это свойство называется называется металличностью.
Металличность – это способность атомов отдавать электроны. Противоположно неметалличности – способности атомов принимать электроны. В периодах слева — направо металличность элементов уменьшается, а неметалличность увеличивается. В группах при перемещении сверху – вниз первое увеличивается, второе уменьшается.
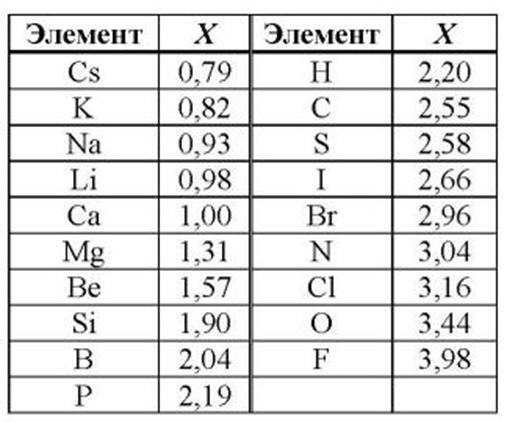
Из вышесказанного следует, что все металлы по сравнению с неметаллами обладают низкой электроотрицательностью, т.е. способностью атомов оттягивать к себе электроны других атомов. В химических реакциях металлы окисляются, являются восстановителями.

Общая характеристика металлов IA группы

Рассмотрим характеристику металлов IA группы (главной подгруппы I группы): литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr).
Их называют щелочными, поскольку при контакте с водой они образуют щелочи (гидроксиды), например, NaOH – едкий натр.
Сверху вниз в группе, с увеличением металличности металлов, реакции с водой начинают протекать бурно.
Так, если литий реагирует довольно спокойно, то калий взаимодействует со взрывом.
Общая характеристика щелочных металлов IA группы:
* Низкая электроотрицательность.
* Электронная конфигурация ns 1 , т.е. на внешнем энергетическом уровне только один электрон.
* Легкая ионизация атомов, с последующим образованием катионов (положительно заряженные ионы М+).
* Степень окисления +1.
Рассмотрим строение атомов щелочных металлов IA группы:

1. Литий (Li):
Электронная конфигурация в основном состоянии (ЭК в ОС): 1s 2 2s 1

2.Натрий (Na):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 1

3.Калий (K):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1

4.Рубидий (Rb):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1

5.Цезий (Cs):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6s 1

6. Франций (Fr):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 6p 6 7s 1

Общая характеристика металлов IIA группы

Данная группа содержит: бериллий (Be), магний (Mg) и щелочноземельные металлы: кальций (Ca), стронций (Sr), барий (Ba), радий (Ra).
Металлы активные, поэтому в природе в свободном состоянии не встречаются.
Самый распространенный среди них кальций, самый редкий – радиоактивный радий.
Многие соединения щелочноземельных металлов изоморфные, то есть сходны по форме и свойствам кристаллов.
Общая характеристика щелочноземельных металлов IIA группы:
* Низкая электроотрицательность.
* Электронная конфигурация ns 2 – конфигурация благородного газа гелия.
* Высокие значения ионизации атомов, убывающие по ряду Ве—Мg—Са—Sr— Ва.
* Степень окисления +2.
Рассмотрим строение атомов металлов IIA группы:

1. Бериллий (Be):
ЭК в ОС: 1s 2 2s 2

2.Магний (Mg):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2

3.Кальций (Ca):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2

4.Стронций (Sr):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 2

5.Барий (Ba):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 6 6s 2

6. Радий (Ra):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 6p 6 7s 2

Общая характеристика металлов IIIA группы

К данной группе относятся: бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl). Из них бор – неметалл. Алюминий, галлий и индий – амфотерные элементы – могут быть как донорами, проявляя кислотные свойства, так и акцепторами, проявляя основные свойства. Ну а таллий – типичный металл.
Общая характеристика элементов IIIA группы:
* Низкая электроотрицательность.
* Электронная конфигурация ns 2 np 1 . Три неспаренных электрона атомов данной группы, находящиеся в sp 2 -гибридизации, активно участвуют в образовании трех ковалентных связей. У атомов остается одна свободная орбиталь. Поэтому элементы IIIA группы образуют четвертую ковалентную связь по донорно-акцепторному механизму, находясь в состоянии sp 3 -гибридизации.
* Высокие значения ионизации атомов, убывающие по ряду Ве—Мg—Са—Sr— Ва.
* Степень окисления +3, для таллия наиболее устойчива степень +1.
Рассмотрим электронные конфигурации металлов IIIA группы в основном состоянии :

1.Бор (B):
ЭК в ОС: 1s 2 2s 2 2p 1

2.Алюминий (Al):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 1

3.Галлий (Ga):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 1

4. Индий (In):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 1

5.Таллий (Tl):
ЭК в ОС: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 6p 1
Источник: kardaeva.ru
Ряд активности металлов

Химия
Автор mednik На чтение 5 мин Просмотров 17.5к. Опубликовано 26 января, 2021
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический.
Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
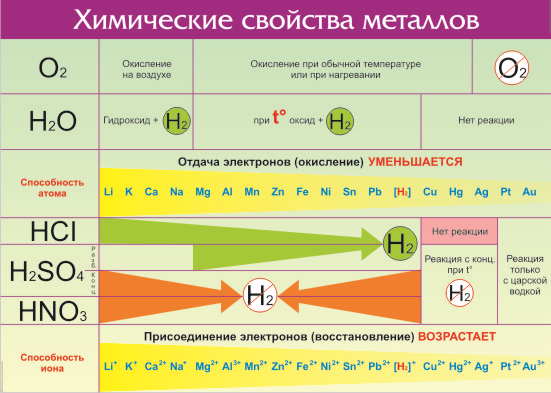
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.

Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
- Ртуть;
- Олово;
- Серебро;
- Никель;
- Рений;
- Медь;
- Марганец и еще несколько элементов.
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде.
Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.
Степень окисления и валентность
Щелочные металлы список и свойства
Алюминий это металл или неметалл
Типы химических связей
Как решать экономические задачи — алгоритм решения экономических задач егэ по математике профильный уровень
Химический состав клетки
Источник: novstudent.ru